Тканинна інженерія у реконструкції скронево-нижньощелепного суглоба
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Вступ
Реконструкція скронево-нижньощелепного суглоба (СНЩС) має багато викликів. Необхідно обережно підходити до розробки протоколів досліджень, щоб уникнути помилкових або сумнівних результатів. Також важливо правильно вибрати тип тварини для включення в дослідження. Помилки минулого, пов'язані з використанням силіконових та тефлонових матеріалів у СНЩС, стали ключовими уроками для майбутнього. Поступове зростання тканинної інженерії (ТІ) може стати обіцяючою сферою для нових біоматеріалів СНЩС, якщо основні принципи будуть дотримані для досягнення безпечних та ефективних рішень для СНЩС.
Модель тварини для тканинної інженерії скронево-нижньощелепного суглоба
Для покращення здоров'я людини наукові відкриття та технології повинні бути переведені в практичні застосування. Такі досягнення традиційно починаються з базових досліджень, а потім переходять на клінічний рівень. Внутрішньо притаманна розробці нових технологій роль доклінічних випробувань з використанням моделей тварин. Хоча жодна модель тварини не може повністю відтворити людські умови, моделі тварин є ключовими для оцінки механізмів захворювання, тестування нових технологій, застосування нових процедур та прогресу ТІ.
Відсутність добре встановленої модельної системи для дослідження скронево-нижньощелепного суглоба (СНЩС) була обмежуючим фактором для потенційного прогресу тканинної інженерії СНЩС. Вибір тварини для експериментального дизайну не є простим, в основному через фізіологічні та анатомічні відмінності. СНЩС є основною характеристикою, яка визначає клас ссавців і відокремлює ссавців від інших хребетних. СНЩС демонструє вражаючу морфологічну та функціональну варіацію між різними видами, що відображає не лише велику адаптацію ссавців до механізмів харчування, але й різну біомеханічну поведінку. Морфологічні варіації в основному корелюють з навантаженням (наприклад, розміром суглобових поверхонь) або рухом (наприклад, орієнтацією суглоба), або обома факторами. Навантаження СНЩС є реакційною силою, що виникає внаслідок скорочення жувальних м'язів; його величина сильно залежить від положення точки укусу відносно лінії дії м'язів. Багато доклінічних досліджень використовували лабораторних тварин, особливо гризунів; однак вони потрапляють до категорії мінімального навантаження СНЩС, особливо під час жування. На відміну від цього, хижаки, такі як собаки, витримують навантаження СНЩС, які вищі, ніж у приматів. Відкриття щелепи зазвичай передбачає комбінацію обертання та вперед ковзання (переміщення), але деякі хижаки втратили здатність ковзати, а деякі спеціалізовані мурахоїди натомість використовують обертання навколо довгої осі вигнутої щелепи. Найекстремальніші еволюційні варіанти включають втрату синовіальної порожнини у деяких китів з фільтрами; втрату (або, можливо, первісну відсутність) диска у монотремів, деяких сумчастих і беззубих (мурахоїдів і лінивців); варіації в орієнтації суглобової порожнини від сагітальної (багато гризунів) до поперечної (багато хижаків); реверсування звичайних опуклої/увігнутої відносини так, що processus condylaris стає жіночим елементом (багато парнокопитних, таких як вівці та велика рогата худоба). Крім того, розмір суглоба є надзвичайно змінним. Свині, вівці, кролики та мавпи використовувалися як моделі дефекту диска СНЩС у багатьох дослідженнях. Модель мавпи майже не використовується в останні роки, враховуючи високу вартість, складну хірургічну операцію та етичне схвалення. Кролик часто використовується як модель для досліджень зміщення диска. Однак ті ж обмеження присутні і в кролика: (1) малий розмір СНЩС, що ускладнює хірургічний доступ; (2) іноді потрібно видалити зигомати, щоб отримати доступ до суглоба; (3) навантаження СНЩС зменшене, що може викликати можливий упередженість у результатах. Найчастіше цитоване дослідження моделі зміщення диска СНЩС використовувало дорослих самців білих кроликів Нової Зеландії для хірургічного індукції переднього зміщення диска. Процедура вимагала розрізу над зигоматичним процесом і перелому зигоматичного процесу сквамозної скроневої кістки для доступу до суглоба. Сам хірургічний підхід міг вплинути на результати і є обмеженням цієї моделі.
Однією з основних причин, чому для вивчення хірургічних методів лікування СНЩС зазвичай використовують більших тварин, а не мишей, щурів і кроликів, є адекватний хірургічний доступ і адекватне навантаження на СНЩС, що підвищує точність можливих механічних випробувань. З цієї причини миші, щури і кролики представляють технічні виклики, які часто викликають питання щодо трансляційної релевантності до людського СНЩС, що виправдовує, чому ці тварини не рекомендуються для суворих доклінічних випробувань для ТЕ СНЩС.
У секції великих тварин історично свиня вважалася золотим стандартом, виходячи з загальних подібностей до людської анатомії, зокрема, розміру артикулярних структур СНЩС і форми диска. Крім того, нещодавнє комплексне дослідження підтвердило використання юкатанської мінісвині як модель тварини для досліджень ТЕ СНЩС. Однак зигомасна дуга захищає суглобовий простір у свині, що, на думку авторів, є обмеженням для використання цієї моделі. Більше того, біомеханічні сили мінісвинки можуть вплинути на результати.
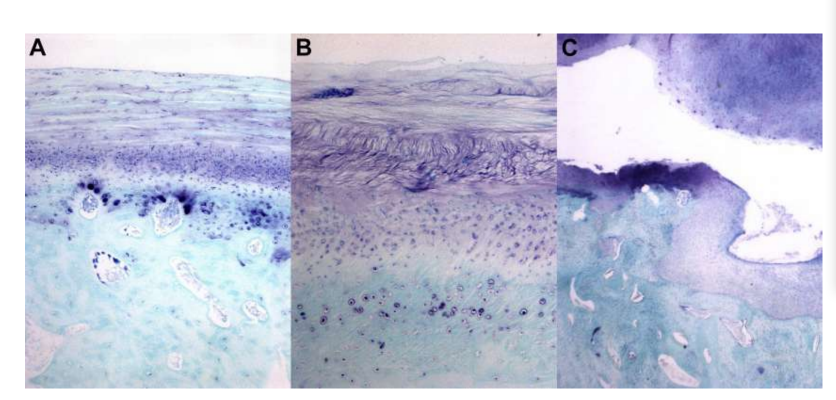
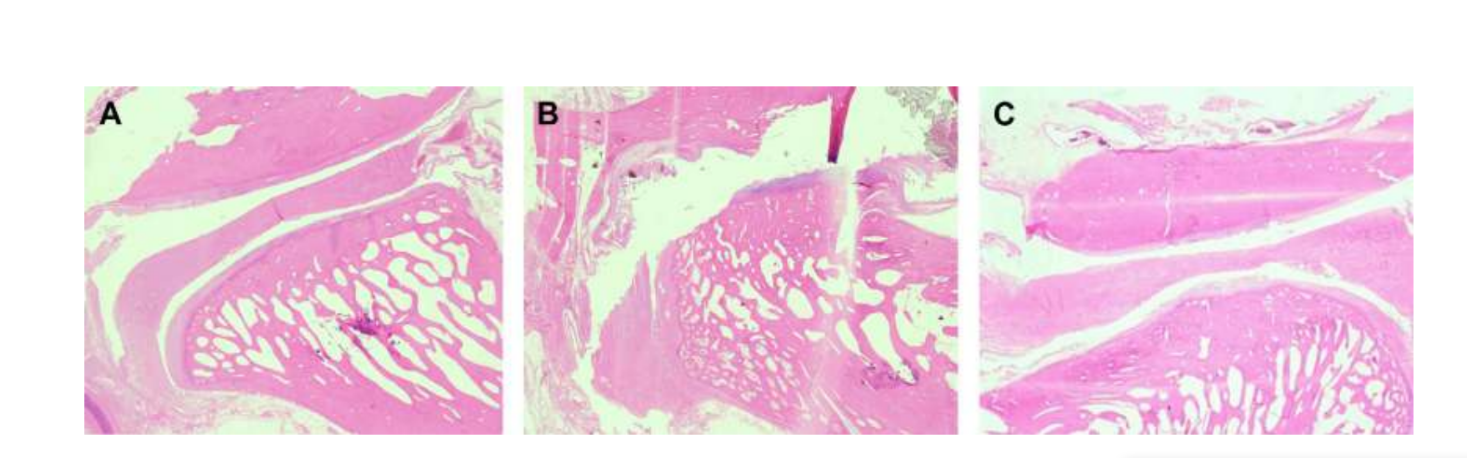
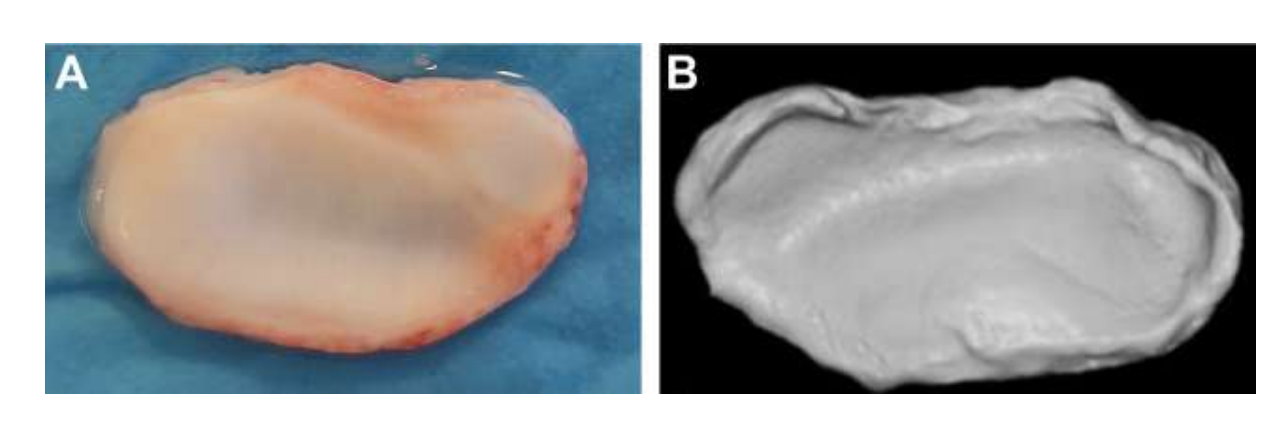
Анатомію, гістологію та біомеханіку скронево-нижньощелепного суглоба чорних меріносових овець також досліджували (Рис. 1). За допомогою передвушкового розрізу та тупої дисекції капсула скронево-нижньощелепного суглоба може бути легко доступна (Рис. 2 та 4), навіть для артроцентезу суглоба. Однією з переваг є те, що зигоматика не закриває суглобовий простір, як це відбувається у свиней. Диск скронево-нижньощелепного суглоба відокремлює верхню частину від нижньої (Рис. 3 та 4). Кондила овець медіолатерально увігнута з еліпсоїдною формою і з більшою віссю в медіолатеральному положенні (Рис. 5 та 6). Ці анатомічні подібності до людського скронево-нижньощелепного суглоба, пов'язані з великим досвідом у in-vivo хірургічному дослідженні суглоба, свідчать про те, що овець можна вважати придатною моделлю для проведення ретельних хірургічних досліджень суглоба.
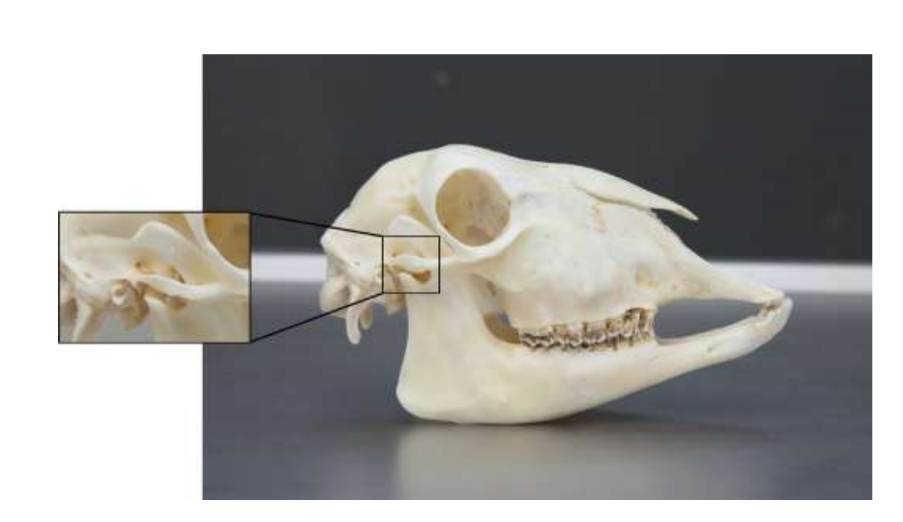
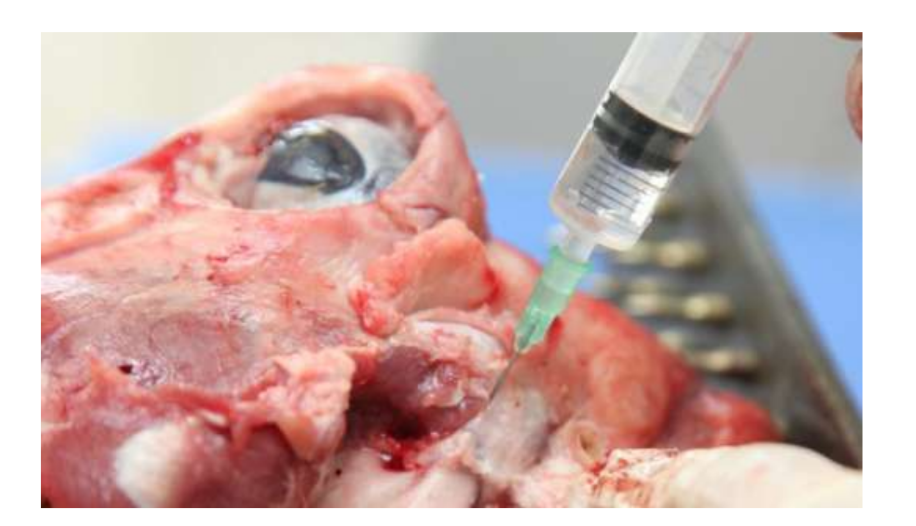
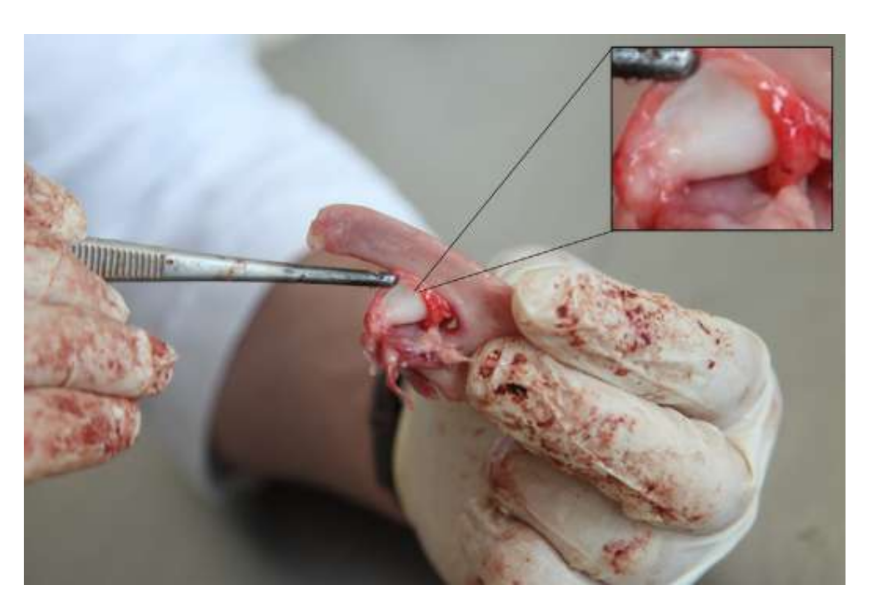
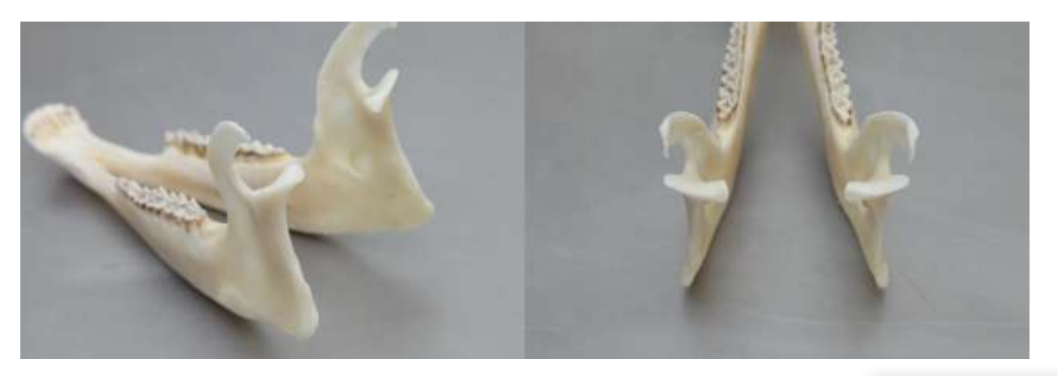
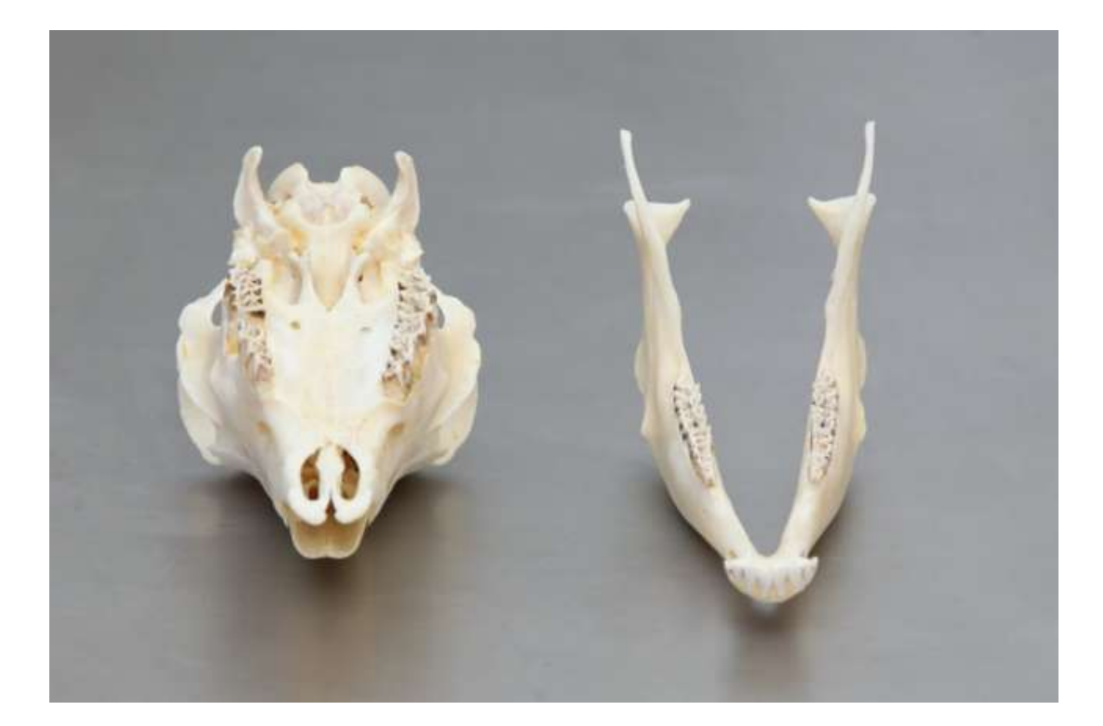
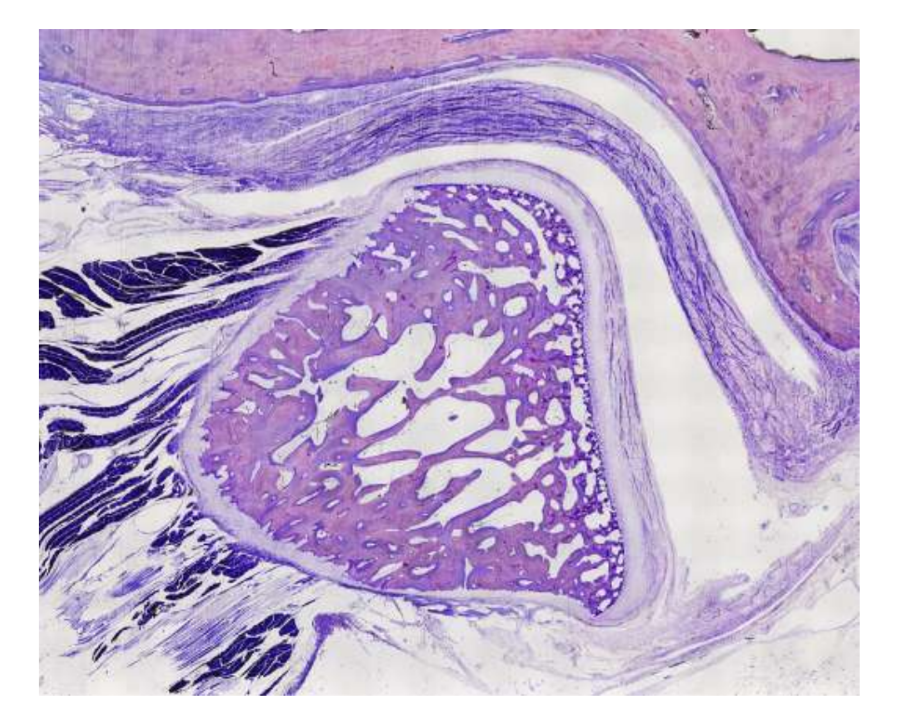
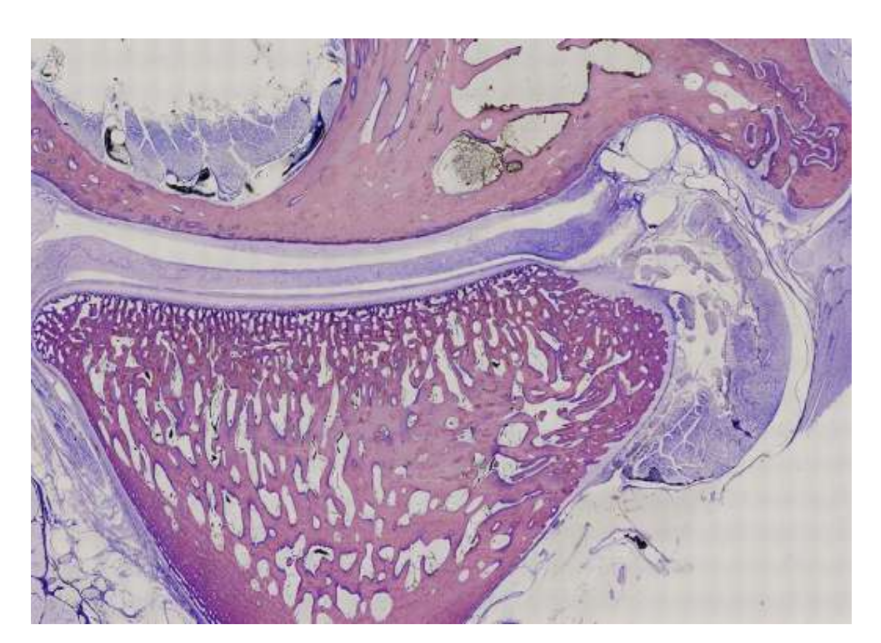
Вівці є дійсним варіантом для досліджень ТМЖ, враховуючи розмір ТМЖ, форму processus condylaris та fossa mandibularis, розмір диска, морфологію та прикріплення. Гістологічний аналіз має велике схожість з людським ТМЖ (Рис. 7 та 8). Ще одна важлива перевага моделі вівці полягає в процесі жування (Рис. 9), що забезпечує додаткове біомеханічне навантаження на ТМЖ, ідеально підходить для тестування in-vivo стійкості матеріалу ТЕ. Нещодавно модель тварини вівці була успішно використана в доклінічному дослідженні алопластичної реконструкції ТМЖ.

Хоча жоден вид не є золотим стандартом для всіх доклінічних досліджень ТМЖ ТЕ, вівці стали провідним варіантом. Мінісвині та сільськогосподарські свині можуть бути розглянуті, коли є достатні ресурси, служачи прийнятними альтернативами.
Дизайн дослідження для доклінічного інженерії тканин скронево-нижньощелепного суглоба
Відсутність ефективних варіантів для заміни диска ТМЖ може бути пов'язана з труднощами в трансляції доказів з тварин до клінічної практики у людей. Ці обмеження, ймовірно, пов'язані з наступними факторами:
- Використання гетерогенних моделей тварин з суперечливими результатами, можливо, через змінну анатомію та навантаження в суглобі між видами;
- Використання контралатерального ТМЖ як контролю, що може бути пов'язано з перевантаженням контралатеральної сторони;
- Біоматеріали, які використовуються для заміни диска, не враховують морфологічні та біомеханічні характеристики природного диска ТМЖ;
- Відсутність рандомізованих контрольованих випробувань з засліпленням оцінювачів результатів;
- Відсутність мультидисциплінарних команд, залучених до проекту.
Доклінічні дослідження повинні сприяти ефективному перенесенню знань у практику. Раніше згадані аспекти можуть обмежувати ефективний перехід якісних наукових знань у клінічну практику, і це може створювати потенційні проблеми для пацієнтів, клініцистів та наукового прогресу.
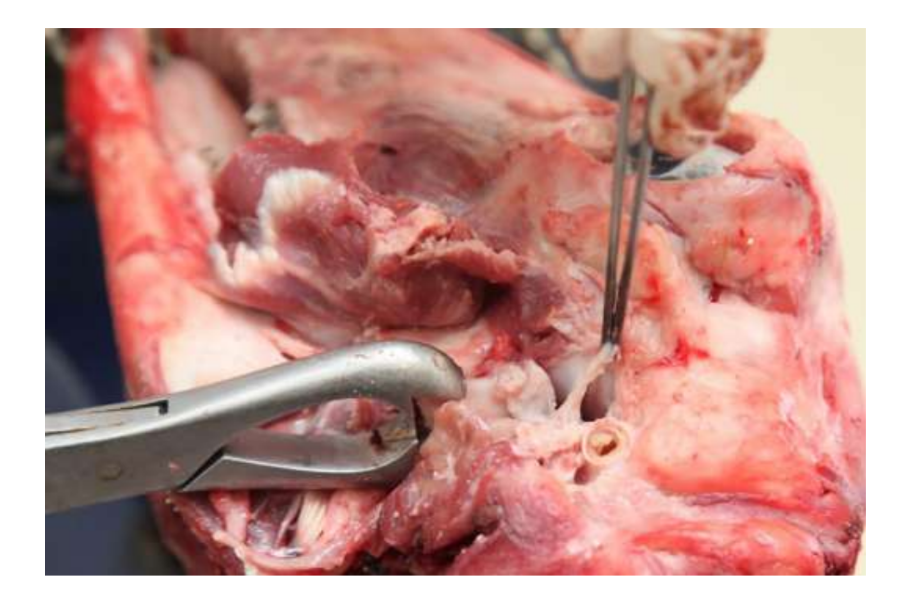
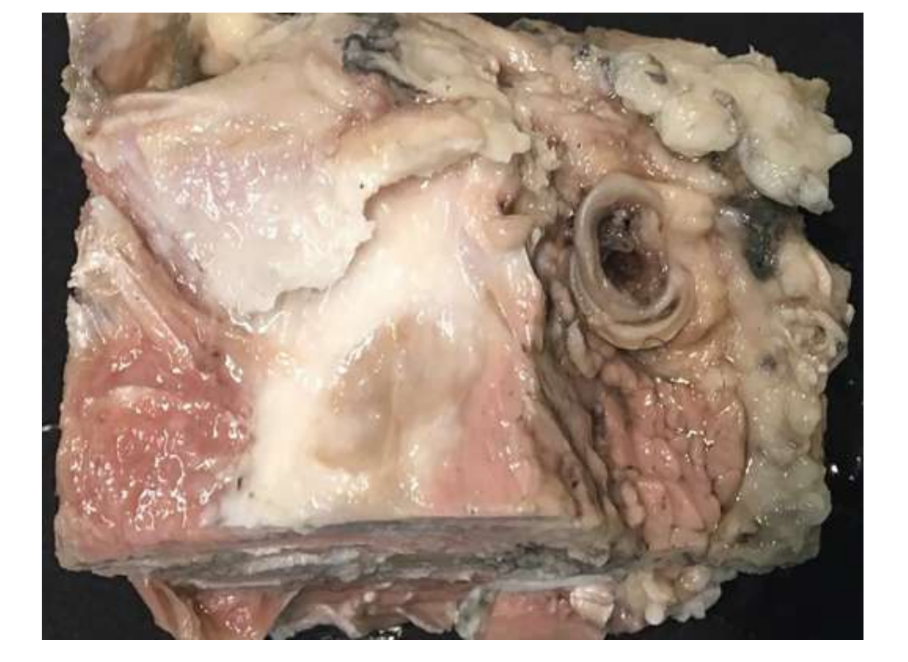
Сучасна відсутність успішних варіантів заміни диска скронево-нижньощелепного суглоба (TMJ) залишається серйозною проблемою для громадського здоров'я. За останнє десятиліття мало що змінилося в дизайні досліджень для вивчення TMJ, і лікування пацієнтів з важкими розладами скронево-нижньощелепного суглоба (TMD) залишається суперечливим. З цих причин майбутні дослідження повинні бути суворими в дизайні дослідження, дотримуючись рекомендацій ARRIVE. TEMPOJIMS є суворим доклінічним дослідженням, протокол якого доступний для публіки. Основним результатом повинна бути гістопатологічна аналіз. Для цього автори рекомендують обережно видаляти блок TMJ, як показано в Рис. 10. Підготовка гістологічного зразка є складною, але протокол добре деталізований нашою групою, більшість труднощів полягає в процесі декальцинації. Протокол дослідження був використаний у TEMPOJIMS фазі 1: порівняння результатів дисектомії TMJ, дископексії TMJ та імітаційної операції TMJ, отримуючи базу для інтерпретації майбутніх результатів TE диска TMJ.
Обґрунтування інженерії тканин скронево-нижньощелепного суглоба
Щоб обґрунтувати дослідження інженерії тканин у скронево-нижньощелепному суглобі, необхідно продемонструвати клінічну потребу в заміні диска суглоба. Наскільки відомо, дисектомія суглоба асоціюється з позитивними довгостроковими результатами, тож чому варто інвестувати час і ресурси в заміну диска суглоба?
Можливо, через те, що, крім сильних доказів, деякі результати щодо дисектомії є суперечливими. У попередніх доклінічних дослідженнях у цій галузі дослідники використовували контралатеральну неоперативну сторону як контроль та спірні моделі тварин. Використання контралатеральної сторони як контролю може бути недоречним, враховуючи вплив контралатерального навантаження. Теоретично, двосторонній підхід може зменшити упередженість. Варіабельність тварин у різних дослідженнях є попередженням про важливість використання однієї й тієї ж моделі тварин у подальших дослідженнях щодо ТМЖ ТЕ. Тому група авторів провела різноманітні доклінічні дослідження на чорних меріно, але перше дослідження було спрямоване на розуміння необхідності заміни диска ТМЖ, використовуючи контрольну групу з імітаційною операцією - TEMPOJIMS фаза 1.
Двостороння дисектомія ТМЖ у чорних меріно була проведена, і були виявлені серйозні зміни ТМЖ як за гістопатологічним, так і за іміджевим аналізом (Рис. 11 та 12). У післясмертній макроскопічній оцінці було виявлено серйозний дегенеративний процес (Рис. 13). У гістологічному аналізі дослідники підтвердили збільшення протеогліканів і округлих клітин, а також потовщення хряща після дисектомії. Також було виявлено більш серйозний синовіт після дисектомії, що вказує на можливий запальний процес. Структурно були виявлені відмінності у формі, склерозі кондилю, склерозі скроневої кістки, кістковому мозку кондилю, ерозії скроневої кістки, ерозії кондилю та кістковому мозку скроневої кістки (Рис. 14). Однак дисектомія мала ефект лише на абсолютний час жування, час жування за цикл та площу жування в перші 2 місяці, а після початкового періоду значних змін не було помічено. У Macaca fascicularis Яйлен та колеги після односторонньої дисектомії описали анкілоз між кондилем та скроневою кісткою. У клінічних дослідженнях аф Бйоркестен та Боман у 1947 році були першими дослідниками, які повідомили про рентгенографічні морфологічні зміни, викликані дисектомією, описуючи "плоскість суглобової поверхні". У 1980-х роках були описані серйозні сплющення кондилю та склероз у пацієнтів після дисектомії. Пізніше Ерікссон та Вестессон у огляді 52 пацієнтів також підтвердили, що більшість суглобів показали рентгенографічні ознаки остеофітів, сплющення та склерозу.
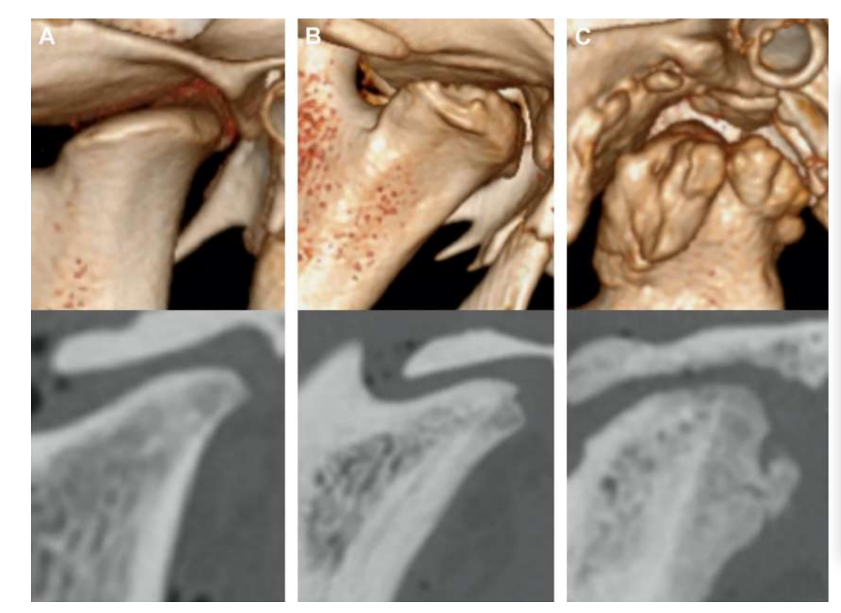
Бйорнланд і Ларгейм описали фіброзний анкілоз через 6 місяців після односторонньої дисектомії. Разом ці результати підкреслили важливість вивчення ефективного матеріалу для заміни диска скронево-нижньощелепного суглоба.
Імплантати з тканинної інженерії
Спроба замінити диск скронево-нижньощелепного суглоба почала вивчатися приблизно в середині 1960-х і 1970-х років. Першими матеріалами, які тестували, були силіконовий каучук (Dow-Corning, Midland, MI, USA) та Proplast-Teflon (Vitek, Inc, Houston, TX, USA). Силіконовий каучук був введений Робінсоном у 1968 році в сферах естетичної хірургії, заміни суглобів та оральної і щелепно-лицевої реконструктивної хірургії. Хоча цей матеріал має цікаві властивості легкого оброблення та доброї стійкості і еластичності, його використання швидко відмовилися. У деяких пацієнтів спостерігалися серйозні імунні реакції, такі як реакції на силіконові частинки та синовіт. Замінник силіконового диска також асоціювався з міграцією цього матеріалу в сусідні тканини. У овець імплантація листа силікону (імплантат з силіконового каучуку) призвела до руйнування кістки у всіх 4 оперованих суглобах і супроводжувалася реакцією на чужорідне тіло в капсулі з фіброзної тканини, яка утворилася навколо імплантату. Також Сандерс та колеги в повторній оцінці 30 пацієнтів повідомили про фіброзну капсулу як псевдодиск і фіброзний бар'єр між кондилем і ямкою.
Proplast-тефлон (політетрафлуороетилен або PTFE) також був іншим матеріалом, що використовувався як заміна диска СКЩ. Введений у 1976 році доктором Чарльзом Хомсі, він був представлений як стабільний і пористий матеріал, що дозволяє адгезію клітин. Однак цей матеріал швидко зношувався, викликаючи серйозні реакції, включаючи гранульоми чужорідного тіла, фіброз, морфологічні зміни в кондилі та біль. У 1990 році Управління з контролю за продуктами і ліками рекомендувало видаляти ці імплантати у випадках, коли спостерігалися дегенеративні зміни в СКЩ.
У зв'язку з наслідками невдач цих замінних матеріалів, ТЕ набуває все більшого значення, представляючи можливий життєздатний шлях до заміни диска СКЩ. Ефективний і безпечний суглобовий диск повинен відповідати деяким критеріям, таким як:
- Біорозкладність, щоб дозволити заміну відповідною тканиною, та біосумісність з господарем, щоб уникнути запальної реакції;
- Висока вантажопідйомність, щоб витримувати механічні сили;
- Відповідна пористість і поверхнева хімія для диференціації клітин та для забезпечення транспорту і обміну кисню, поживних речовин і відходів.
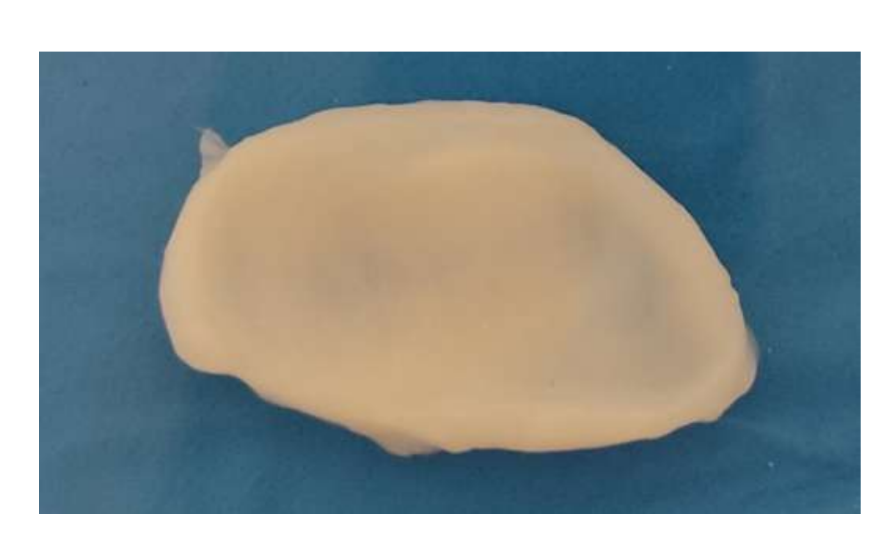
У цьому контексті автори охарактеризували морфологічну, гістологічну та біомеханічну характеристику диска скронево-нижньощелепного суглоба (Рис. 15). Результати цього дослідження були надзвичайно важливими для розуміння геометрії та біомеханічних і біологічних властивостей суглобового диска з метою розробки матеріалів для заміни. Насправді, великою проблемою тканинної інженерії було розробити стратегію, в якій біоматеріал містив би всі ці характеристики. У випадку зі скронево-нижньощелепним суглобом дослідження зосереджувалися на 2 типах біоматеріалів: синтетичних та натуральних.
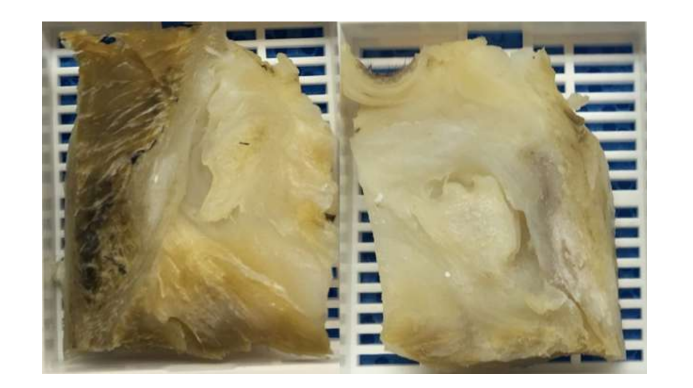
Природні біоматеріали походять з природних джерел і мають найкращі біологічні властивості, такі як біосумісність, біорозкладність і біоактивність, а також сприяють адгезії, проліферації та диференціації клітин, що є необхідним для тканинної інженерії. Однак вони зазвичай мають гірші механічні властивості та більші труднощі в обробці матеріалів. Через ці труднощі небагато досліджень продемонстрували потенційне використання цих біоматеріалів у щелепно-лицевому суглобі. Перше пілотне дослідження використовувало гібрид фібрину/хітозану в поєднанні з синовіальними стовбуровими клітинами щелепно-лицевого суглоба. Дослідники показали сприяння депозиції позаклітинного матриксу з імплантацією каркасу у мишей. Незважаючи на ці обнадійливі результати, дослідження не було продовжено, і багато в чому це могло бути пов'язано з тим, що після 7 дня посіву клітин кількість клітин почала різко зменшуватися. В іншому дослідженні була оцінена комбінація каркасу з колагенової губки та аутологічних мезенхімальних клітин кісткового мозку у перфорованих дисках щелепно-лицевого суглоба японських кроликів. Дослідники спостерігали утворення нової сполучної тканини через 2 тижні, тоді як у контрольній групі через 8 тижнів перфорація ще не закрилася повністю. Однак, як вже згадувалося, використання кроликів/мишей у цьому типі досліджень має багато обмежень. Алгінат також вивчався в інвітро підході з клітинами диска щелепно-лицевого суглоба, але результати не були обнадійливими, і утворення колагену або ГАГ не було підтверджено, а кількість клітин зменшувалася з часом. Іншою стратегією, яка була досліджена, є деклітинізований позаклітинний матрикс (dECM). dECM має чудові властивості, зберігаючи природні органічні та механічні властивості, такі як колагенова мережа тканини, оскільки імуногенні компоненти видаляються, щоб дозволити адгезію та проліферацію клітин. Небагато досліджень зосереджено на найкращому методі ефективної деклітинізації диска щелепно-лицевого суглоба. Нещодавно був вироблений ін'єкційний гідрогель на основі деклітинізованих дисків щелепно-лицевого суглоба свиней, який був введений у мишу. Гідрогель показав хорошу цитосумісність, і лише незначне запалення було спостережено протягом 7 днів після імплантації. Однак цьому дослідженню бракує перевірки терапевтичної ефективності. Дослідження, пов'язані з найбільш ефективним протоколом деклітинізації диска, є рідкісними. Таким чином, дослідницька група авторів в даний час активно вивчає інші методи деклітинізації дисків чорної меріно (Рис. 16), такі як хімічні, фізичні та ензимні, з метою знайти найбільш ефективну стратегію.
Синтетичні біоматеріали в порівнянні з натуральними мають недоліки в структурних відмінностях у порівнянні з рідною тканиною та можливими ускладненнями, пов'язаними з токсичністю та біосумісністю. Однак вони мають деякі суттєві переваги, такі як вища доступність, легше оброблення та кращі біомеханічні та фізичні властивості. З цих причин синтетичні матеріали досліджуються як замінники дисків ТМЖ.
Полілактид (PLA), який має більш тривалий час деградації, був одним з перших синтетичних матеріалів, що вивчалися. PLA у поєднанні з адипоцитарними стовбуровими клітинами збільшив експресію агрекану та коллагену типу I і II в хондрогенному середовищі, але ступінь диференціації клітин був нижчим у порівнянні з клітинами, отриманими з диска ТМЖ.
Полігліколева кислота (PGA) також є біорозкладним полімером, що вивчається в області ТМЖ. Клітини диска ТМЖ свиней були висіяні на каркас PGA, і було підтверджено збільшення виробництва матриці. Інші дослідники висунули гіпотезу, що неткані сітки полі-L-молочної кислоти (PLLA) обмежать скорочення, дозволять провести всебічну механічну оцінку та підтримають життєздатність у порівнянні з контролями нетканих сіток PGA. Ці останні конструкції мали здатність підтримувати свій об'єм протягом
6 тижнів, у порівнянні з PGA, але мали низьку механічну міцність. Полі(ε-капролактон) (PCL) є ще одним біоматеріалом, який вивчався через їх повільну деградацію. Каркаси PCL, де орієнтація волокон представляла коллагенову мережу, були інкапсульовані мікросферами
фактору росту сполучної тканини (CTGF) та трансформуючого фактора росту бета 3 (TGFb3). Коли цей каркас культивували з людськими мезенхімальними стовбуровими/попередніми клітинами, він виявився ефективним у створенні гетерогенної фіброзно-хрящової матриці та візкоеластичних властивостей. Дослідники зазначають, що необхідно провести тести на деградацію каркасів in vivo та в довгостроковій перспективі. Цзян та колеги вивчали гідрогель полі(vinyl alcohol), зшитий циклічним заморожуванням та відтаванням, і зміцнений тривимірним (3D) PCL, який імплантували в кіз на 12 тижнів. Дослідники описали цей замінник як такий, що здатний підтримувати стабільність суглоба та захищати кондиларний хрящ і кістку від пошкоджень. Однак також було повідомлено про прорастання волокнистої тканини в навколишній області PCL. Насправді, PCL, здається, не має ідеальних властивостей для використання в якості замінника в проведених роботах. Дослідницька група авторів також вивчала біоматеріали на основі каркасів та гідрогелів, що імітують диск TMJ чорних меріносів, використовуючи різні матеріали, PCL та поліетиленгліколь діакрилат (PEGDA), а також як багатоматеріальну структуру, що поєднує PEGDA з 3D-друкованими каркасами PCL (Рис. 17). Результати авторів продемонстрували, що гідрогель PEGDA як ядро в каркасі більш точно імітує механічні властивості рідної тканини (Рис. 18). Нещодавно були розроблені імплантати диска TMJ, адаптовані до 3D, та імплантовані в чорних меріносів:
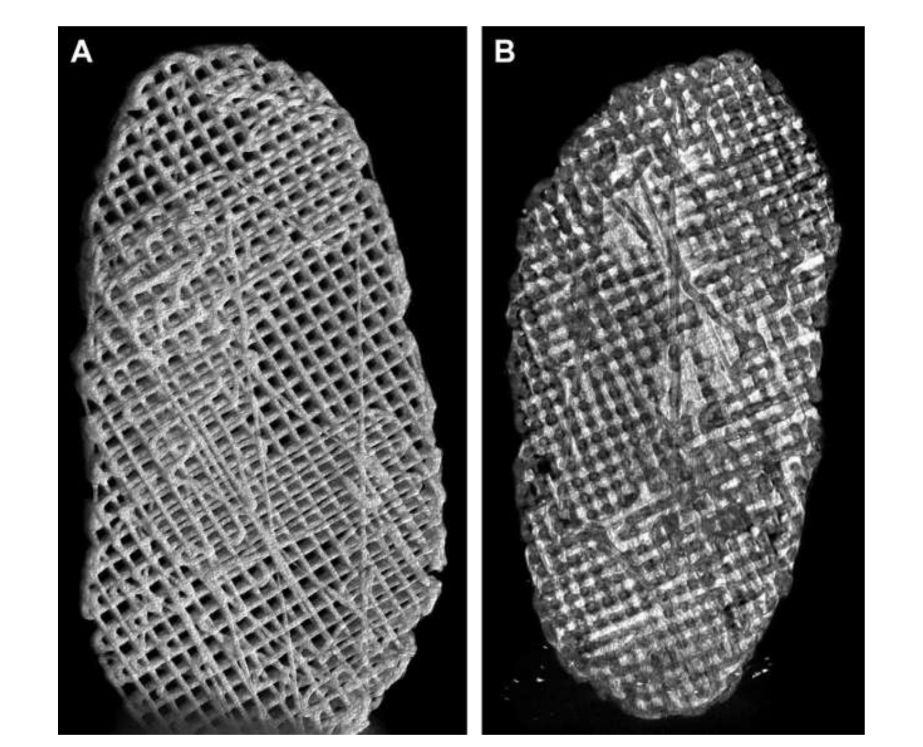
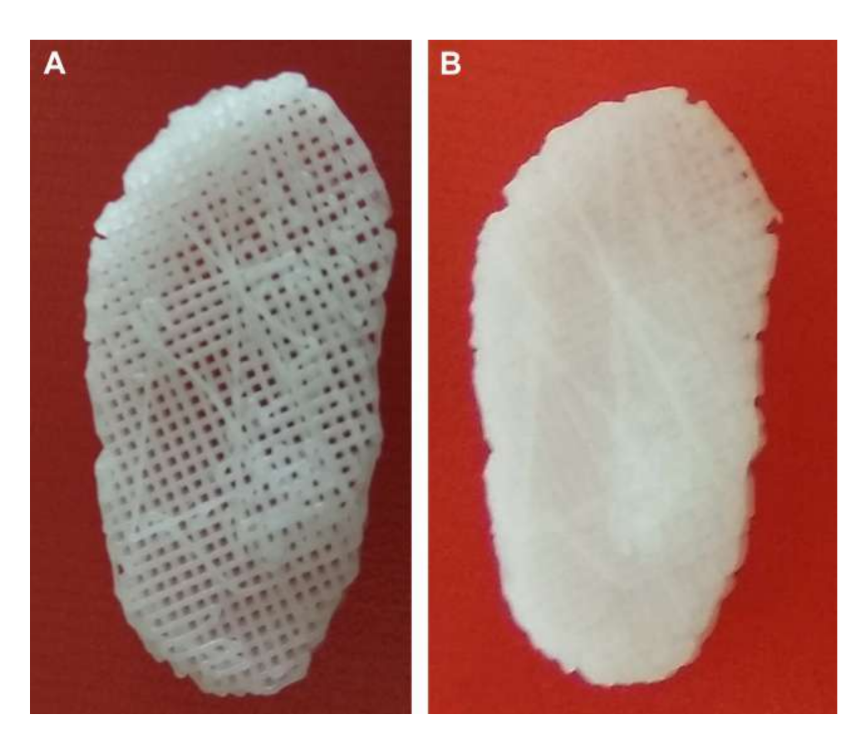
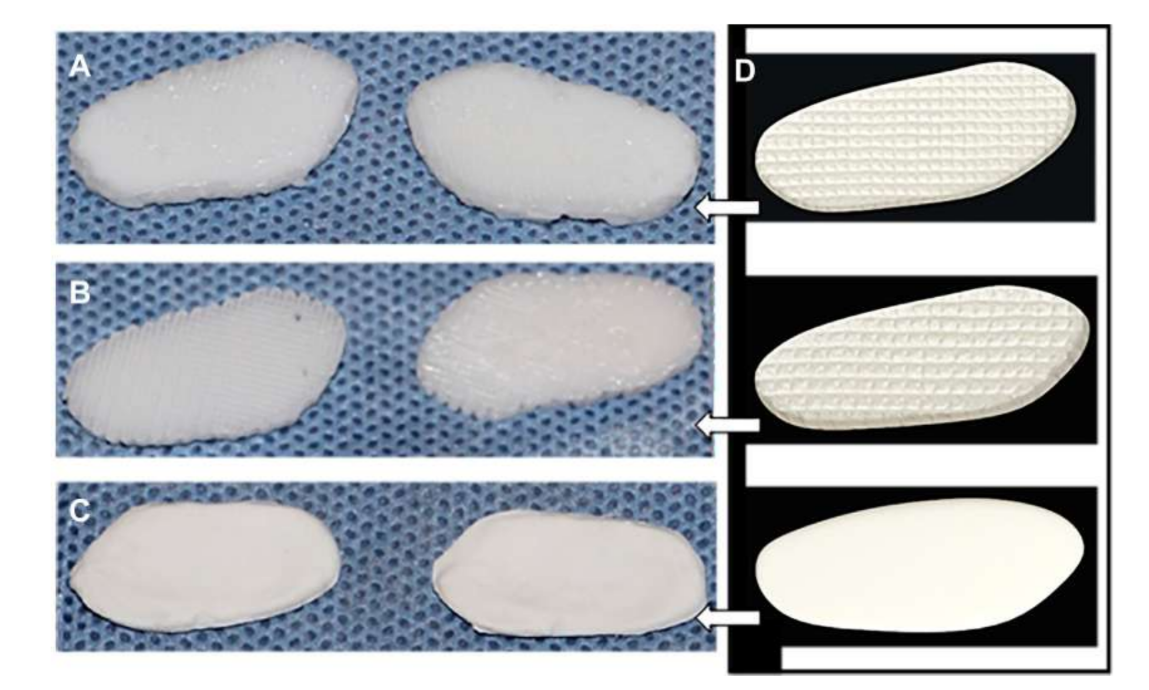
(1) Полі(гліцерол себакат) (PGS) каркас, зміцнений електроспіненими волокнами PCL на зовнішній поверхні (PGS + PCL); (2) PCL та PEGDA (PCL + PEGDA); та (3) PCL (Рис. 19 та 20). Результати показали, що диски PCL та PCL + PEGDA мали вищий ризик збільшення дегенеративних змін через фрагментацію матеріалу. Жоден з протестованих дисків не регенерував новий аутологічний диск; однак PGS + PCL був безпечним, продемонстрував швидку резорбцію та був здатний запобігати дегенеративним змінам в кондилі. Хагандора в дослідженні in vitro також вказав на чудову властивість PGS, враховуючи, що фіброхондроцити реагують на застосування механічних сил, виробляючи підвищені кількості позаклітинного матриксу.

Незважаючи на дослідження, які проводилися в останні роки, біоматеріал, що відповідає всім необхідним характеристикам для заміни диска СНЩС, досі не доступний для клінічних випробувань. Очікується, що в найближчі кілька років це стане можливим.
Ще одна важлива галузь досліджень тканинної інженерії (TE) пов'язана з мультипотентними клітинами. Серед цих клітин найбільш вивченими є мезенхімальні стовбурові клітини (MSC), особливо в лікуванні остеоартриту СНЩС (TMD). Походячи з різних тканин, включаючи кістки, жирову тканину та синовіальну оболонку, MSC мають численні властивості: хондрогенна диференціація, протизапальна активність, регенерація фіброзного хряща та остеогенна диференціація. Незважаючи на деякі обнадійливі результати в захисті остеоартриту та резорбції кондилів, дослідження в основному базуються на внутрішньосуглобових ін'єкціях. Використання цих клітин у регенерації суглобового диска є рідкісним і в основному застосовується разом з іншими біоматеріалами. У кроликів Атіайнен та колеги розробили диск з PLA з жировими стовбуровими клітинами та спостерігали, що ці клітини покращили морфологічний малюнок кістки, більш схожий на природний, і спостерігалася регенерація сусідньої тканини. Нещодавно було розроблено дослідження, яке використовувало стовбурові клітини, отримані з жирової тканини, для диференціації цих клітин у клітини диска СНЩС за допомогою лазерної індукції. Більше 90% клітин були життєздатними з фібробластичними та хондрогенними фенотипами. Застосування цього підходу не було реалізовано в in vivo випробуваннях. У пілотному дослідженні, використовуючи гібридні каркаси з фібрину/хітозану з мезенхімальними стовбуровими клітинами, отриманими з синовіальної оболонки, дослідники спостерігали регенеративну здатність та надекспресію у щурів з перфорацією диска СНЩС. Стовбурові клітини зубного пульпи також використовувалися в каркасах з хітозану/альгінату та оцінювалися в in vitro культурі. Ці стовбурові клітини показали підвищений модуль зберігання та еластичні властивості, що збільшило адгезію клітин та експресію маркерів фіброзного хряща. Однак їхня ефективність у in vivo випробуваннях ще має бути продемонстрована. Також мультипотентні мезенхімальні стромальні клітини ідентифіковані та ізольовані з дисків СНЩС і продемонстрували здатність до проліферації та диференціації. У найближчому майбутньому очікується, що дослідження з цими клітинами покажуть ефективність у регенерації диска СНЩС.
Для покращення властивостей, показаних стовбуровими клітинами та каркасами, були вивчені деякі фактори росту з метою покращення диференціації, проліферації, виробництва ГАГ та колагену. Найбільш помітними факторами росту є судинний ендотеліальний фактор росту, білок морфогенетичний кістки-2, фактор росту фібробластів (FGF), TGF-b1, білок групи високої рухливості 1, інсуліноподібний фактор росту-1 (IGF-1); фактор росту, похідний тромбоцитів, епідермальний фактор росту, інтерлейкін 1 та фактор некрозу пухлин альфа. У літературі деякі дослідники вивчали потенціал вбудовування цих факторів росту в різні каркаси. ДетаМор і Афанасіу були піонерами, які включили 3 фактори росту (FGF, TGF-b та IGF) у каркаси PGA. Усі фактори росту покращили механічну та структурну цілісність; однак IGF та TGF-b були найбільш ефективними у сприянні синтезу колагену. У каркасах PLLA, оброблених IGF1 або TGF-b1 або TGF-b3, результати були кращими, при цьому TGF-b1 сприяло більшій кількості клітин, колагену та глікозаміногліканів. PCL також був інкапсульований мікросферами CTGF та TGFb3. Коли його вирощували з людськими мезенхімальними стовбуровими/попередніми клітинами, цей каркас був ефективним у генерації гетерогенної фіброзно-хрящової матриці та візкоеластичних властивостей. У майбутньому очікується можливість дослідження цього концепту, вбудовуючи біоматеріали зі стовбуровими клітинами та факторами росту; однак бюрократичні та етичні обмеження повинні бути переглянуті, щоб підкріпити очікування використання цих технік у людей.
Резюме
Попит на заміну диска скронево-нижньощелепного суглоба продовжує залишатися великою проблемою сьогодні. Велика складність полягає в розробці біоматеріалу, який має біомеханічні та біохімічні властивості, щоб стати життєздатною альтернативою.
Область тканинної інженерії активно сприяла можливості досягнення нових результатів у пошуках нового та довговічного тканини, яка ефективно замінює/регенерує диск ТМЩ. Дослідження повинні враховувати природні властивості диска, такі як механічні, фізичні та біологічні. Стандартизація досліджень на великих тваринах, таких як вівці та свині, також повинна бути застосована.
Хоча ще не вдалося досягти ідеального біоматеріалу, робота, проведена в останні роки, робить можливим, що ця мета ближча.
Давид Фаустіно Âнгело, Флоренсіо Монхе Гіл
Посилання
- Херрінг СВ. Анатомія скронево-нижньощелепного суглоба та моделі тварин. J Musculoskelet neuronal interactions 2003;3(4):391-407.
- Наполес ВЛ. Морфологія, еволюція та функція годування у великого мурахоїда (Myrmecophaga tridactyla). J Zool 1999;249(1): 19-41.
- Лі ЙК, Мун ХД. Взаємний вплив жувального апарату, черепно-лицевої структури та гомеостазу всього тіла. Med Hypotheses 2012;79(6):761-6.
- Херрінг СВ, Лю ЗД. Навантаження скронево-нижньощелепного суглоба: анатомічні та in vivo докази з кісток. Cells Tissues Organs 2001;169(3):193-200.
- Босанкет А, Ісімару Дж, Госс АН. Вплив експериментальної перфорації диска в скронево-нижньощелепних суглобах овець. Int J Oral Maxill Surg 1991;20(3):177-81.
- Босанкет АГ, Госс АН. Вівця як модель для хірургії скронево-нижньощелепного суглоба. Int J Oral Maxill Surg 1987;16(5):600-3.
- Ісімару Дж-І, Госс АН. Модель остеоартриту скронево-нижньощелепного суглоба. J Oral Maxillofacial Surg 1992;50(11):1191-5.
- Лонг Х, Госс АН. Модель овець для внутрішньосуглобового перелому кондилю. J Oral Maxillofac Surg 2007;65(6):1102-8.
- Хельгеланд Е, Шанбхаг С, Педерсен ТО та ін. Регенерація тканин скронево-нижньощелепного суглоба на основі каркасів у експериментальних моделях тварин: систематичний огляд. Tissue Eng B Rev 2018;24(4): 300-16.
- Ван КХ, Чан ВП, Чіу ЛХ та ін. Гістологічні та імуногістохімічні аналізи відновлення диска в скронево-нижньощелепному суглобі кролика з використанням колагенового шаблону. Materials (Basel) 2017; 10(8).
- Шараві ММ, Хелмі ЕС, Бейс РА та ін. Відновлення перфорації диска скронево-нижньощелепного суглоба з використанням клаптя синовіальної мембрани у мавп Macaca fascicularis: дослідження світлової та електронної мікроскопії. J Oral Maxillofac Surg 1994;52(3):259-70.
- Алі АМ, Шараві ММ. Гістопатологічні зміни в кроликовому краніомандібулярному суглобі, пов'язані з експериментально індукованим переднім зміщенням диска (ADD). J Oral Pathol Med 1994;23(8): 364-74.
- Міллс ДК, Даніель ДжК, Герцог С та ін. Модель тварини для вивчення механізмів у людському порушенні диска скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 1994;52(12):1279-92.
- Талентс РХ, Мачер ДЖ, Ріволі П та ін. Модель тварини для зміщення диска. J Craniomandib Disord 1990;4(4):233-40.
- Легрелл ПЕ, Ісберг А. Асиметрія висоти нижньої щелепи після експериментально індукованого зміщення диска скронево-нижньощелепного суглоба у кроликів. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;86(3):280-5.
- Сінделар БД, Херрінг СВ. Механіка м'яких тканин скронево-нижньощелепного суглоба. Cells Tissues Organs 2005;180(1):36-43.
- Сунь З, Лю ЗД, Херрінг СВ. Рух тканин скронево-нижньощелепного суглоба під час жування та пасивної маніпуляції у мініатюрних свиней. Arch Oral Biol 2002;47(4):293-305.
- Херрінг СВ, Декер ДжД, Лю ЗД та ін. Скронево-нижньощелепний суглоб у мініатюрних свиней: анатомія, клітинна реплікація та зв'язок з навантаженням. Anat Rec 2002;266(3):152-66.
- Лю ЗД, Херрінг СВ. Жувальні навантаження на кісткові та зв'язкові компоненти скронево-нижньощелепного суглоба у мініатюрних свиней. J Orofac Pain 2000;14(4):265-78.
- Сінделар БД, Еванко СП, Алонсо Т та ін. Вплив носіння внутрішньоротового шини на протеоглікани в диску скронево-нижньощелепного суглоба. Arch Biochem Biophys 2000;379(1):64-70.
- Вапніарський Н, Аряєй А, Арзі Б та ін. Структурно-функціональні зв'язки диска скронево-нижньощелепного суглоба юкатанського мінісвина підтримують його придатність для порівняльних досліджень у людей. Tissue Eng C Methods 2017;23(11):700-9.
- Тома КХ. Гіперостоз кондилю нижньої щелепи: з описом двох випадків. Am J Orthod Oral Surg 1945;31(10):597-607.
- Анджело ДФ, Мороуко П, Алвес Н та ін. Вибір овець (Ovis aries) як моделі тварини для дослідження скронево-нижньощелепного суглоба: морфологічна, гістологічна та біомеханічна характеристика диска суглоба. Morphologie 2016;100(331):223-33.
- Анджело ДФ, Монхе ФГ, Гонсалес-Гарсія Р та ін. Біоінженерні імплантати диска скронево-нижньощелепного суглоба: протокол дослідження для двофазного експлораційного рандомізованого передкліничного пілотного випробування на 18 чорних меріно. JMIR Res Protoc 2017;6(3):e37.
- Херрінг СВ. Анатомія скронево-нижньощелепного суглоба та моделі тварин. J Musculoskelet Neuronal Interactions 2003;3(4):391-4.
- Де Мюреші Н, Моммарц М. Аллопластичні системи заміщення скронево-нижньощелепного суглоба: систематичний огляд їх історії. Int J Oral Maxill Surg 2018;47.
- Анджело ДФ, Мороуко П, Монхе Гіл Ф та ін. Передкліничне рандомізоване контрольоване випробування двосторонньої дисектомії проти двосторонньої дископексії у скронево-нижньощелепному суглобі чорних меріно: TEMPOJIMS - фаза 1 - гістологічні, іміджеві та результати ваги тіла. J Craniomaxillofac Surg 2018;46(4):688-96.
- Коен ВА, Сервейс ДжМ, Полур І та ін. Деградація суглобового хряща в контралатеральному неоперативному скронево-нижньощелепному суглобі у мишей з односторонньою частковою дисектомією. J Oral Pathol Med 2014; 43(2):162-5.
- Ахтіайнен К, Маун Дж, Елла В та ін. Автологічні стовбурові клітини жирової тканини та полілактидні диски в заміні диска скронево-нижньощелепного суглоба у кролика. J R Soc Interf 2013;10(85):20130287.
- Бйорнланд Т, Хаанес ХР. Дисектомія скронево-нижньощелепного суглоба: експериментальне дослідження на мавпах. J Craniomaxillofac Surg 1999;27(2):113-6.
- Лі Л, Ван Л, Сунь Й та ін. Встановлення та гістологічна оцінка моделі травматичного скронево-нижньощелепного суглоба у кіз. J Oral Maxillofac Surg 2015;73(5):943-50.
- Сюй Л, Полур І, Лім Ц та ін. Ранній остеоартрит скронево-нижньощелепного суглоба миші, індукований частковою дисектомією. Osteoarthritis Cartil 2009;17(7):917-22.
- Димітруліс Г, Славін Дж. Впливи односторонньої дисектомії та кондилектомії на контралатеральний інтактний краніомандібулярний суглоб кролика. J Oral Maxillofac Surg 2006;64(8):1261-6.
- Анджело ДФ, Гіл ФМ, Гонсалес-Гарсія Р та ін. Впливи двосторонньої дисектомії та двосторонньої дископексії на кінематику жування чорних меріно: TEMPOJIMS - фаза 1 - пілотне сліпе, рандомізоване передкліничне дослідження. J Craniomaxillofac Surg 2018;46(2):346-55.
- Яйлен ДМ, Шапіро ПА, Лушей ЕС та ін. Менісектомія скронево-нижньощелепного суглоба – впливи на структуру суглоба та жувальну функцію у Macaca fascicularis. J Maxillofac Surg 1979;7(4):255-64.
- Боман КА. Артроз скронево-нижньощелепного суглоба та його лікування шляхом екстирпації диска: клінічне дослідження. Університет Мічигану: Альмквіст і Віксель; 1947.
- Тольванен М, Ойкарінен ВД, Вольф Дж. 30-річне спостереження за менісектомією скронево-нижньощелепного суглоба: звіт про п'ять пацієнтів. Br J Oral Maxill Surg 1988;26(4):311-6.
- Ерікссон Л, Вестессон ПЛ. Дисектомія як ефективне лікування болісного внутрішнього порушення скронево-нижньощелепного суглоба: 5-річне клінічне та рентгенографічне спостереження. J Oral Maxillofac Surg 2001; 59(7):750-8.
- Бйорнланд Т, Ларгейм ТА. Дисектомія скронево-нижньощелепного суглоба: 3-річне спостереження як предиктор 10-річного результату. J Oral Maxillofac Surg 2003;61(1):55-60.
- Хартман ЛС, Бессетт РВ, Байер РЕ та ін. Замінники менісків з силіконової гуми для скронево-нижньощелепного суглоба (TMJ): гістопатологічна та матеріальна оцінка після імплантації. J Biomed Mater Res 1988;22(6):475-84.
- Генрі ЧХ, Вольфорд ЛМ. Результати лікування реконструкції скронево-нижньощелепного суглоба після невдачі імплантату Proplast-Teflon. J Oral Maxillofacial Surg 1993;51(4):352-8.
- Такер МР, Беркс ЕД молодший. Тимчасова імплантація силікону після дисектомії в скронево-нижньощелепному суглобі приматів. J Oral Maxillofacial Surg 1989;47(12):1290-5.
- Босанкет АГ, Ісімару Дж, Госс АН. Вплив заміни силіконом після дисектомії в скронево-нижньощелепних суглобах овець. J Oral Maxillofac Surg 1991;49(11):1204-9.
- Сандерс Б, Буонкристіані РД, Джонсон Л. Видалення імплантату з силіконової гуми через часткову артротомію з подальшим артроскопічним оглядом внутрішньої поверхні фіброзної капсули. Oral Surg Oral Med Oral Pathol 1990;70(3):369-71.
- Баваріан Р, Шатман МЕ, Кіт ДА. Постійний біль після імплантатів Proplast-Teflon скронево-нижньощелепного суглоба: звіт про випадок та 35-річна перспектива управління. J Pain Res 2021;14: 3033-46.
- Хеффез Л, Мафі МФ, Розенберг Х та ін. Оцінка КТ заміни диска TMJ з ламінатом Proplast-Teflon. J Oral Maxillofacial Surg 1987;45(8):657-65.
- У Wu, Гонг Z, Лі J та ін. Пілотне дослідження фібрину з похідними синовіальними стовбуровими клітинами скронево-нижньощелепного суглоба для відновлення перфорації диска TMJ. Biomed Res Int 2014;2014:454021.
- Кобаяші Е, Накахара Т, Іноуе М та ін. Експериментальне дослідження in situ тканинної інженерії диска скронево-нижньощелепного суглоба з використанням автологічної кісткового мозку та колагенового спонжа. J Hard Tissue Biol 2015;24:211-8.
- Алмарза АД, Афанасіу КА. Техніки посіву та вибір каркасів для тканинної інженерії диска скронево-нижньощелепного суглоба. Tissue Eng 2004;10(11-12):1787-95.
- Юран СМ, Долвік МФ, МакФетрідж ПС. Інженерна мікропористість: підвищення раннього регенеративного потенціалу деклірованих дисків скронево-нижньощелепного суглоба. Tissue Eng A 2015;21(3-4): 829-39.
- Матуска АМ, МакФетрідж ПС. Лазерна мікроабляція фіброзного хряща: впливи обробки тканини на модифікацію пористості та механіку. J Biomed Mater Res B Appl Biomater 2018;106(5): 1858-68.
- Лянг Дж, Ій П, Ван Х та ін. Безклітинний матричний гідрогель для відновлення диска скронево-нижньощелепного суглоба. J Biomed Mater Res B Appl Biomater 2020;108(7):2995-3007.
- Мяенпяя К, Елла В, Маун Дж та ін. Використання стовбурових клітин жирової тканини та полілактидних дисків для тканинної інженерії диска скронево-нижньощелепного суглоба. J R Soc Interf 2010;7(42):177-88.
- Детаморе МС, Афанасіу КА. Використання обертового біореактора для тканинної інженерії диска скронево-нижньощелепного суглоба. Tissue Eng 2005;11(7e8):1188-97.
- Аллен КД, Афанасіу КА. Вибір каркасів та факторів росту в інженерії диска скронево-нижньощелепного суглоба. J dental Res 2008; 87(2):180-5.
- Легемате К, Тарафдер С, Джун Й та ін. Інженерія дисків TMJ людини з білковими вивільняючими 3D-друкованими каркасами. J dental Res 2016; 95(7):800-7.
- Цзян Н, Ян Й, Чжан Л та ін. 3D-друкований полікапролактон, зміцнений гідрогелем, як штучний диск TMJ. J dental Res 2021; 100(8):839-46.
- Мура С, Тріндаде Д, Віера М та ін. Мультиматеріальні імплантати для відновлення диска скронево-нижньощелепного суглоба: виготовлення за допомогою адитивного виробництва. Front Bioeng Biotechnol 2020;8:342.
- Анджело ДФ, Ван Й, Мороуко П та ін. Рандомізоване контрольоване передкліничне випробування трьох імплантатів диска скронево-нижньощелепного суглоба: TEMPOJIMS - фаза 2. J Tissue Eng regenerative Med 2021; 15(10):852-68.
- Хагандора КК, Гао Дж, Ван Й та ін. Полі (гліцерол себакат): новий матеріал каркасу для інженерії диска скронево-нижньощелепного суглоба. Tissue Eng Part A 2013;19(5e6):729-37.
