Gewebeengineering bei der Rekonstruktion des Kiefergelenks
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання).
Einführung
Die Rekonstruktion des Kiefergelenks (TMJ) stellt viele Herausforderungen dar. Bei der Gestaltung von Studienprotokollen muss darauf geachtet werden, fehlerhafte oder zweifelhafte Ergebnisse zu vermeiden. Es ist auch unerlässlich, den richtigen Typ von Tieren für die Studien auszuwählen. Misserfolge aus der Vergangenheit, die die Verwendung von Silikon- und Teflon-basierten Materialien im TMJ betrafen, waren wichtige Lektionen für die Zukunft. Das allmähliche Wachstum der Gewebeengineering (TE) kann ein vielversprechendes Feld für aufkommende TMJ-Biomaterialien sein, wenn grundlegende Prinzipien respektiert werden, um sichere und effektive Lösungen für das TMJ zu erreichen.
Tiermodell für das Gewebeengineering des Kiefergelenks
Um die menschliche Gesundheit zu verbessern, müssen wissenschaftliche Entdeckungen und Technologien in praktische Anwendungen umgesetzt werden. Solche Fortschritte beginnen klassischerweise mit der Grundlagenforschung und schreiten dann auf klinischer Ebene voran. Dem Entwicklung neuer Technologien inhärent ist die Rolle von präklinischen Studien mit Tiermodellen. Obwohl kein Tiermodell die menschlichen Bedingungen vollständig nachahmen kann, sind Tiermodelle entscheidend für die Bewertung von Krankheitsmechanismen, das Testen neuer Technologien, die Anwendung neuer Verfahren und den Fortschritt des TE.
Das Fehlen eines gut etablierten Tiermodells für die Untersuchung des Kiefergelenks (TMJ) war ein einschränkender Faktor für den potenziellen Fortschritt der TMJ-Tissue Engineering (TE). Die Wahl eines Tieres für das experimentelle Design ist nicht einfach, hauptsächlich aufgrund physiologischer und anatomischer Unterschiede. Das TMJ ist ein kardinales Merkmal, das die Klasse Mammalia definiert und Säugetiere von anderen Wirbeltieren trennt. Das TMJ zeigt bemerkenswerte morphologische und funktionale Variationen zwischen verschiedenen Arten, die nicht nur die große Anpassung der Säugetiere an Fütterungsmechanismen widerspiegeln, sondern auch unterschiedliche biomechanische Verhaltensweisen. Die morphologischen Variationen sind meist mit der Belastung (z. B. Größe der Gelenkflächen) oder Bewegung (z. B. Orientierung des Gelenks) oder beidem korreliert. Die Belastung des TMJ ist eine Reaktionskraft, die aus der Kontraktion der Kaumuskeln resultiert; ihre Größe hängt stark von der Position des Bisspunkts relativ zur Muskelaktionslinie ab. Viele präklinische Studien verwendeten Labortiere, insbesondere Nagetiere; sie fallen jedoch in die Kategorie minimaler TMJ-Belastung, insbesondere während des Kauens. Im Gegensatz dazu tragen Fleischfresser, wie Hunde, TMJ-Belastungen, die höher sind als die von Primaten. Das Öffnen des Kiefers umfasst normalerweise eine Kombination aus Rotation und vorwärts gerichteter Gleiten (Translation), aber einige Fleischfresser haben die Fähigkeit zu gleiten verloren, und einige spezialisierte Ameisenbären verwenden stattdessen eine Rotation um die Längsachse des gebogenen Unterkiefers. Die extremsten evolutionären Varianten umfassen den Verlust der Synovialhöhle bei einigen Bartenwalen; Verlust (oder möglicherweise primitive Abwesenheit) des Discus bei Monotremen, einigen Beuteltieren und Zahnlosen (Ameisenbären und Faultieren); Variationen in der Orientierung der Gelenkhöhle von sagittal (viele Nagetiere) zu transversal (viele Fleischfresser); Umkehrung der üblichen konvexen/konkaven Beziehung, sodass der processus condylaris das weibliche Element wird (viele Paarhufer wie Schafe und Rinder). Darüber hinaus ist die Größe des Gelenks extrem variabel. Schwein, Schaf, Kaninchen und Affe wurden in vielen Studien als Modelle für TMJ-Diskdefekte verwendet. Das Affenmodell wird in den letzten Jahren kaum verwendet, angesichts der hohen Kosten, der schwierigen chirurgischen Operation und der ethischen Genehmigung. Das Kaninchen wird oft als Modell für Studien zur Diskverschiebung verwendet. Allerdings sind die gleichen Einschränkungen beim Kaninchen vorhanden: (1) die kleine Größe des TMJ, die die chirurgische Herangehensweise erschwert; (2) der Jochbogen muss manchmal entfernt werden, um Zugang zum Gelenk zu erhalten; (3) die TMJ-Belastung ist reduziert, was zu einer möglichen Verzerrung der Ergebnisse führen kann. Die am häufigsten zitierte Studie eines TMJ-Diskverschiebungsmodells verwendete erwachsene männliche Neuseeland-weiße Kaninchen, um chirurgisch eine anteriore Diskverschiebung zu induzieren. Das Verfahren erforderte einen Schnitt über dem Jochbogen und einen Bruch des Jochbogens des squamosalen Schläfenbeins, um Zugang zum Gelenk zu erhalten. Allein der chirurgische Zugang könnte die Ergebnisse beeinflussen und stellt eine Einschränkung dieses Modells dar.
Einer der Hauptgründe, warum größere Tiere anstelle von Mäusen, Ratten und Kaninchen häufig für die Untersuchung von chirurgischen Methoden am Kiefergelenk verwendet werden, ist der angemessene chirurgische Zugang und die adäquate Belastung des Kiefergelenks, was die Genauigkeit möglicher mechanischer Tests erhöht. Aus diesem Grund stellen Mäuse, Ratten und Kaninchen technische Herausforderungen dar, die häufig Fragen zur translationalen Relevanz für das menschliche Kiefergelenk aufwerfen, was rechtfertigt, warum diese Tiere nicht für strenge präklinische Studien zur Kiefergelenk-Gewebeengineering empfohlen werden.
Im Bereich der großen Tiere wurde historisch das Schwein als der Goldstandard angesehen, basierend auf allgemeinen Ähnlichkeiten zur menschlichen Anatomie, insbesondere in Bezug auf die Größe der artikulären Kiefergelenkstrukturen und die Form der Scheibe. Darüber hinaus hat eine kürzlich durchgeführte umfassende Studie die Verwendung des Yucatan-Minischweins als Tiermodell für Studien zum Kiefergelenk-Gewebeengineering validiert. Allerdings schützt der Jochbogen den Gelenkraum beim Hausschwein, was in der Meinung der Autoren eine Einschränkung für die Verwendung dieses Modells darstellt. Darüber hinaus können die biomechanischen Kräfte des Minischweins die Ergebnisse beeinträchtigen.
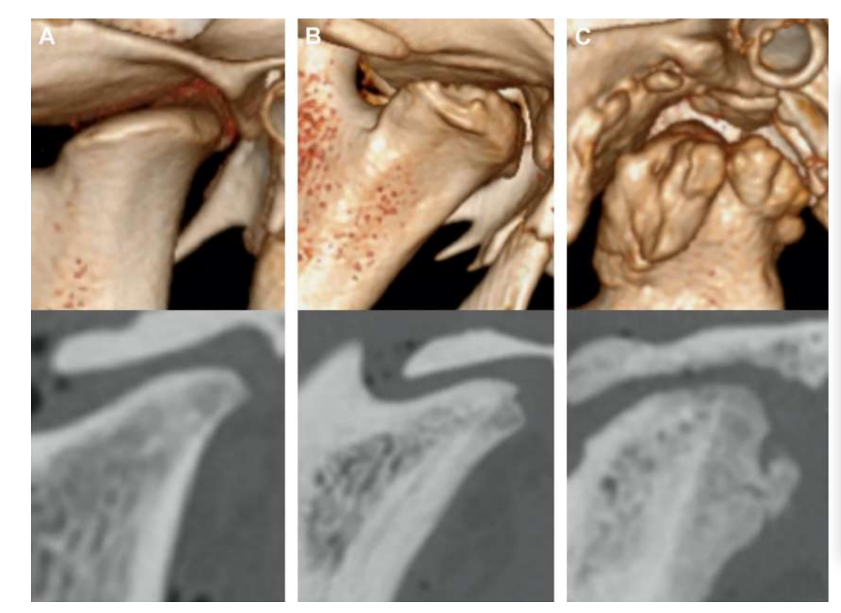
Die Anatomie, Histologie und Biomechanik des Kiefergelenks (TMJ) von schwarzen Merinoschafen wurden ebenfalls untersucht (Abb. 1). Mit einem präaurikulären Schnitt und stumpfer Dissektion kann die TMJ-Kapsel leicht erreicht werden (Abb. 2 und 4), selbst für die TMJ-Arthrozentese. Ein Vorteil ist, dass der Jochbogen den Gelenkraum nicht verdeckt, wie es bei Hausschweinen der Fall ist. Der TMJ-Diskus trennt das obere vom unteren Kompartiment (Abb. 3 und 4). Der Kondylus des Schafes ist mediolateral konkav mit ellipsoider Form und hat die längere Achse in der mediolateralen Position (Abb. 5 und 6). Diese anatomischen Ähnlichkeiten zum menschlichen TMJ, verbunden mit der großen Erfahrung in in-vivo chirurgischen Untersuchungen des TMJ, deuten darauf hin, dass das Schaf als geeignetes Modell für rigorose chirurgische Untersuchungen des TMJ betrachtet werden kann.
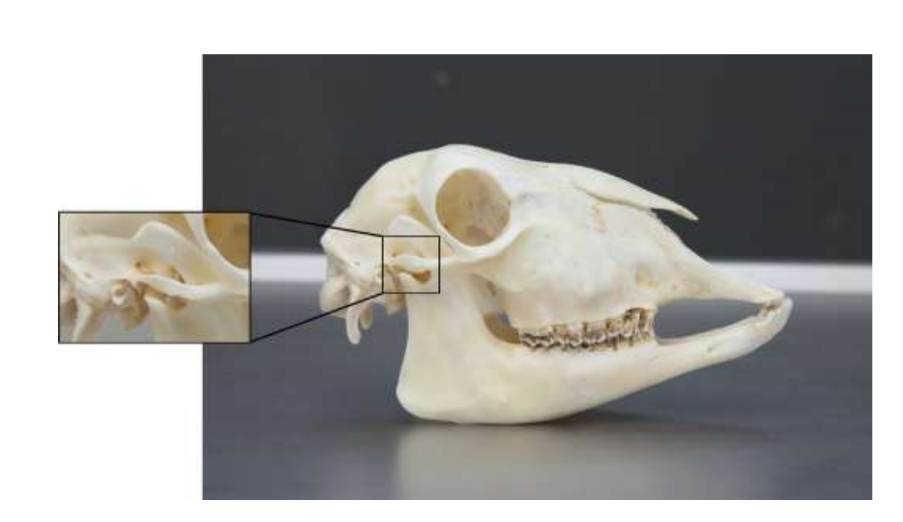
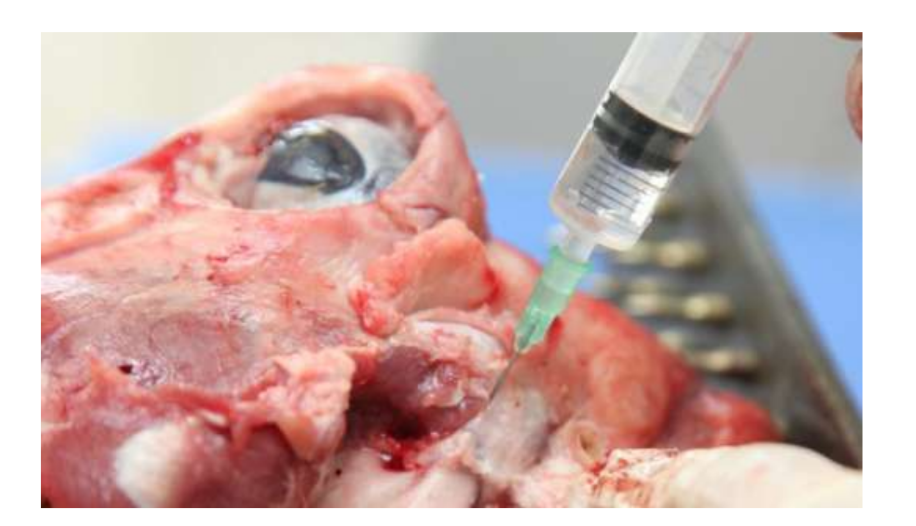
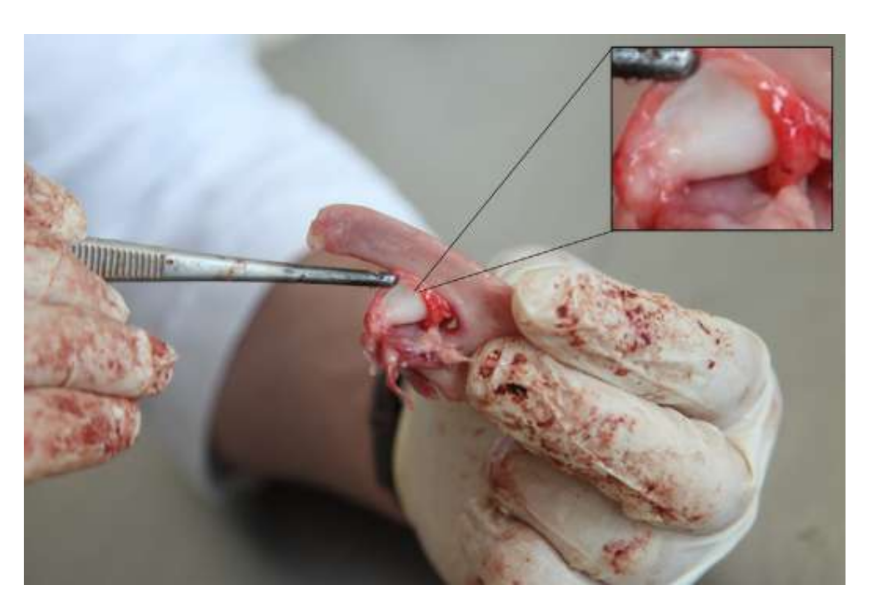
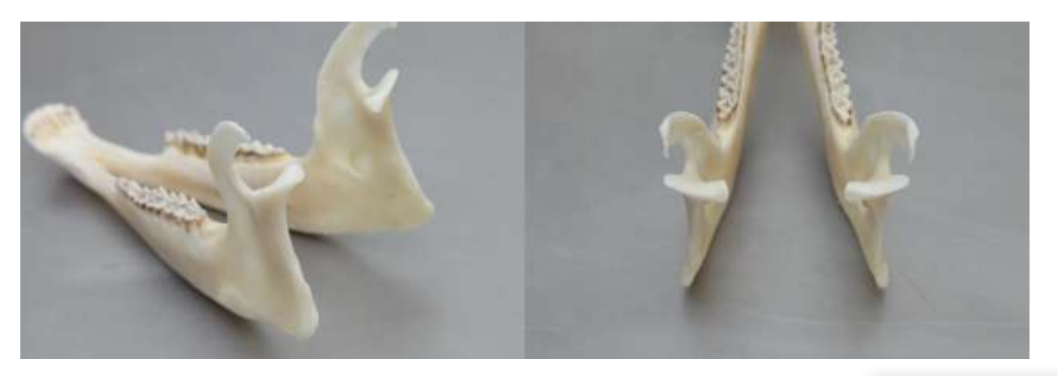
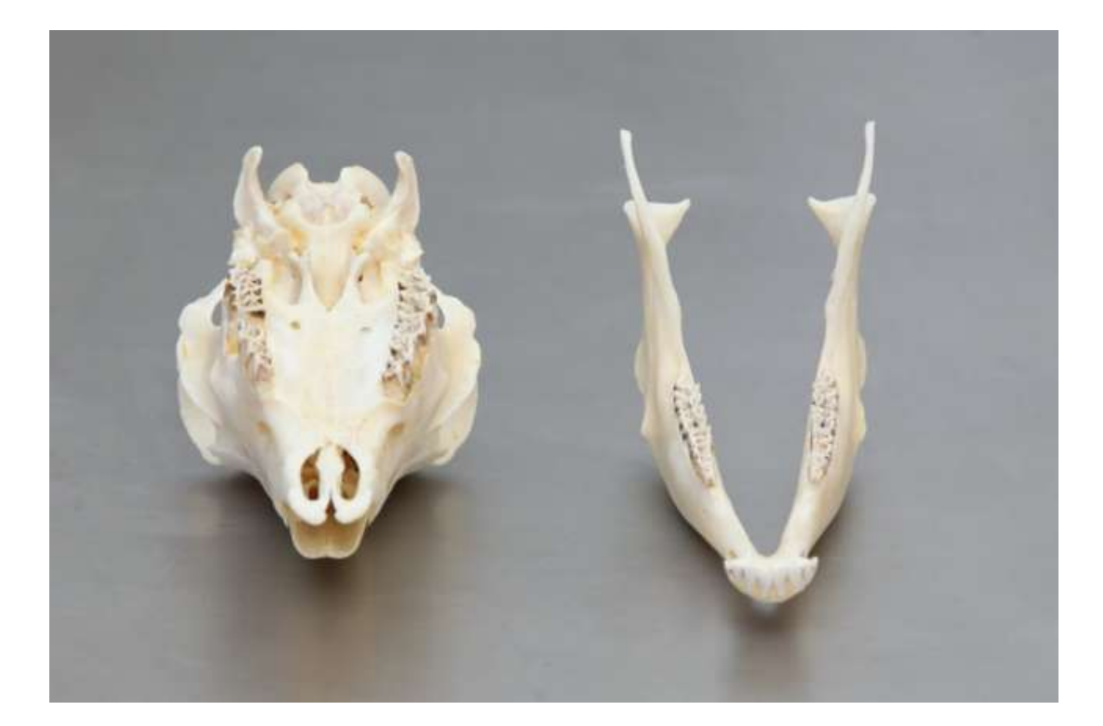
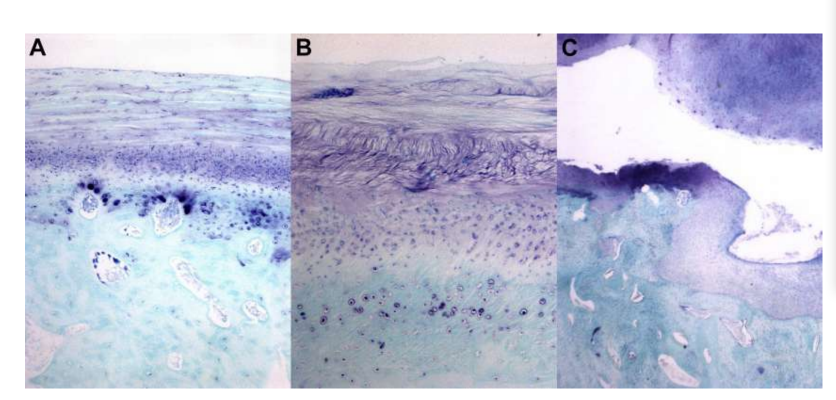
Schafe sind eine valide Option für TMJ-Studien, wenn man die Größe des TMJ, den processus condylaris und die Form der fossa mandibularis, die Größe, Morphologie und die Anheftungen der Diskus berücksichtigt. Die histologische Analyse weist eine große Ähnlichkeit mit dem menschlichen TMJ auf (Abb. 7 und 8). Ein weiterer wichtiger Vorteil des Schafmodells ist der Ruminationprozess (Abb. 9), der zusätzliche biomechanische Belastungen im TMJ bietet, ideal um die in-vivo TE-Materialbeständigkeit zu testen. Kürzlich wurde das Schafmodell erfolgreich in einer präklinischen Studie zur alloplastischen Rekonstruktion des TMJ eingesetzt.
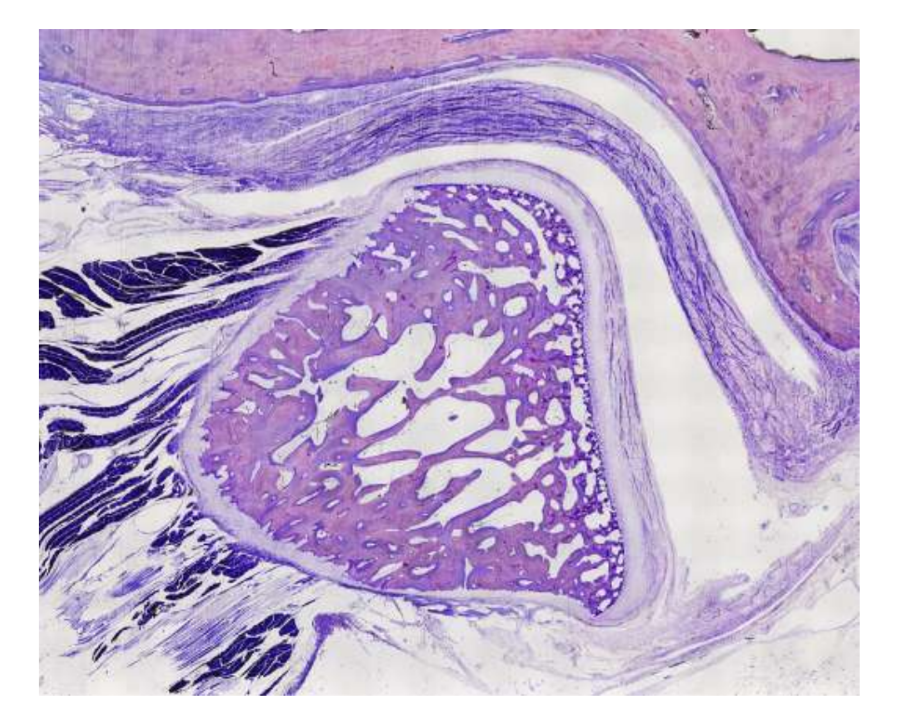
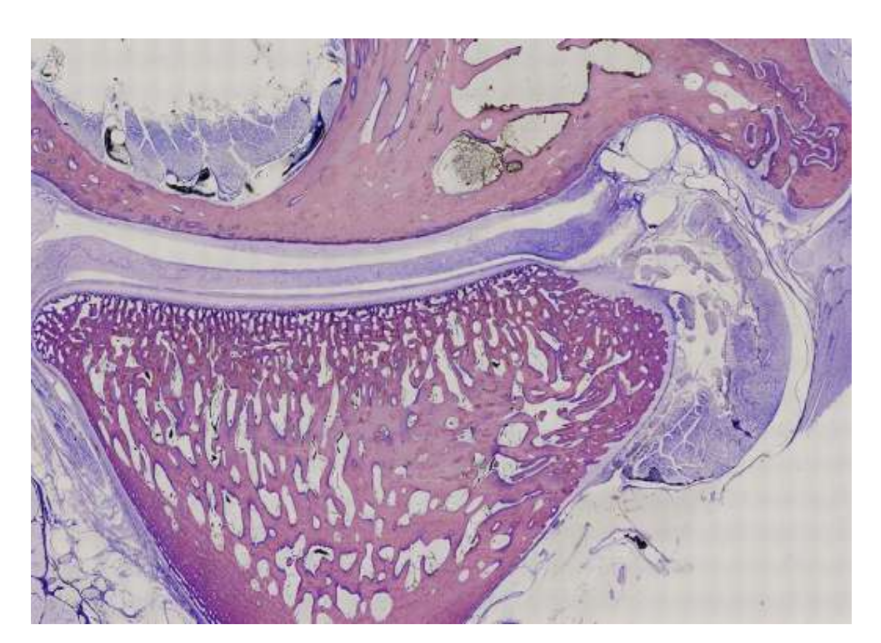

Obwohl keine Spezies den Goldstandard für alle präklinischen TMJ-TE-Studien bietet, haben sich Schafe als führende Option herauskristallisiert. Das Minischwein und das Hausschwein können in Betracht gezogen werden, wenn ausreichende Ressourcen verfügbar sind, und dienen als akzeptable Alternativen.
Studienentwurf für die präklinische Gewebeengineering des Kiefergelenks
Das Fehlen wirksamer Optionen zur Substitution des TMJ-Disks kann mit Schwierigkeiten bei der Übertragung von tierexperimentellen Ergebnissen auf die klinische Praxis beim Menschen in Verbindung gebracht werden. Diese Einschränkungen stehen wahrscheinlich im Zusammenhang mit den folgenden Punkten:
- Die Verwendung heterogener Tiermodelle mit widersprüchlichen Ergebnissen, möglicherweise aufgrund variabler Anatomie und intraartikulärer Belastung zwischen den Arten;
- Die Verwendung des kontralateralen TMJ als Kontrolle, was mit einer kontralateralen Überlastung verbunden sein kann;
- Die Biomaterialien, die zur Ersetzung des Disks verwendet werden, berücksichtigen nicht die morphologischen und biomechanischen Eigenschaften des natürlichen TMJ-Disks;
- Das Fehlen von randomisierten kontrollierten Studien mit Verblindung der Outcome-Bewerter;
- Der Mangel an interdisziplinären Teams, die an dem Projekt beteiligt sind.
Die präklinische Forschung sollte die effektive Übersetzung von Wissen in die Praxis fördern. Die zuvor genannten Aspekte können die effektive Übersetzung von qualitativ hochwertigem wissenschaftlichem Wissen in die klinische Praxis einschränken, und diese können potenzielle Probleme für Patienten, Kliniker und den wissenschaftlichen Fortschritt darstellen.
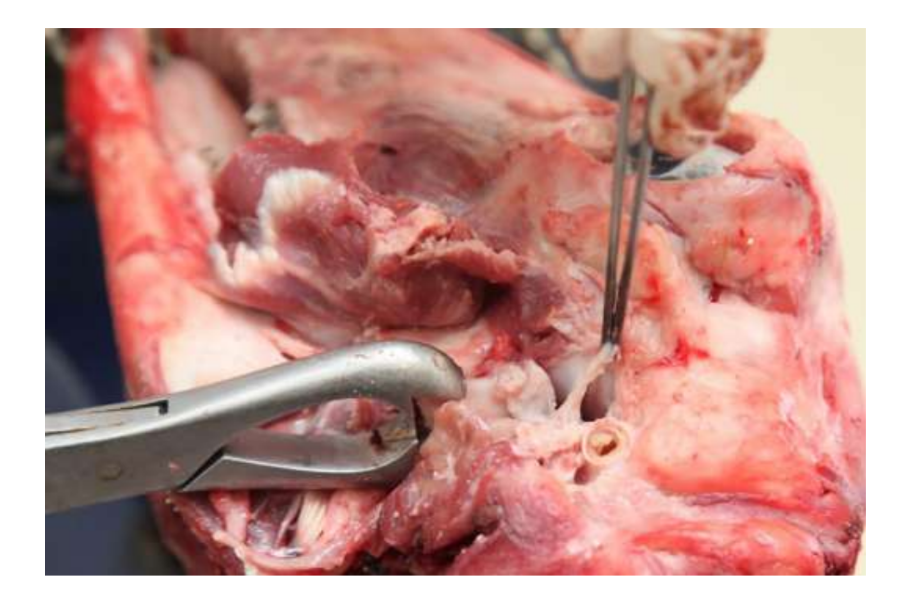
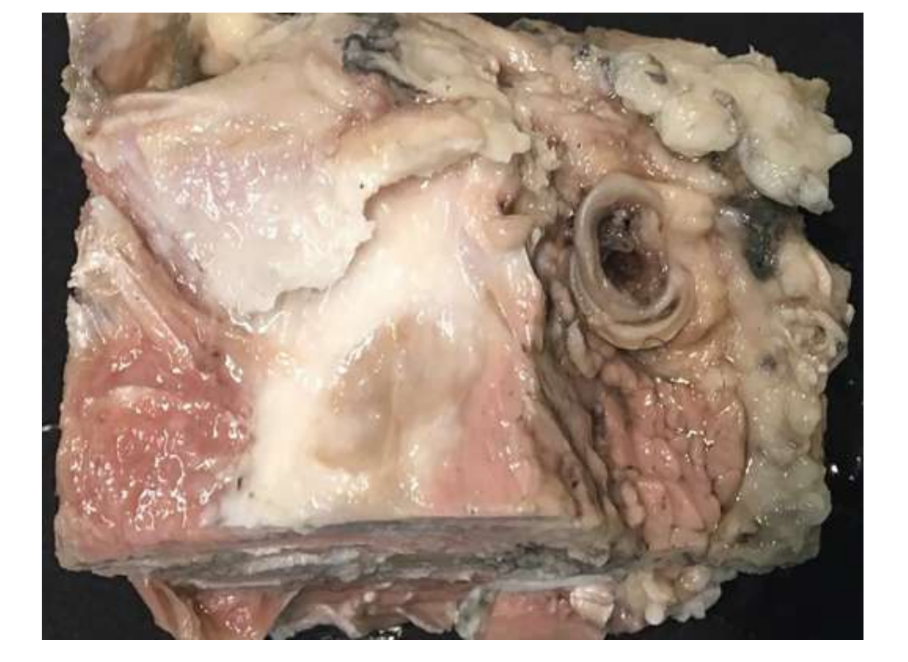
Das gegenwärtige Fehlen erfolgreicher Optionen zur Substitution des Kiefergelenksdisks ist nach wie vor ein großes Problem für die öffentliche Gesundheit. In den letzten zehn Jahren hat sich hinsichtlich der Studiendesigns für die Untersuchung des Kiefergelenks wenig geändert, und die Behandlung von Patienten mit schweren Kiefergelenksstörungen (TMD) bleibt umstritten. Aus diesen Gründen müssen zukünftige Studien im Studiendesign rigoros sein und die ARRIVE-Richtlinien respektieren. TEMPOJIMS ist eine rigorose präklinische Studie, deren Protokoll öffentlich verfügbar ist. Das primäre Ergebnis sollte die histopathologische Analyse sein. Dafür empfehlen die Autoren, den Kiefergelenksblock sorgfältig zu entfernen, wie in Abb. 10 gezeigt. Die histologische Vorbereitung ist herausfordernd, aber das Protokoll ist von unserer Gruppe gut detailliert, die meisten Schwierigkeiten liegen im Entkalkungsprozess. Das Studienprotokoll wurde in der TEMPOJIMS-Phase 1 verwendet: Vergleich der Ergebnisse der Kiefergelenksdiscektomie versus Kiefergelenksdiscopexie versus Kiefergelenks-Scheinoperation, um eine Basislinie für die Interpretation zukünftiger Ergebnisse zur Kiefergelenksdisk TE zu erhalten.
Die Begründung für das Tissue Engineering des Kiefergelenks
Um die Untersuchung von TE im Kiefergelenk zu rechtfertigen, ist es notwendig, den klinischen Bedarf an einem Ersatz für den Kiefergelenkdisc zu demonstrieren. Soweit bekannt ist, ist die Kiefergelenkdiscektomie mit günstigen Langzeitergebnissen verbunden, warum also Zeit und Ressourcen in einen Ersatz für den Kiefergelenkdisc investieren?
Wahrscheinlich, weil neben den starken Beweisen einige Ergebnisse zur Diskektomie widersprüchlich sind. In früheren präklinischen Studien auf diesem Gebiet haben die Forscher die kontralaterale, nicht operierte Seite als Kontrolle und umstrittene Tiermodelle verwendet. Die Verwendung der kontralateralen Seite als Kontrolle kann unangemessen sein, wenn man den Einfluss der kontralateralen Überlastung berücksichtigt. Theoretisch könnte ein bilateraler Ansatz die Verzerrung reduzieren. Die tierische Variabilität in den verschiedenen Studien ist eine Warnung hinsichtlich der Bedeutung der Verwendung desselben Tiermodells in weiteren Studien zur TMJ TE. Daher führte die Gruppe der Autoren verschiedene präklinische Studien an schwarzen Merinoschafen durch, wobei die erste Studie darauf abzielte, den Bedarf an einem TMJ-Diskersatz zu verstehen, wobei eine Kontrollgruppe mit Scheinoperation verwendet wurde - TEMPOJIMS Phase 1.
Die bilaterale TMJ-Diskektomie bei schwarzen Merinoschafen wurde durchgeführt, und es wurden schwere TMJ-Veränderungen sowohl mit histopathologischen als auch mit bildgebenden Analysen festgestellt (Abb. 11 und 12). In der postmortalen makroskopischen Bewertung wurde ein schwerer degenerativer Prozess beobachtet (Abb. 13). In der histologischen Analyse verifizierten die Forscher einen Anstieg von Proteoglykanen und runden Zellen sowie eine Verdickung des Knorpels nach der Diskektomie. Eine schwerere Synovitis nach der Diskektomie wurde ebenfalls beobachtet, was auf einen möglichen Entzündungsprozess hinweist. Strukturell wurden Unterschiede in Form, Kondylensklerose, temporaler Sklerose, Kondylusmark, temporärer Erosion, Kondylerosion und temporärem Mark festgestellt (Abb. 14). Die Diskektomie hatte jedoch nur einen Effekt auf die absolute Kaudauer, die Wiederkäuzeit pro Zyklus und die Wiederkäuare in den ersten 2 Monaten, und nach der Anfangsphase wurden keine signifikanten Veränderungen festgestellt. Bei Macaca fascicularis beschrieben Yaillen und Kollegen nach einer einseitigen Diskektomie eine Ankylose zwischen dem Kondylus und dem Schläfenbein. In klinischen Studien waren af Björkesten und Boman 1947 die ersten Forscher, die radiografische morphologische Veränderungen durch Diskektomie berichteten und von einer „Abflachung der Gelenkfläche“ sprachen. In den 1980er Jahren wurden schwerwiegende Kondylusabflachungen und Sklerose bei Patienten nach Diskektomie beschrieben. Später verifizierten Eriksson und Westesson in einer Überprüfung von 52 Patienten ebenfalls, dass die meisten Gelenke radiografische Hinweise auf Osteophyten, Abflachung und Sklerose zeigten.
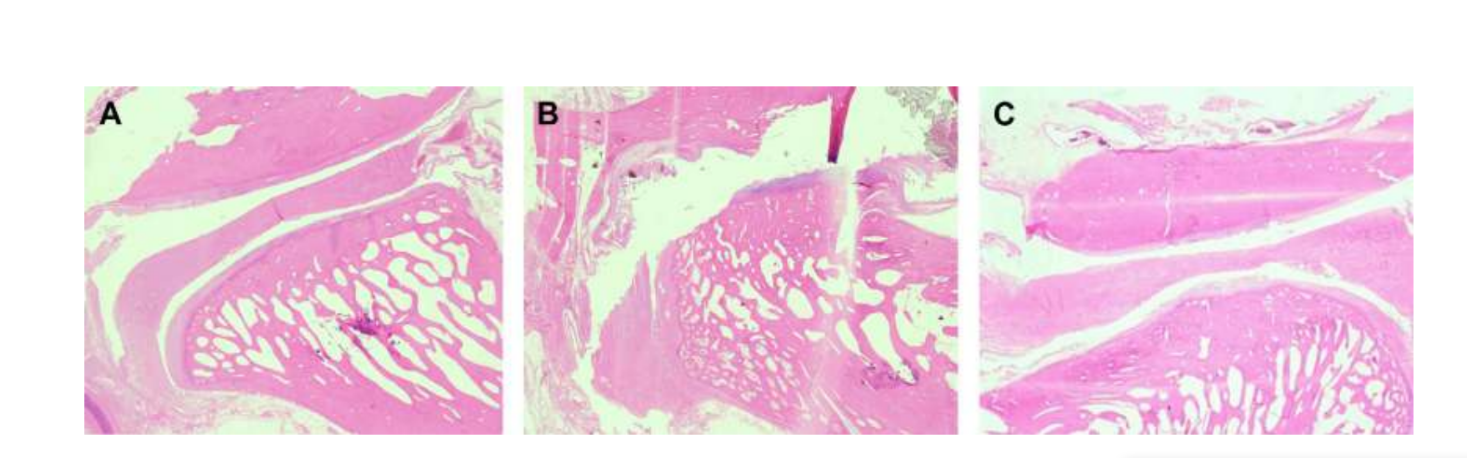
Bjørnland und Larheim beschrieben eine fibröse Ankylose 6 Monate nach einer einseitigen Diskektomie. Zusammen hoben diese Ergebnisse die Bedeutung der Untersuchung eines effektiven Interpositionsmaterials hervor, um den TMJ-Diskus zu ersetzen.
Gewebe-engineered Implantate
Der Versuch, den TMJ-Diskus zu ersetzen, begann in den 1960er und 1970er Jahren zu Studienzwecken. Die ersten getesteten Materialien waren Silikon-Gummi (Dow-Corning, Midland, MI, USA) und Proplast-Teflon (Vitek, Inc, Houston, TX, USA). Silikon-Gummi wurde 1968 von Robinson in den Bereichen der ästhetischen Chirurgie, Gelenkersatz und der oral- und maxillofazialen rekonstruktiven Chirurgie eingeführt. Obwohl dieses Material interessante Eigenschaften wie einfache Handhabung sowie gute Widerstandsfähigkeit und Elastizität aufweist, wurde seine Verwendung schnell entmutigt. Einige Patienten zeigten schwere Immunreaktionen, wie Reaktionen gegen Silikonpartikel und Synovitis. Der Silikondiskus-Ersatz wurde auch mit der Migration dieses Materials in benachbarte Gewebe in Verbindung gebracht. Bei Schafen war die Implantation eines Blattes aus Silastic (Silikon-Gummi-Implantat) verantwortlich für eine Knochenschädigung in allen 4 operierten Gelenken und ging mit einer Fremdkörperreaktion in der gesamten fibrösen Gewebekapsel einher, die sich um das Implantat gebildet hatte. Auch Sanders und Kollegen berichteten in einer Neubewertung von 30 Patienten über eine fibröse Kapsel als Pseudodiskus und eine fibröse Barriere zwischen dem Kondylus und der Fossa.
Proplast-Teflon (Polytetrafluorethylen oder PTFE) war auch ein weiteres Material, das als Ersatz für den Kiefergelenkscheiben verwendet wurde. Es wurde 1976 von Dr. Charles Homsy eingeführt und als stabiles und poröses Material präsentiert, das Zelladhäsion ermöglicht. Dieses Material verschleiß jedoch schnell und führte zu schweren Reaktionen, einschließlich Fremdkörpergranulomen, Fibrose, morphologischen Veränderungen des Kondylus und Schmerzen. Im Jahr 1990 empfahl die Food and Drug Administration, diese Implantate zu entfernen, wenn degenerative Veränderungen im Kiefergelenk beobachtet wurden.
Angesichts der daraus resultierenden Misserfolge dieser Ersatzmaterialien hat die TE an Bedeutung gewonnen und stellt einen möglichen gangbaren Weg zum Ersatz der Kiefergelenkscheibe dar. Eine effektive und sichere Gelenkscheibe muss einige Kriterien erfüllen, wie die folgenden:
- Biodegradierbarkeit, um einen Ersatz durch geeignetes Gewebe zu ermöglichen, und Biokompatibilität mit dem Wirt, um eine entzündliche Reaktion zu vermeiden;
- Hohe Tragfähigkeit, um den aufgebrachten mechanischen Kräften standzuhalten;
- Geeignete Porosität und Oberflächenchemie für die Zell-Differenzierung und um den Transport und Austausch von Sauerstoff, Nährstoffen und Abfall zu ermöglichen.
In diesem Zusammenhang charakterisierten die Autoren die morphologische, histologische und biomechanische Charakterisierung des Kiefergelenkdisks des schwarzen Merino-Schafes (Abb. 15). Die Ergebnisse dieser Studie waren äußerst relevant für das Verständnis der Geometrie sowie der biomechanischen und biologischen Eigenschaften des Gelenkdisks, um Ersatzmaterialien entwickeln zu können. Tatsächlich war die große Herausforderung der Gewebeengineering (TE), eine Strategie zu entwickeln, in der ein Biomaterial all diese Eigenschaften enthält. Im Fall des Kiefergelenks konzentrierten sich die Studien auf 2 Arten von Biomaterialien: synthetisch und natürlich.
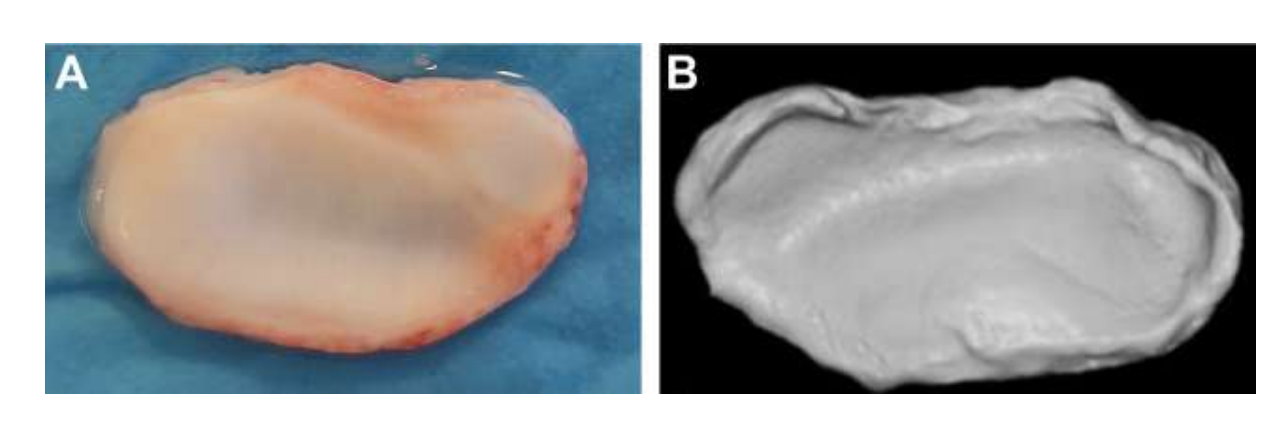
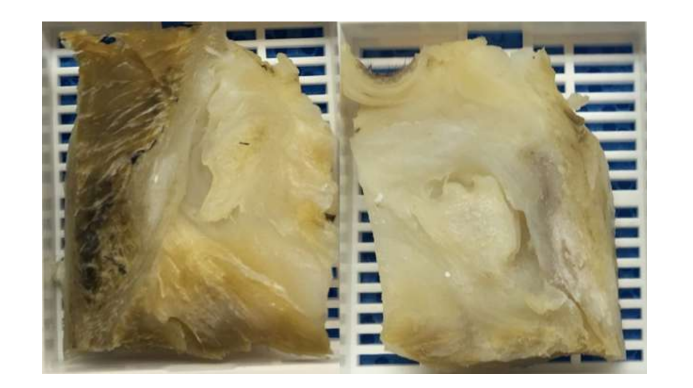
Die natürlichen Biomaterialien stammen aus natürlichen Quellen und weisen die besten biologischen Eigenschaften auf, wie Biokompatibilität, Biodegradierbarkeit und Bioaktivität, und fördern die Zelladhäsion, Proliferation und Differenzierung, die für die Gewebetechnik (TE) unerlässlich sind. Sie haben jedoch in der Regel schlechtere mechanische Eigenschaften und mehr Schwierigkeiten bei der Materialverarbeitung. Aufgrund dieser Schwierigkeiten haben nur wenige Studien bisher das potenzielle Einsatzgebiet dieser Biomaterialien im Kiefergelenk (TMJ) demonstriert. Die erste Pilotstudie verwendete ein Fibrin/Chitosan-Hybrid, das mit synovialen Stammzellen des TMJ kombiniert wurde. Die Forscher zeigten eine Förderung der Ablagerung der extrazellulären Matrix mit der Implantation des Gerüsts in Mäusen. Trotz dieser vielversprechenden Ergebnisse wurde die Studie nicht weitergeführt, und vieles davon könnte darauf zurückzuführen sein, dass nach Tag 7 der Zellbesiedelung die Anzahl der Zellen drastisch zu sinken begann. In einer anderen Studie wurde eine Kombination aus Kollagen-Schwammgerüst und autologen mesenchymalen Zellen aus dem Knochenmark in perforierten TMJ-Scheiben japanischer Kaninchen untersucht. Die Forscher beobachteten die Bildung von neuem Bindegewebe nach 2 Wochen, während in der Kontrollgruppe nach 8 Wochen die Perforation immer noch nicht vollständig geschlossen war. Wie bereits erwähnt, hat die Verwendung von Kaninchen/Mäusen in dieser Art von Studie jedoch viele Einschränkungen. Auch Alginat wurde in einem In-vitro-Ansatz mit TMJ-Scheibenzellen untersucht, aber die Ergebnisse waren nicht vielversprechend, und die Bildung von Kollagen oder GAG wurde nicht verifiziert, und die Zellpopulation nahm im Laufe der Zeit ab. Eine weitere Strategie, die untersucht wurde, ist die dezelularisierte extrazelluläre Matrix (dECM). dECM hat großartige Eigenschaften, da sie die nativen organischen und mechanischen Eigenschaften, wie das Kollagennetzwerk des Gewebes, bewahrt, da die immunogenen Komponenten entfernt werden, um die Zelladhäsion und -proliferation zu ermöglichen. Nur wenige Studien haben sich auf die beste Methode zur effektiven Dekellularisierung der TMJ-Scheibe konzentriert. Kürzlich wurde ein injizierbares Hydrogel auf Basis von dezelularisierten Schweine-TMJ-Scheiben hergestellt und in eine Maus injiziert. Das Hydrogel zeigte eine gute Zytokompatibilität, und nur eine geringe Entzündung wurde innerhalb von 7 Tagen nach der Implantation beobachtet. Diese Studie fehlt jedoch die Verifizierung der therapeutischen Wirksamkeit. Die Untersuchungen zum effektivsten Protokoll der Dekellularisierung der Scheibe sind spärlich. Daher untersucht die Forschungsgruppe der Autoren derzeit umfassend andere Methoden zur Dekellularisierung der schwarzen Merino-TMJ-Scheiben (Abb. 16), wie chemische, physikalische und enzymatische, um die effektivste Strategie zu finden.
Synthetische Biomaterialien haben im Vergleich zu natürlichen Materialien Nachteile in den strukturellen Unterschieden im Vergleich zu native Gewebe und möglichen Komplikationen im Zusammenhang mit Toxizität und Biokompatibilität. Sie bieten jedoch einige relevante Vorteile, wie höhere Verfügbarkeit, einfachere Verarbeitung und bessere biomechanische und physikalische Eigenschaften. Aus diesen Gründen werden synthetische Materialien als Ersatz für Kiefergelenkscheiben untersucht.
Polylactid (PLA), das eine längere Abbauzeit hat, war eines der ersten synthetischen Materialien, die untersucht wurden. Das PLA in Kombination mit adipösen Stammzellen erhöhte die Expression von Aggrecan und Kollagen Typ I und II in einem chondrogenen Medium, aber der Differenzierungsgrad der Zellen war im Vergleich zu Zellen, die aus der TMJ-Scheibe stammen, geringer.
Poly(glycolic acid) (PGA) ist ebenfalls ein biologisch abbaubarer Polymer, der im Bereich des TMJ untersucht wurde. Porcine TMJ-Scheibenzellen wurden auf ein PGA-Gerüst ausgesät, und eine erhöhte Menge an Matrixproduktion wurde verifiziert. Andere Forscher vermuteten, dass Poly-L-Milchsäure (PLLA) nicht gewebte Netze die Kontraktion begrenzen, eine umfassende mechanische Bewertung ermöglichen und die Lebensfähigkeit im Vergleich zu PGA nicht gewebten Netz-Kontrollen aufrechterhalten würden. Diese letzteren Konstrukte hatten die Fähigkeit, ihr Volumen für
6 Wochen im Vergleich zu PGA aufrechtzuerhalten, wiesen jedoch eine geringe mechanische Kapazität auf. Poly(ε-Caprolacton) (PCL) ist ein weiteres Biomaterial, das aufgrund seines langsamen Abbaus untersucht wurde. PCL-Gerüste, bei denen die Faserorientierung das Kollagennetzwerk darstellt, wurden mit Mikrosphären umhüllt.
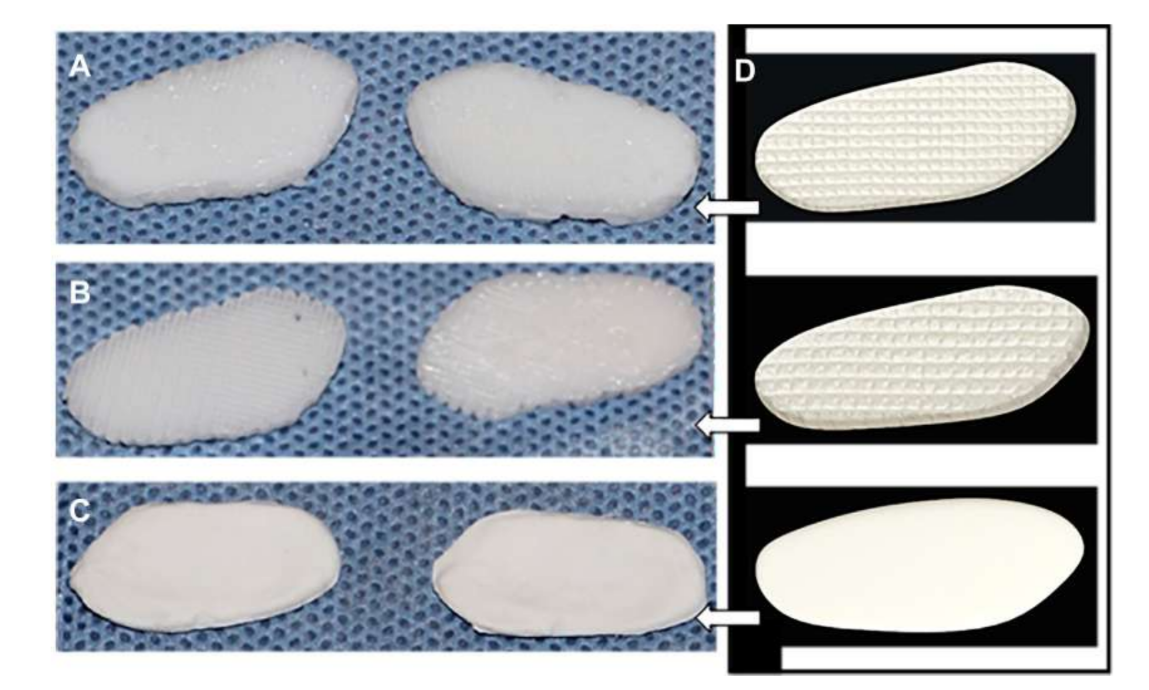
von Wachstumsfaktor für Bindegewebe (CTGF) und Transformationswachstumsfaktor Beta 3 (TGFb3). Bei der Kultivierung mit menschlichen mesenchymalen Stamm-/Vorläuferzellen war dieses Gerüst effizient in der Erzeugung einer heterogenen fibrocartilaginösen Matrix und viskoelastischen Eigenschaften. Die Forscher geben an, dass in vivo und Langzeit-Tests zur Abbaubarkeit des Gerüsts durchgeführt werden müssen. Jiang und Kollegen untersuchten Polyvinylalkohol-Hydrogel, das durch zyklisches Einfrieren und Auftauen vernetzt und durch 3-dimensionale (3D) PCL verstärkt wurde, und implantierten es für 12 Wochen in Ziegen. Die Forscher beschrieben diesen Ersatz als fähig, die Gelenkstabilität aufrechtzuerhalten und das kondyläre Knorpel- und Knochengewebe vor Schäden zu schützen. Es wurde jedoch auch von einem Eindringen von Bindegewebe im umliegenden Bereich von PCL berichtet. Tatsächlich scheint PCL nicht die idealen Eigenschaften zu besitzen, um als Ersatz in den durchgeführten Arbeiten verwendet zu werden. Die Forschungsgruppe der Autoren untersuchte auch Biomaterialien, die auf Gerüsten und Hydrogelen basieren und die TMJ-Scheibe von schwarzen Merinoschafen nachahmen, wobei verschiedene Materialien, PCL und Polyethylenglykol-Diacrylat (PEGDA), sowie eine Multimaterialstruktur kombiniert mit 3D-gedruckten PCL-Gerüsten verwendet wurden (Abb. 17). Die Ergebnisse der Autoren zeigten, dass das Hydrogel PEGDA als Kern im Gerüst die mechanischen Eigenschaften des nativen Gewebes näher nachahmt (Abb. 18). Kürzlich wurden 3D-angepasste TMJ-Scheibenimplantate entwickelt und in schwarzen Merinoschafen implantiert:
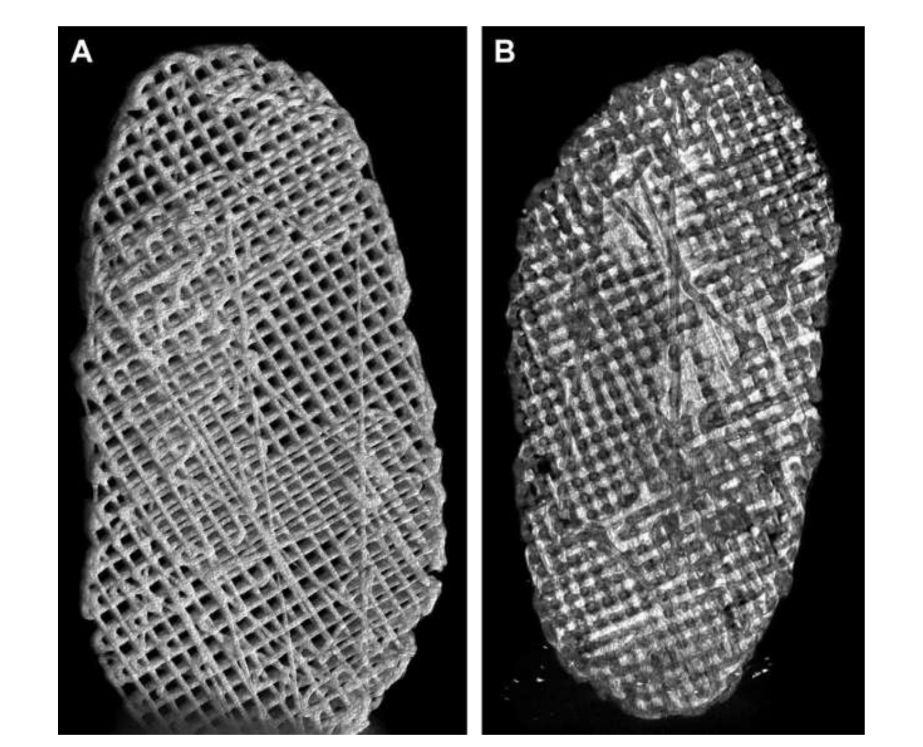
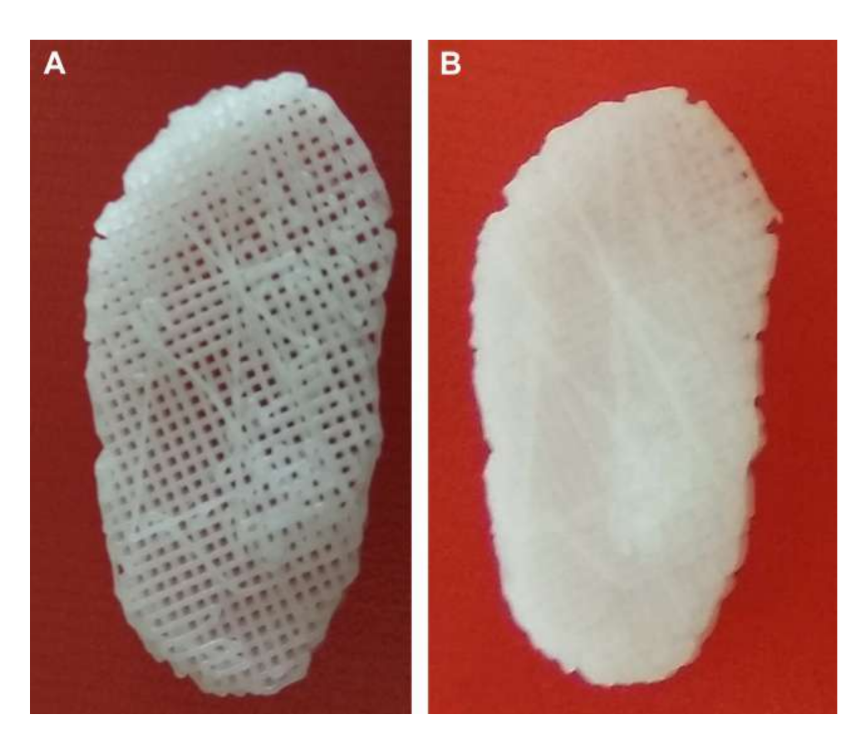
(1) Poly(glycerol sebacate) (PGS) Gerüst verstärkt mit elektrogesponnenen PCL-Fasern auf der Außenseite (PGS + PCL); (2) PCL und PEGDA (PCL + PEGDA); und (3) PCL (Abb. 19 und 20). Die Ergebnisse zeigten, dass PCL und PCL + PEGDA Scheiben ein höheres Risiko für degenerative Veränderungen aufwiesen, bedingt durch Materialfragmentierung. Keine der getesteten Scheiben regenerierte eine neue autologe Scheibe; jedoch war PGS + PCL sicher, zeigte eine schnelle Resorption und war in der Lage, degenerative Veränderungen des Kondylus zu verhindern. Hagandora wies in einer In-vitro-Studie auch auf eine großartige Eigenschaft von PGS hin, da Fibrochondrozyten auf die Anwendung mechanischer Kräfte reagieren, indem sie erhöhte Mengen an extrazellulärer Matrix produzieren.

Trotz der in den letzten Jahren durchgeführten Forschung steht ein Biomaterial, das alle notwendigen Eigenschaften zur Ersetzung des Kiefergelenkdisks erfüllt, noch nicht für klinische Studien zur Verfügung. Es wird erwartet, dass dies in den nächsten Jahren möglich sein wird.
Ein weiterer wichtiger Bereich der TE-Forschung sind die multipotenten Zellen. Unter diesen Zellen sind die mesenchymalen Stammzellen (MSCs) die am meisten untersuchten, insbesondere in der Behandlung von TMD-Osteoarthritis (OA). Abgeleitet aus verschiedenen Geweben, einschließlich Knochen, Fettgewebe und Synovialgewebe, besitzen MSCs mehrere Eigenschaften: chondrogene Differenzierung, entzündungshemmende Aktivität, Regeneration von Faserknorpel und osteogene Differenzierung. Trotz einiger vielversprechender Ergebnisse zum Schutz vor OA und kondylärer Resorption basieren die Studien hauptsächlich auf intraartikulären Injektionen. Der Einsatz dieser Zellen in der Regeneration des Gelenkdisks ist seltener und wird hauptsächlich in Kombination mit anderen Biomaterialien verwendet. Bei Kaninchen entwarfen Ahtiainen und Kollegen einen PLA-Disk mit adipösen Stammzellen und beobachteten, dass diese Zellen das morphologische Muster des Knochens verbesserten, das dem nativen ähnlicher war, und es wurde eine Regeneration des angrenzenden Gewebes beobachtet. Kürzlich wurde eine Studie durchgeführt, die adipose Stammzellen verwendete, um diese Zellen durch Laserinduktion in Kiefergelenkdisk-Zellen zu differenzieren. Mehr als 90 % der Zellen waren vital mit fibroblastischen und chondrogenen Phänotypen. Die Anwendung dieses Ansatzes wurde nicht in in vivo-Studien getestet. In einer Pilotstudie, die Fibrin/Chitosan-Hybridgerüste mit aus Synovialgewebe abgeleiteten MSCs verwendete, beobachteten die Forscher regenerative Fähigkeiten und Überexpression bei Ratten mit perforiertem Kiefergelenkdisk. Auch Zahnmark-Stammzellen wurden in Chitosan/Alginat-Gerüsten verwendet und in vitro kultiviert. Diese Stammzellen zeigten einen erhöhten Speicher-Modul und elastische Eigenschaften, was die Adhäsion der Zellen und die Expression von faserknorpeligen Markern erhöhte. Ihre Wirksamkeit in in vivo-Studien muss jedoch noch nachgewiesen werden. Außerdem wurden multipotente mesenchymale Stromazellen aus Kiefergelenkdisks identifiziert und isoliert und zeigten Proliferations- und Differenzierungsfähigkeiten. In naher Zukunft wird erwartet, dass Studien mit diesen Zellen die Wirksamkeit in der Regeneration des Kiefergelenkdisks zeigen.
Um die Eigenschaften von Stammzellen und Gerüsten zu verbessern, wurden einige Wachstumsfaktoren untersucht, um die Differenzierung, Proliferation, GAG- und Kollagenproduktion zu verbessern. Die auffälligsten Wachstumsfaktoren sind der vaskuläre endothelialen Wachstumsfaktor, das Knochenmorphenetische Protein-2, der Fibroblasten-Wachstumsfaktor (FGF), TGF-b1, das hochmobile Gruppe-1-Protein, der Insulin-Wachstumsfaktor-1 (IGF-1); der plättchenabgeleitete Wachstumsfaktor, der epidermale Wachstumsfaktor, Interleukin 1 und der Tumornekrosefaktor-alpha. In der Literatur haben einige Forscher das Potenzial untersucht, diese Wachstumsfaktoren in verschiedenen Gerüsten einzubetten. Detamore und Athanasiou waren Pioniere, die 3 Wachstumsfaktoren (FGF, TGF-b und IGF) in PGA-Gerüsten einbrachten. Alle Wachstumsfaktoren verbesserten die mechanische und strukturelle Integrität; jedoch waren IGF und TGF-b am effektivsten bei der Förderung der Kollagensynthese. In PLLA-Gerüsten, die mit IGF1 oder TGF-b1 oder TGF-b3 behandelt wurden, waren die Ergebnisse besser, wobei TGF-b1 eine größere Anzahl von Zellen, Kollagen und Glykosaminoglykanen förderte. PCL wurde auch mit Mikrosphären von CTGF und TGFb3 verkapselt. Bei der Kultivierung mit menschlichen mesenchymalen Stamm-/Vorläuferzellen war dieses Gerüst effizient in der Erzeugung einer heterogenen fibrocartilaginösen Matrix und viskoelastischen Eigenschaften. In Zukunft wird erwartet, dass dieses Konzept erforscht wird, indem Biomaterialien mit Stammzellen und Wachstumsfaktoren kombiniert werden; jedoch müssen bürokratische und ethische Einschränkungen überprüft werden, um die Erwartung zu verstärken, diese Techniken beim Menschen anzuwenden.
Zusammenfassung
Die Nachfrage nach einem TMJ-Scheibenersatz stellt weiterhin eine große Herausforderung dar. Die große Schwierigkeit besteht weiterhin darin, ein Biomaterial zu entwickeln, das die biomechanischen und biochemischen Eigenschaften aufweist, um eine tragfähige Alternative darzustellen.
Das TE-Feld hat aktiv zur Möglichkeit beigetragen, neue Ergebnisse in der Suche nach einem neuen und langlebigen Gewebe zu bringen, das die TMJ-Scheibe effektiv ersetzt/regeneriert. Studien sollten die nativen Eigenschaften der Scheibe, wie mechanische, physikalische und biologische, berücksichtigen. Eine Standardisierung der Studien an großen Tieren wie Schafen und Schweinen sollte ebenfalls angewendet werden.
Obwohl es bisher nicht gelungen ist, ein ideales Biomaterial zu erreichen, lässt die in den letzten Jahren geleistete Arbeit darauf schließen, dass dieses Ziel näher rückt.
David Faustino Ângelo, Florencio Monje Gil
Referenzen
- Herring SW. Anatomie des Kiefergelenks und Tiermodelle. J Musculoskelet Neuronal Interactions 2003;3(4):391-407.
- Naples VL. Morphologie, Evolution und Funktion der Nahrungsaufnahme beim Riesenanteater (Myrmecophaga tridactyla). J Zool 1999;249(1): 19-41.
- Lee YK, Moon HJ. Gegenseitiger Einfluss des Kaumaschinenapparats, der kraniofazialen Struktur und der Homöostase des gesamten Körpers. Med Hypotheses 2012;79(6):761-6.
- Herring SW, Liu ZJ. Belastung des Kiefergelenks: anatomische und in vivo Beweise aus den Knochen. Cells Tissues Organs 2001;169(3):193-200.
- Bosanquet A, Ishimaru J, Goss AN. Wirkung der experimentellen Diskusperforation in Schaf-Kiefergelenken. Int J Oral Maxill Surg 1991;20(3):177-81.
- Bosanquet AG, Goss AN. Das Schaf als Modell für die Kiefergelenkchirurgie. Int J Oral Maxill Surg 1987;16(5):600-3.
- Ishimaru J-I, Goss AN. Ein Modell für Osteoarthritis des Kiefergelenks. J Oral Maxillofacial Surg 1992;50(11):1191-5.
- Long X, Goss AN. Ein Schafmodell für intrakapsuläre Kondylenfrakturen. J Oral Maxillofac Surg 2007;65(6):1102-8.
- Helgeland E, Shanbhag S, Pedersen TO, et al. Gerüstbasierte Geweberegeneration des Kiefergelenks in experimentellen Tiermodellen: eine systematische Übersicht. Tissue Eng B Rev 2018;24(4): 300-16.
- Wang KH, Chan WP, Chiu LH, et al. Histologische und immunhistochemische Analysen der Reparatur des Diskus im Kiefergelenk von Kaninchen unter Verwendung einer Kollagenvorlage. Materials (Basel) 2017; 10(8).
- Sharawy MM, Helmy ES, Bays RA, et al. Reparatur der Perforation des Kiefergelenksdiskus unter Verwendung eines synovialen Membranlappens bei Macaca fascicularis Affen: Licht- und Elektronenmikroskopiestudien. J Oral Maxillofac Surg 1994;52(3):259-70.
- Ali AM, Sharawy MM. Histopathologische Veränderungen im Kranio-Mandibular-Gelenk von Kaninchen im Zusammenhang mit experimentell induzierter anteriorer Diskusverschiebung (ADD). J Oral Pathol Med 1994;23(8): 364-74.
- Mills DK, Daniel JC, Herzog S, et al. Ein Tiermodell zur Untersuchung der Mechanismen bei menschlichen Diskusfehlstellungen des Kiefergelenks. J Oral Maxillofac Surg 1994;52(12):1279-92.
- Tallents RH, Macher DJ, Rivoli P, et al. Tiermodell für Diskusverschiebung. J Craniomandib Disord 1990;4(4):233-40.
- Legrell PE, Isberg A. Asymmetrie der Mandibulären Höhe nach experimentell induzierter Diskusverschiebung im Kiefergelenk von Kaninchen. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;86(3):280-5.
- Sindelar BJ, Herring SW. Weichgewebemechanik des Kiefergelenks. Cells Tissues Organs 2005;180(1):36-43.
- Sun Z, Liu ZJ, Herring SW. Bewegung der Kiefergelenkgewebe während der Mastikation und passiven Manipulation bei Miniaturschweinen. Arch Oral Biol 2002;47(4):293-305.
- Herring SW, Decker JD, Liu ZJ, et al. Kiefergelenk bei Miniaturschweinen: Anatomie, Zellreplikation und Beziehung zur Belastung. Anat Rec 2002;266(3):152-66.
- Liu ZJ, Herring SW. Kaubelastungen auf die knöchernen und ligamentären Komponenten des Kiefergelenks bei Miniaturschweinen. J Orofac Pain 2000;14(4):265-78.
- Sindelar BJ, Evanko SP, Alonzo T, et al. Auswirkungen des Tragens einer intraoralen Schiene auf Proteoglykane im Diskus des Kiefergelenks. Arch Biochem Biophys 2000;379(1):64-70.
- Vapniarsky N, Aryaei A, Arzi B, et al. Die Struktur-Funktions-Beziehungen des Kiefergelenksdiskus des Yucatan-Minischweins unterstützen seine Eignung für vergleichende Studien am Menschen. Tissue Eng C Methods 2017;23(11):700-9.
- Thoma KH. Hyperostose des mandibulären Kondylus: mit Bericht über zwei Fälle. Am J Orthod Oral Surg 1945;31(10):597-607.
- Angelo DF, Morouc‚o P, Alves N, et al. Wahl des Schafs (Ovis aries) als Tiermodell für die Forschung zum Kiefergelenk: morphologische, histologische und biomechanische Charakterisierung des Gelenkdiskus. Morphologie 2016;100(331):223-33.
- Ângelo DF, Monje FG, González-García R, et al. Bioengineered Kiefergelenk-Diskusimplantate: Studienprotokoll für eine zweiphasige explorative randomisierte präklinische Pilotstudie an 18 schwarzen Merino-Schafen (TEMPOJIMS). JMIR Res Protoc 2017;6(3):e37.
- Herring SW. Anatomie des Kiefergelenks und Tiermodelle. J Musculoskelet Neuronal Interactions 2003;3(4):391-4.
- De Meurechy N, Mommaerts M. Alloplastische Kiefergelenkersatzsysteme: eine systematische Übersicht über ihre Geschichte. Int J Oral Maxill Surg 2018;47.
- Ângelo DF, Morouc‚o P, Monje Gil F, et al. Präklinische randomisierte kontrollierte Studie zur bilateralen Diskektomie versus bilaterale Diskopexie im Kiefergelenk von schwarzen Merino-Schafen: TEMPOJIMS - Phase 1 - histologische, bildgebende und Körpergewichtsergebnisse. J Craniomaxillofac Surg 2018;46(4):688-96.
- Cohen WA, Servais JM, Polur I, et al. Degeneration des Gelenkknorpels im kontralateralen nicht-chirurgischen Kiefergelenk bei Mäusen mit einer einseitigen partiellen Diskektomie. J Oral Pathol Med 2014; 43(2):162-5.
- Ahtiainen K, Mauno J, Ellä V, et al. Autologe adipöse Stammzellen und Polylactid-Diskusse beim Ersatz des Kiefergelenksdiskus von Kaninchen. J R Soc Interf 2013;10(85):20130287.
- Bjørnland T, Haanaes HR. Diskektomie des Kiefergelenks: eine experimentelle Studie an Affen. J Craniomaxillofac Surg 1999;27(2):113-6.
- Li L, Wang L, Sun Y, et al. Etablierung und histologische Bewertung eines traumatischen Kiefergelenkmodells bei Ziegen. J Oral Maxillofac Surg 2015;73(5):943-50.
- Xu L, Polur I, Lim C, et al. Frühe Osteoarthritis des Kiefergelenks bei Mäusen, induziert durch partielle Diskektomie. Osteoarthritis Cartil 2009;17(7):917-22.
- Dimitroulis G, Slavin J. Die Auswirkungen der einseitigen Diskektomie und Kondylektomie auf das kontralaterale intakte Kranio-Mandibular-Gelenk von Kaninchen. J Oral Maxillofac Surg 2006;64(8):1261-6.
- Ângelo DF, Gil FM, González-García R, et al. Auswirkungen der bilateralen Diskektomie und bilateralen Diskopexie auf die Kinematik der Wiederkäuenden bei schwarzen Merino-Schafen: TEMPOJIMS - Phase 1 - pilot-blind, randomisierte präklinische Studie. J Craniomaxillofac Surg 2018;46(2):346-55.
- Yaillen DM, Shapiro PA, Luschei ES, et al. Meniskektomie des Kiefergelenks – Auswirkungen auf die Gelenkstruktur und die Kaafunktion bei Macaca fascicularis. J Maxillofac Surg 1979;7(4):255-64.
- Boman KA. Arthrose des Kiefergelenks und deren Behandlung durch Extirpation des Diskus: eine klinische Studie. University of Michigan: Almqvist & Wiksell; 1947.
- Tolvanen M, Oikarinen VJ, Wolf J. Eine 30-jährige Follow-up-Studie zu Meniskektomien des Kiefergelenks: ein Bericht über fünf Patienten. Br J Oral Maxill Surg 1988;26(4):311-6.
- Eriksson L, Westesson PL. Diskektomie als effektive Behandlung für schmerzhafte interne Fehlstellungen des Kiefergelenks: ein 5-jähriges klinisches und radiografisches Follow-up. J Oral Maxillofac Surg 2001; 59(7):750-8.
- Bjørnland T, Larheim TA. Diskektomie des Kiefergelenks: 3-Jahres-Follow-up als Prädiktor für das 10-Jahres-Ergebnis. J Oral Maxillofac Surg 2003;61(1):55-60.
- Hartman LC, Bessette RW, Baier RE, et al. Silikon-Gummi-Kiefergelenk (TMJ) Meniskus-Ersatz: Postimplantations-histopathologische und Materialbewertung. J Biomed Mater Res 1988;22(6):475-84.
- Henry CH, Wolford LM. Behandlungsergebnisse für die Rekonstruktion des Kiefergelenks nach Proplast-Teflon-Implantatversagen. J Oral Maxillofacial Surg 1993;51(4):352-8.
- Tucker MR, Burkes EJ Jr. Temporäre Silastic-Implantation nach Diskektomie im Kiefergelenk von Primaten. J Oral Maxillofacial Surg 1989;47(12):1290-5.
- Bosanquet AG, Ishimaru J, Goss AN. Die Wirkung des Silastic-Ersatzes nach Diskektomie in Schaf-Kiefergelenken. J Oral Maxillofac Surg 1991;49(11):1204-9.
- Sanders B, Buoncristiani RD, Johnson L. Entfernung eines Silikon-Gummi-Fossa-Implantats durch partielle Arthrotomie gefolgt von arthroskopischer Untersuchung der inneren Oberfläche der fibrösen Kapsel. Oral Surg Oral Med Oral Pathol 1990;70(3):369-71.
- Bavarian R, Schatman ME, Keith DA. Persistierende Schmerzen nach Proplast-Teflon-Implantaten des Kiefergelenks: ein Fallbericht und 35 Jahre Management-Perspektive. J Pain Res 2021;14: 3033-46.
- Heffez L, Mafee MF, Rosenberg H, et al. CT-Bewertung des TMJ-Diskus-Ersatzes mit einer Proplast-Teflon-Laminat. J Oral Maxillofacial Surg 1987;45(8):657-65.
- Wu Y, Gong Z, Li J, et al. Die Pilotstudie von Fibrin mit aus dem Kiefergelenk gewonnenen synovialen Stammzellen zur Reparatur der Diskusperforation. Biomed Res Int 2014;2014:454021.
- Kobayashi E, Nakahara T, Inoue M, et al. Experimentelle Studie zur in situ Gewebezüchtung des Kiefergelenksdiskus unter Verwendung von autologem Knochenmark und Kollagen-Schwammgerüst. J Hard Tissue Biol 2015;24:211-8.
- Almarza AJ, Athanasiou KA. Besamungstechniken und Auswahl des Gerüsts für die Gewebezüchtung des Kiefergelenksdiskus. Tissue Eng 2004;10(11-12):1787-95.
- Juran CM, Dolwick MF, McFetridge PS. Ingenieurmikroporosität: Verbesserung des frühen regenerativen Potenzials von de-zellularisierten Kiefergelenksdiskussen. Tissue Eng A 2015;21(3-4): 829-39.
- Matuska AM, McFetridge PS. Laser-Mikroablation von Faserknorpelgewebe: Auswirkungen der Gewebeverarbeitung auf die Porositätsmodifikation und Mechanik. J Biomed Mater Res B Appl Biomater 2018;106(5): 1858-68.
- Liang J, Yi P, Wang X, et al. Acelluläre Matrix-Hydrogel zur Reparatur des Kiefergelenksdiskus. J Biomed Mater Res B Appl Biomater 2020;108(7):2995-3007.
- Mäenpää K, Ellä V, Mauno J, et al. Verwendung von adipösen Stammzellen und Polylactid-Diskussen für die Gewebezüchtung des Kiefergelenksdiskus. J R Soc Interf 2010;7(42):177-88.
- Detamore MS, Athanasiou KA. Verwendung eines rotierenden Bioreaktors zur Gewebezüchtung des Kiefergelenksdiskus. Tissue Eng 2005;11(7e8):1188-97.
- Allen KD, Athanasiou KA. Auswahl von Gerüst und Wachstumsfaktoren in der Ingenieurwissenschaft des Kiefergelenksdiskus. J dental Res 2008; 87(2):180-5.
- Legemate K, Tarafder S, Jun Y, et al. Ingenieurwissenschaftliche menschliche TMJ-Diskusse mit proteinfreisetzenden 3D-gedruckten Gerüsten. J dental Res 2016; 95(7):800-7.
- Jiang N, Yang Y, Zhang L, et al. 3D-gedrucktes Polycaprolacton-verstärktes Hydrogel als künstlicher TMJ-Diskus. J dental Res 2021; 100(8):839-46.
- Moura C, Trindade D, Vieira M, et al. Multi-Material-Implantate zur Reparatur des Kiefergelenksdiskus: maßgeschneiderte additive Fertigung. Front Bioeng Biotechnol 2020;8:342.
- Ângelo DF, Wang Y, Morouc‚o P, et al. Eine randomisierte kontrollierte präklinische Studie zu 3 Interpositions-Kiefergelenksdiskusimplantaten: TEMPOJIMS-Phase 2. J Tissue Eng regenerative Med 2021; 15(10):852-68.
- Hagandora CK, Gao J, Wang Y, et al. Poly(glycerol sebacate): ein neuartiges Gerüstmaterial für die Ingenieurwissenschaft des Kiefergelenksdiskus. Tissue Eng Part A 2013;19(5e6):729-37.

/social-network-service/media/default/6809/fbab08d0.jpg)