Гістоморфометрія кістки після навмисно відкритої нерозчинної d-PTFE мембрани або керованої регенерації кістки для лікування постекстракційних дефектів альвеолярної кістки з імплантатами: пілотне рандомізоване контрольоване дослідження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Метою даного дослідження було вивчення кількісного гістологічного дослідження кістки, реконструйованої з використанням нерозчинної мембрани з високої щільності політетрафторетилену (d-PTFE), яка була навмисно залишена відкритою в лунках після видалення зубів, заповнених анорганічним кістковим матеріалом, і видаленої через чотири тижні, порівняно з видаленням зуба та керованою регенерацією кістки (GBR), проведеною через два місяці.
Матеріали та методи: Це дослідження було спроектовано як багатопрофільне рандомізоване контрольоване випробування паралельного дизайну. Пацієнти були відібрані та послідовно лікувалися в трьох центрах в Італії. Пацієнти випадковим чином отримували навмисно відкриту нерозчинну мембрану d-PTFE (група A) або керовану регенерацію кістки (група B) для лікування дефектів альвеолярної кістки після видалення зубів з імплантатами. Результати включали: невдачу імплантату, будь-які механічні та біологічні ускладнення, задоволеність пацієнтів, а також якісну та гістоморфометричну оцінку зібраних зразків кістки.
Результати: Вісімнадцять пацієнтів були послідовно залучені до дослідження. З них шість з 18 пацієнтів були чоловіками. Усі включені пацієнти отримали лікування відповідно до призначених втручань, і жоден з них не вибув. Не було зафіксовано жодного випадку відмови імпланта та жодних ускладнень, і всі пацієнти були повністю задоволені функцією та естетикою своїх відновлень на імплантах, без різниці між групами. Морфологічний аналіз не виявив жодних ознак реакції тканин, таких як фіброз або некроз. Відновлена кістка була добре мінералізована в обох групах, але здавалася більш зрілою в групі B, ніж у групі A. Три зразки показали мінімальну кількість лімфоцитів. Кілька дрібних кровоносних судин займали медулярні простори, де тканина виявила більшу зрілість, що вказує на активність тканини в процесі. Гістоморфометрична оцінка не показала статистично значущих відмінностей у обсягах тканини між двома групами пацієнтів.
Висновки: З урахуванням обмежень даного дослідження, реконструкція щічної пластинки з навмисно відкритою нерозчинною мембраною є ефективною та простою процедурою для регенерації резорбованої щічної кісткової пластинки, що зменшує потребу в керованій регенерації кістки.
Вступ
Втрата альвеолярної кістки може бути спричинена різними факторами, такими як ендодонтична патологія, пародонтит, травми обличчя та агресивні маневри під час видалення зубів. Більше того, після видалення зуба відбувається каскад біологічних подій, що зазвичай призводить до значних локальних анатомічних змін, включаючи зменшення висоти та ширини залишкового гребеня. Горизонтальна втрата кістки зазвичай є найбільшою і відбувається частіше на щічній стороні. Вигідні показники успішності імплантів та реакції періімплантних тканин можуть бути досягнуті шляхом встановлення імплантів безпосередньо після видалення зуба, однак спостерігалося подальше відступання обличчя ясенних тканин. Для покращення естетичної передбачуваності постекстракційних імплантів було проведено кілька досліджень та систематичних оглядів для оцінки ефективності різних підходів до заповнення лунки з використанням різних матеріалів для пересадки, з бар'єрними мембранами або без них. У цих дослідженнях було використано безліч біоматеріалів, включаючи аутологічну кістку, замінники кістки (аллографти, ксенографти та алопласти), а також продукти, отримані з аутологічної крові, та біоактивні агенти. Однак нещодавні клінічні випробування та систематичні огляди не змогли знайти докази того, що якийсь біоматеріал та бар'єрна мембрана були б кращими за інші. З урахуванням обмежень цього дослідження, використання мембран з високощільного політетрафторетилену (d-PTFE) було безпечним та передбачуваним, особливо з точки зору ширини кератинізованих тканин.
Ті ж дослідження заохочують добре проведені рандомізовані контрольовані випробування.
Еліан та ін. запропонували спрощену класифікацію лунок і неінвазивний підхід до пересадки та управління лунками, коли присутня м'яка тканина, але буковий пластина порушена (Тип II). Автори використовували колагенову мембрану та матеріали для пересадки для лікування лунок типу II. Нещодавній систематичний огляд дійшов висновку, що мембрани з PTFE захищають матеріал для пересадки та/або початковий згусток загоєння від бактеріального забруднення, що призводить до успішної регенерації без значного ризику інфекції.
Метою даного рандомізованого контрольованого випробування було дослідити кількісне гістологічне дослідження кістки, реконструйованої з мембраною d-PTFE, навмисно залишеної відкритою в лунках після видалення, пересаджених неорганічним матеріалом для кістки, і видаленої через чотири тижні, в порівнянні з видаленням і керованою регенерацією кістки (GBR), проведеною через два місяці. Нульова гіпотеза полягала в тому, що не було статистичних відмінностей щодо якісної та гістоморфометричної оцінки зразків між групами. Нульова гіпотеза була перевірена на противагу альтернативній гіпотезі про відмінність. Дане дослідження було написано відповідно до рекомендацій CONSORT.
Матеріали та методи
Це дослідження було спроектовано як пілотне, багатопрофільне рандомізоване контрольоване випробування паралельного дизайну, метою якого було оцінити гістоморфометрію кістки та клінічні параметри пацієнтів з безнадійними зубами нижньої та верхньої щелепи, розташованими між премолярами, які потребують відстроченого імплантованого одиничного коронкового відновлення. Пацієнти були відібрані та послідовно лікувалися в трьох центрах в Італії з листопада 2018 року по вересень 2020 року.
Три клініцисти виконували як хірургічні, так і протезні процедури. Калібрування хірургів забезпечило виконання кожним з них двох додаткових клінічних випадків, щоб оцінити та зменшити потенційні хірургічні ризики. Це дослідження проводилося відповідно до принципів, викладених у Гельсінській декларації 1964 року для біомедичних досліджень, що залучають людей, з поправками на 64-й Генеральній асамблеї ВМА, Форталеза, Бразилія, жовтень 2013 року, і отримало етичне схвалення від "Етичного комітету Лаціо 1". Номер протоколу 23/CE Лаціо 1, від 7 січня 2020 року. Пацієнти були належним чином проінформовані про природу дослідження. Письмова форма інформованої згоди на хірургічні та протезні процедури, а також на використання клінічних та радіологічних даних, була отримана для кожного пацієнта перед початком лікування.
Критерії включення та виключення
Будь-який пацієнт, який потребує щонайменше одного імплантованого одиничного відновлення між премолярами, щоб замінити втрачене зуб з пошкодженою щічною кістковою платівкою, але з збереженою архітектурою м'яких тканин (Тип II відповідно до Elian et al.), віком не менше 18 років і здатний підписати форму інформованої згоди, вважався таким, що відповідає критеріям цього дослідження, і послідовно включався. Безнадійні зуби оцінювалися за такими критеріями: залучення розгалуження > II; рухливість > II; PPD > 6 мм з відсотком втрати альвеолярної кістки/довжини кореня ≥70%; постійна рентгенографічна патологія та/або симптоми (наприклад, біль, свищ, абсцес) ендодонтичного походження та невизначений прогноз; можливість відновлення.
Кожен пацієнт брав участь лише в одній процедурі. Вибране місце повинно було мати сусідні зуби/імпланти. Критерії виключення були:
- Загальні протипоказання до оральної хірургії (такі як ASA III та IV);
- Важкі курці (≥ 10 сигарет/день);
- Залежність від алкоголю або наркотиків;
- Гострі та хронічні інфекції в місці, призначеному для імплантації;
- Погана гігієна порожнини рота (кровотеча з усієї рота та індекс нальоту в усій ротовій порожнині вище 25%);
- Вагітність або годування;
- Психіатрична терапія;
- Пацієнти, які отримували або перебувають на лікуванні внутрішньовенними амінобісфосфонатами;
- Попередня променева терапія в області рота та щелепно-лицевої ділянки протягом останніх 5 років;
- Пацієнти, які не можуть дотримуватися запланованого спостереження.
Клінічні процедури
Потенційно придатні пацієнти були клінічно оцінені, а їх медичні історії були зафіксовані. Під час візиту були отримані передопераційні періапікальні рентгенограми, навчальні моделі та фотографії, а також проведено періодонтальне скринінгове обстеження.
Пацієнти пройшли професійну гігієну порожнини рота перед хірургічним втручанням і отримали профілактичний антисептик (ополіскувач для рота 0,2% хлоргексидину за одну хвилину до операції) та антибіотикотерапію (дві грами амоксициліну та клавуланової кислоти або кліндаміцину 600 мг у разі алергії на пеніцилін, за годину до операції). Усі пацієнти лікувалися під місцевою анестезією з використанням гідрохлориду артикаїну з адреналіном 1:100,000 (Orabloc, Pierrel, Мілан, Італія). Видалення зубів проводилося без розрізів, якомога менш травматично. Зуби з кількома коренями були розділені на рівні розгалуження, а корені були видалені окремо. Після цього залишкову лунку видалення промивали фізіологічним розчином, і її ретельно очищали від грануляційної тканини та залишкових волокон періодонтальної зв'язки. Нарешті, кісткова стінка була оцінена за допомогою періодонтального зонда (PCPUNC156, Hu-Friedy). Після цього пацієнти, які відповідали всім критеріям включення, були остаточно зараховані, і запечатаний конверт з послідовно пронумерованим номером, що відповідає номеру набору пацієнтів, був відкритий сліпим незалежним асистентом для визначення групи розподілу.
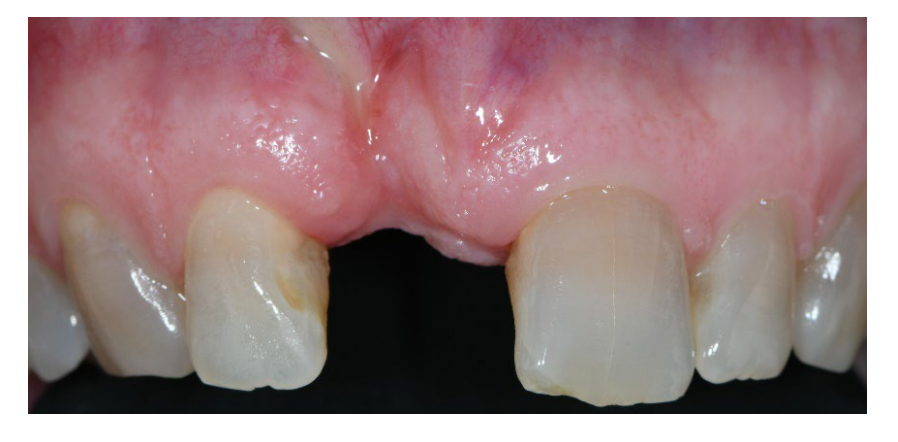
У групі A, збереження лунки з навмисно відкритою не розсмоктувальною мембраною d-PTFE (експериментальна група, малюнки 1–4), залишкова альвеолярна лунка була пересаджена порцеляновим кістковим матеріалом (частинки 0,25–1 мм, Zcore, DeOre s.r.l., Неграр [Vr], Італія). Потім не розсмоктувальна, щільна політетрафторетиленова (d-PTFE) мембрана (Cytoplast TXT1224, DeOre) була сформована відповідно до розміру залишкової лунки і вставлена в щічний та язиковий кишеню. Нарешті, горизонтальний матрацний шов (Cytoplast PTFE Suture 4-0, DeOre) був накладений для фіксації мембрани та стабілізації її до країв м'яких тканин. Використання не розсмоктувальної мембрани d-PTFE не вимагало первинного закриття шляхом просування щічного клаптя. Шви були видалені через 10–14 днів після операції, а не розсмоктувальна мембрана d-PTFE була видалена між четвертим і п'ятим тижнями після операції. Після цього рана залишалася загоюватися приблизно п'ять місяців, що дозволяло процесу реепітелізації.
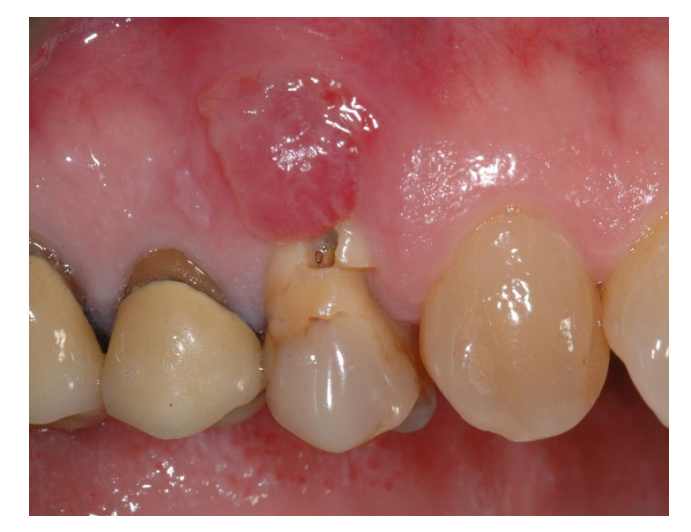
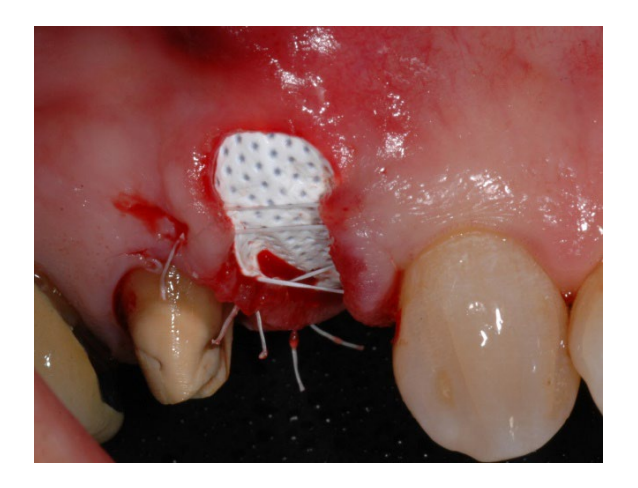
У групі B, GBR (контрольна група, малюнки 5–8), до лунки була вставлена лише фібринова губка для стабілізації кров’яного згустку.
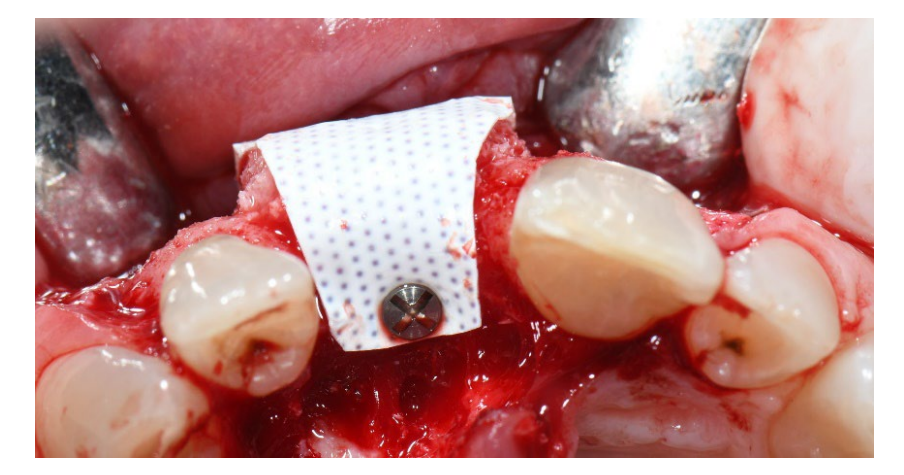
В обох групах 1 г амоксициліну (або 300 мг кліндаміцину) вводили кожні 12 годин протягом шести днів після видалення зуба та реконструкції кістки. Парацетамол 500 мг плюс кодеїн 30 мг призначали за потреби. Пацієнтів інструктували не приймати їх у відсутності болю. Спосіб застосування хлоргексидину у вигляді спрею 0,2% двічі на день протягом двох і п'яти тижнів був призначений у групах A і B відповідно. М'яка дієта рекомендувалася протягом двох тижнів після хірургічних процедур в обох групах.
У групі B, через вісім тижнів після видалення зуба, був зроблений внутрішньоясневий розріз за допомогою леза Bard-Parker № 15C, і був піднятий повнотканинний клапоть за межі мукогінгівального з'єднання та щонайменше на 5 мм за межі кісткового дефекту. Два вертикальні розрізи були зроблені щонайменше на один зуб від області, що підлягає збільшенню. Багаторазові декортикаційні отвори на місці отримання були виконані круглим бором. Залишковий альвеолярний лунка була пересаджена частинками кісткового матеріалу, отриманого з свиней (Zcore, DeOre). Потім колагенова мембрана (Cytoplast RTM Collagen, DeOre) була сформована відповідно до регенерованого кісткового дефекту і закріплена трьома-п'ятьма титановими шпильками (Supertack, MCbio s.r.l., Ломаззо, Італія) з боку щоки та язика/неба. Мембрана була підрізана до обсягу пересадки, на один-два міліметри перед поверхнею сусідніх зубів. Періостальний розріз був виконаний між двома вертикальними розрізами, щоб забезпечити повністю безнапружене закриття клаптя. Клапті були потім зашиті в два шари, щоб запобігти оголенню мембрани (Cytoplast PTFE Suture 4-0). Спочатку горизонтальні матрацні шви були накладені на відстані 4 мм від лінії розрізу; потім були накладені одиничні перервані шви для закриття країв клаптя. Вертикальні розрізи були зашиті одиничними перерваними швами. Одиничні перервані шви були видалені через 10-14 днів після операції, а матрацні шви були видалені через два-три тижні після операції. 1 г амоксициліну (або 300 мг кліндаміцину) вводили кожні 12 годин протягом восьми днів після видалення зуба та реконструкції кістки. Парацетамол 500 мг плюс кодеїн 30 мг призначали за потреби. Пацієнтів інструктували не приймати їх у відсутності болю.
Спрей хлоргексидину 0,2% призначався двічі на день протягом двох і п’яти тижнів відповідно в групах A і B. М’яка дієта рекомендувалася на 2 тижні після хірургічних процедур в обох групах.
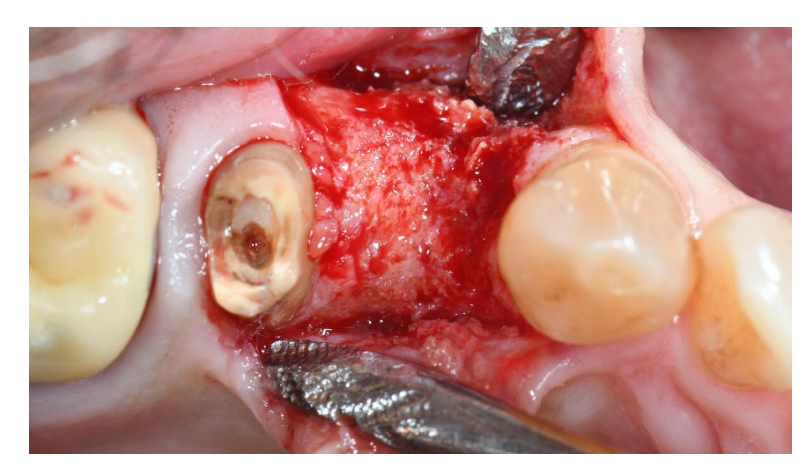
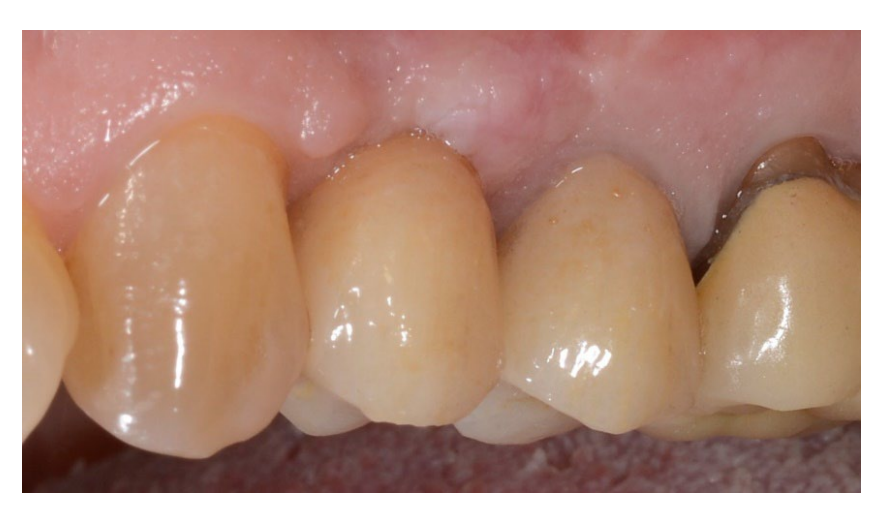
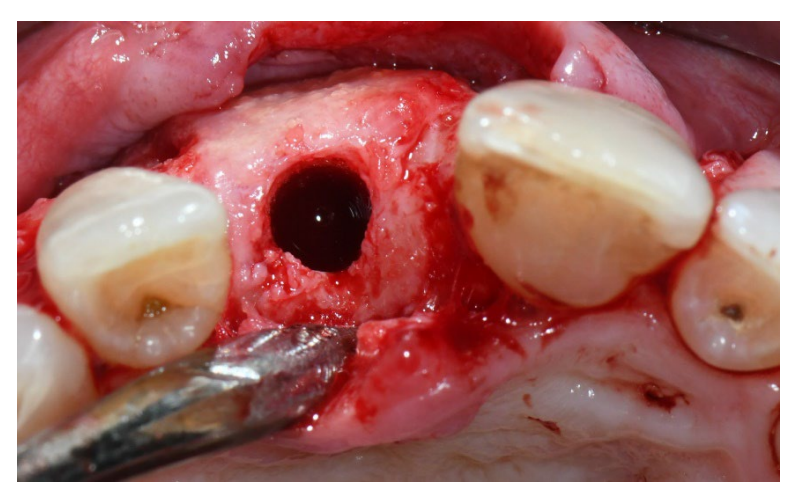
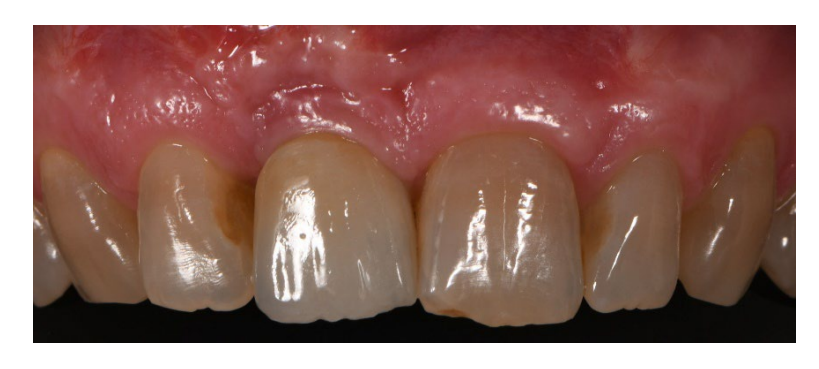
В обох групах, через шість-вісім місяців після видалення зуба (групи A і B відповідно), були встановлені зубні імплантати (Premium, Швеція та Martina, Due Carrare, PD, Італія). У жодному з випадків не було необхідності проводити додаткову GBR. Кількість кістки вважалася достатньою для встановлення імплантату діаметром 3,8 мм і довжиною 10 до 11,5 мм. Дизайн клаптя виконувався відповідно до клінічного сценарію та вимог пацієнта. Перед підготовкою місця для імпланта використовувався калібрований трефінний бур з зовнішнім діаметром 3,0 мм для збору зразка для гістологічного аналізу. Імплантати були занурені на три місяці. Через три місяці після встановлення імплантату була доставлена тимчасова реставрація на гвинтах. Нарешті, через два-три місяці після початкового навантаження була доставлена остаточна, гвинтова, CAD/CAM, безметалева реставрація. Оклюзія була відкоригована, а контрольні візити були заплановані кожні чотири місяці.
Результати вимірювань
- Невдача імпланта визначалася як рухливість імпланта та/або будь-яка інфекція, що вимагає видалення імпланта, перелом імпланта або будь-яка інша механічна ускладненість, що робить імплант непридатним. Крім того, стабільність кожного імпланта вимірювалася вручну шляхом затягування гвинта абатмента під час доставки остаточних коронок або шляхом оцінки стабільності коронки на імплантаті за допомогою ручки двох металевих інструментів під час кожного контролю.
- Будь-які механічні та біологічні ускладнення фіксувалися протягом усього періоду спостереження. Ті ж калібровані оператори, які виконували всі хірургічні та протезні процедури, оцінювали невдачі імплантів та ускладнення.
- Задоволеність пацієнтів оцінювалася сліпими операторами в кожному центрі, які раніше не брали участі в дослідженні. Під час доставки остаточних коронок незалежний оцінювач результатів запитав пацієнта наступні питання (можливі відповіді: “так” або “ні”):
- Чи задоволені ви функцією вашого зуба на імплантаті?
- Чи задоволені ви естетичним результатом вашого зуба на імплантаті?
- Чи погодилися б ви пройти таку ж терапію знову?
- Кількісні та якісні аналізи проводилися на анонімізованих зразках сліпим патологоанатомом. Якісна та гістоморфометрична оцінка. Після збору зразки кістки фіксувалися в 10% формаліні. Зразки дегідратувалися за зростаючою шкалою етанолу. Після дегідратації зразки інфільтрувалися метакрилатною смолою і потім вморожувалися в смолу (Technovit 7200, Bio Optica, Мілан). Усі зразки полімеризувалися за допомогою полімеризаційної машини (Exakt 520, Exakt Norderstedt, Німеччина). Отримані блоки різалися за допомогою пилки з алмазним лезом (Micromet, Remet, Болонья, Італія). Секції монтувалися на пластикові слайди за допомогою клеючої машини (Exakt 402, Exakt Norderstedt, Німеччина) та клеючої смоли (Technovit 7210, Bio Optica, Мілан, Італія) і потім шліфувалися до товщини 100 мкм за допомогою шліфувальної машини (LS2 Remet, Болонья, Італія). Для кожного зразка отримувалися дві репрезентативні поздовжні секції, які фарбувалися Толуїдиновим синім та Піроніновим жовтим для підкреслення різних фаз мінералізації кістки, і цифрово отримувалися при загальному збільшенні 400× за допомогою сканера високої роздільної здатності (Nanozoomer S60, Hamamatsu).
- Якісна оцінка мала на меті виявити кількість запального, фіброзного та жирового інфільтрату, а також можливі ділянки некрозу відповідно до вказівок, наведених у стандарті ISO 10993. Гістоморфометрична оцінка обсягу тканинних фракцій проводилася за допомогою стереологічного методу. Для кожної секції використовувалася цифрова сітка для підрахунку точок перетину, які потрапляють на кожен вид тканини (ламелярна кістка, плетена кістка, остеоїдна матриця, біоматеріал та медулярні простори), а відсотки обсягу фракцій отримувалися шляхом співвідношення між точками перетину, які потрапляють на кожен тип тканини, та загальними точками перетину сітки.
Статистичний аналіз
Розмір вибірки не був розрахований. Було вирішено залучити 30 пацієнтів, оскільки ця кількість відповідала можливостям поточних дослідницьких груп. Три списки рандомізації були створені онлайн на веб-сайті Random Sequence Generator (https://www.random.org). Лише один з дослідників (FMC), який не брав участі у відборі та лікуванні пацієнтів, знав про випадкову послідовність і міг отримати доступ до списків рандомізації, які зберігалися на портативному комп'ютері з паролем. Випадкові коди були поміщені в послідовно пронумеровані, однакові, непрозорі, запечатані конверти. Конверти відкривалися послідовно після того, як відповідні пацієнти підписали інформовану згоду; отже, розподіл лікування був прихований від дослідників, відповідальних за залучення та лікування пацієнтів. Через природу дослідження, після розподілу груп, хірурги не були сліпими. Тим не менш, зразки були анонімізовані, а гістологічна лабораторія була сліпою під час аналізів.
Всі аналізи даних були проведені відповідно до попередньо встановленого плану аналізу. Описовий аналіз був виконаний з використанням середнього ± стандартного відхилення (SD) за допомогою (Numbers for Mac V. 11.0 [7030.0.94], Apple Inc., Лос-Альтос, Каліфорнія, США). Дихотомічні результати порівнювалися між групами. Порівняння безперервних змінних проводилися за допомогою незалежного t-тесту. Всі статистичні порівняння проводилися на рівні значущості 0.05. Пацієнти використовувалися як статистична одиниця.
Результати
Схема потоку лікуваних пацієнтів наведена на малюнку 9. Пацієнтів потрібно було набрати та лікувати за допомогою подібних процедур у трьох різних центрах, і кожен центр повинен був набрати та лікувати 10 пацієнтів. Однак лише один центр набрав усіх запланованих пацієнтів, тоді як інші два центри набрали по чотири пацієнти кожен. Причинами ненабору 12 пацієнтів були: часті візити на огляди (10 пацієнтів) та відмова від керованої регенерації кістки (два пацієнти). Врешті-решт, 18 пацієнтів були послідовно включені в дослідження з когорті з 30 пацієнтів, які спочатку були перевірені на відповідність. Вісім пацієнтів були випадковим чином розподілені в групу A, тоді як 10 пацієнтів були випадковим чином розподілені в групу B. З них шість з 18 пацієнтів були чоловіками.
Усі включені пацієнти отримали лікування відповідно до призначених втручань. Перший пацієнт був пролікований у листопаді 2018 року, а останнє хірургічне лікування розпочалося у вересні 2020 року. Жоден пацієнт не вибув з дослідження, і відхилень від початкового протоколу не було; отже, всі пацієнти отримали фінальні коронки. Середній термін спостереження після доставки протезів становив від 6 до 30 місяців. Середній вік пацієнтів становив 56,9 ± 11,9, жоден з яких не курив. Було встановлено вісімнадцять імплантатів, розподілених на вісім у тестовій групі (збереження лунки, група A) та 10 у контрольній групі (GBR, група B). Дані всіх включених пацієнтів були оцінені в статистичних аналізах. Порівнюючи протестовані групи, немає дисбалансу між ними, включаючи позицію та розподіл зубів (Таблиця 1).
Невдача імпланта, ускладнення та задоволеність пацієнтів
Ніяких невдач імплантів та ускладнень не було. Крім того, всі пацієнти були повністю задоволені функцією та естетикою своїх відновлень на імплантах, і не було жодних відмінностей у їхньому сприйнятті терапії, тому всі пацієнти погодилися б на ту ж терапію.
Гістоморфометричний аналіз
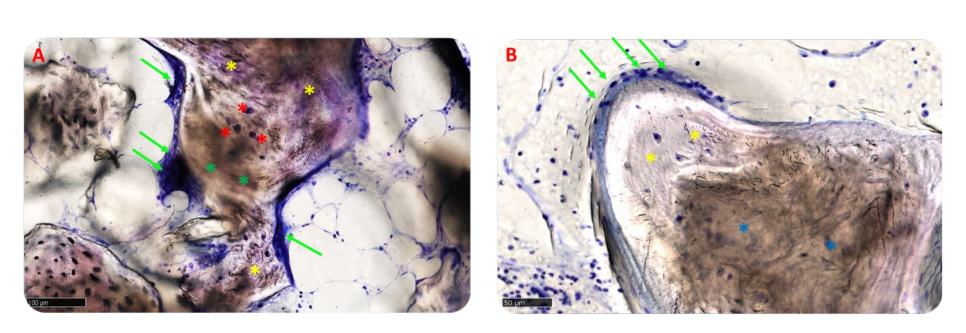
Морфологічний аналіз не виявив ознак реакції тканин, таких як фіброз або некроз. Відновлена кістка була добре мінералізована в обох групах, але здавалася більш зрілою в групі B, ніж у групі A, що можна спостерігати на малюнку 10A,B, який показує огляди представницьких зразків.
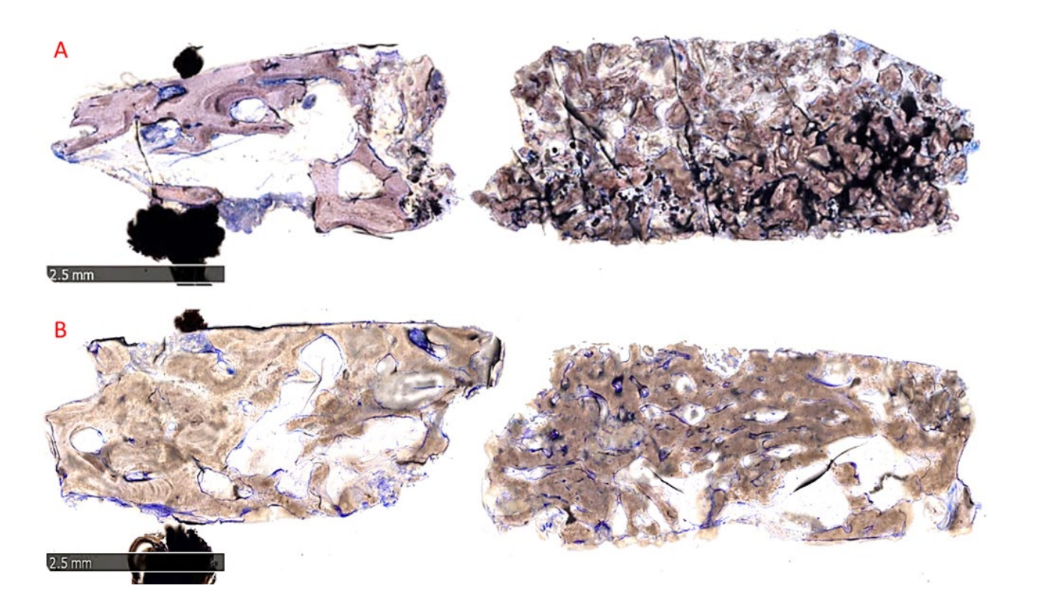
У групі A пересаджені частинки були повністю вмонтовані в кісткову матрицю і, здавалося, проходили інтенсивну ремоделювання з проміжним ступенем мінералізації. На межі між залишковими блоками та новоутвореною кісткою не було видно жодних зазорів (Рисунок 11A). У групі B кісткова матриця, що оточувала частинки біоматеріалу, демонструвала високий рівень мінералізації та остеоінтеграції з балансом утворення кістки (анаболічна фаза) та деградації кістки (катаболічна фаза), що підтверджується наявністю деяких фронтів ремоделювання кістки та кількома остеокластами (Рисунок 11B).
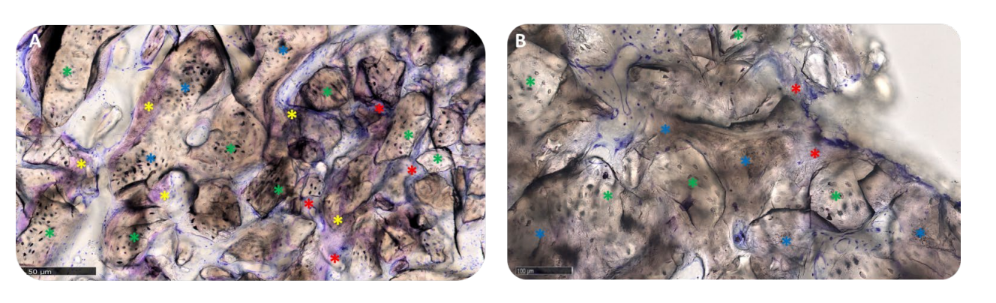
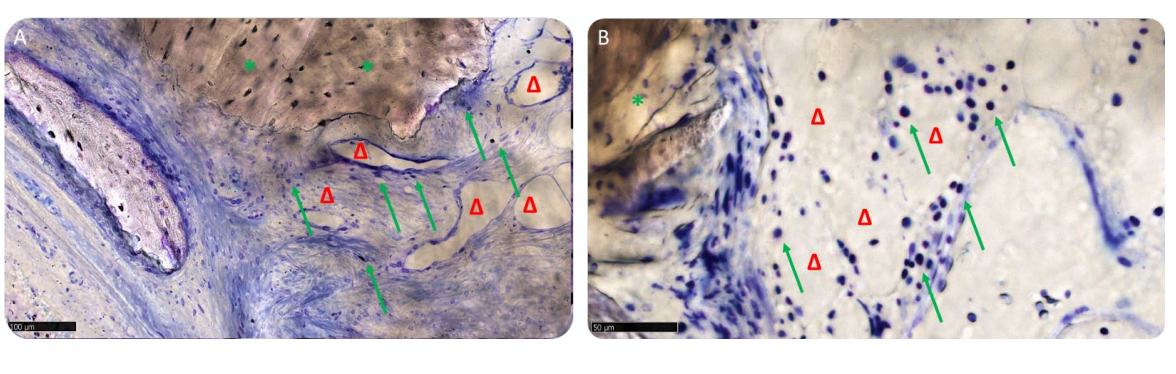
Матриця була в активній анаболічній фазі: кісткові ділянки складалися з новоутвореної ламелярної, мінералізованої кістки, з остеоцитами в кальцифікованій матриці та передній частині ремоделювання, населеній активними остеобластами та кількома остеокластами, особливо в групі A (Рисунок 12A,B).
Три зразки показали мінімальну кількість лімфоцитів, тоді як решта зразків обох груп містила лише деякі розсіяні запальні клітини (Рисунок 13A,B). Кілька кровоносних судин малого розміру займали медулярні простори, де тканина виявилася більш зрілою, що потенційно вказує на активність тканини в процесі.
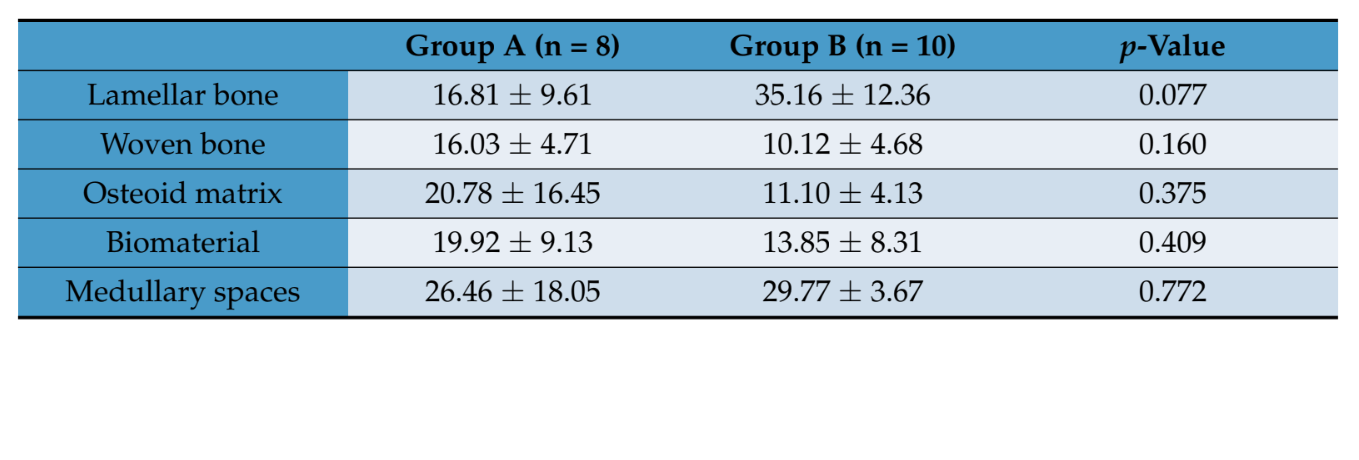
Гістоморфометрична оцінка не виявила статистично значущих відмінностей у обсягах тканин між двома групами пацієнтів (Таблиця 2). Однак у групі B ламелярна кістка мала вищу середню величину, ніж та, що була отримана в групі A, де новоутворена кісткова матриця в основному була представлена менш зрілою матрицею, такою як остеоїд і плетена кістка.
Обговорення
Це дослідження було спроектовано як рандомізоване контрольоване випробування, метою якого було відповісти на наступне питання: яке рекомендоване лікування для імплантаційної реабілітації резидуальних лунок класу II Еліана між нерозчинною, високощільною мембраною з політетрафторетилену (d-PTFE), яка залишалася навмисно відкритою протягом 4 тижнів після видалення зуба, та збереження лунки з використанням анорганічного кісткового матеріалу, а також видалення зуба з подальшою керованою регенерацією кістки, що проводилася через два місяці? Результати даного дослідження не виявили жодного переважного лікування над іншим, отже, нульова гіпотеза про відсутність статистично значущих відмінностей між двома протестованими процедурами була прийнята.
Хоча результати даного дослідження є подібними між групами, основна перевага запропонованої техніки збереження лунки з нерозчинною мембраною може бути дійсно валідним варіантом, оскільки вона дозволяє зменшити загальний час лікування та витрати для пацієнта. Ці переваги в основному обумовлені тим, що вона може зменшити потребу в інших регенеративних техніках, не погіршуючи кінцеві результати, передбачуваність імплантаційного лікування і, що не менш важливо, задоволеність пацієнта.
Непошкоджена щічна пластина (дефект класу 1 за Еліаном) вважається передумовою стабільності м'яких тканин в області, що оточує імплантат, а отже, і для довгострокових естетичних результатів, особливо у випадках високих естетичних вимог. Безперервна резорбція тонкої щічної кісткової пластини може призвести до високого ризику резорбції ясен з часом. Лікування передніх дефектів часто вимагає повторної операції, що складається з додаткових процедур регенерації кістки, щоб забезпечити протезно орієнтоване введення імплантатів. Однак ці процедури зазвичай не є більш прийнятними для пацієнтів через їх інвазивність і вартість. Запропонована техніка використання нерозчинної мембрани для тимчасового ремонту пошкодженої щічної стінки, навмисно залишеної відкритою над пересадженим лункою, здається обнадійливою та простою, вимагаючи менше хірургічних процедур. У даному дослідженні не було виявлено жодних відмінностей щодо гістологічного кількісного дослідження. Насправді, реконструкція щічної пластини з навмисно відкритою нерозчинною мембраною здається ефективною та простою процедурою для регенерації резорбованої щічної кісткової пластини, потенційно зменшуючи потребу в керованій регенерації кістки. Запропонована техніка може бути сильно прийнята пацієнтами завдяки зменшеній інвазивності.
Біологічна причина чекати чотири-шість тижнів перед використанням мембрани d-PTFE полягає в тому, щоб дочекатися закінчення початкової фази загоєння, перед процесом ремоделювання кістки. На цьому етапі, під мембраною d-PTFE, можна очікувати повного закриття м'яких тканин. Мембрана d-PTFE може діяти як каркас, що спрямовує загоєння нових м'яких тканин, зберігаючи опуклу форму альвеолярного гребеня. Навпаки, в групі GBR рекомендовано період у вісім тижнів перед повним відновленням м'яких тканин, відповідно до Бусера та співавторів.
Нерозсмоктувальна мембрана працює як бар'єр, що дозволяє відокремити м'які тканини від кістки на 4-6 тижнів, що є необхідним часом для досягнення стабілізації кров'яного згустку. Видалення нерозсмоктувальної мембрани після цього періоду, здається, дає достатньо часу для того, щоб всередині лунки відбулася диференціація мезенхімальних клітин в остеобласти, виключаючи фібробласти з ясеневого клаптя, і врешті-решт призводить до утворення та дозрівання нової кістки. Для цього важливо, щоб пацієнт підтримував хірургічну рану в чистоті та дезінфекції. Однак подібні рекомендації були надані для обох технік. У порівнянні з поетапною керованою регенерацією кістки, представлена техніка дозволяє доставити остаточне відновлення за коротший час, потенційно покращуючи прийнятність пацієнтів, а також потенційно знижуючи загальні витрати.
У гістологічному дослідженні у людей біопсія була взята через 4 тижні в момент видалення мембрани. Результати цього гістологічного дослідження продемонстрували, що, навіть якщо не резорбована мембрана d-PTFE була навмисно залишена відкритою, епітеліальна тканина над щільною сполучною тканиною не була виявлена. Це відкриття може свідчити про те, що новоутворена сполучна тканина, здається, є добре васкуляризованою остеоїдною матрицею. Проте, для завершення дозрівання та перетворення на мінералізовану тканину потрібно більше часу, що дозволить провести імплантацію. Загальний період становить від 3 до 5 місяців. В основному, це залежить від типу та розміру дефекту та біоматеріалу, використаного для пересадки лунки. У іншому гістологічному дослідженні тестова група отримала комбінацію 70% мінералізованого та 30% демінералізованого кортикального аллографтного матеріалу, який використовувався для пересадки лунки після видалення зуба, покритої навмисно відкритою, не резорбованою мембраною d-PTFE. Отримані результати оцінювалися по місцях з контрольною групою, для якої використовувався лише мінералізований аллографтний матеріал. Біопсії продемонстрували збільшене утворення життєздатної кістки (36.16%) з відповідним зменшенням залишкового графту (18.24%) у тестовій групі, порівняно з контрольними випадками, з 100% групою мінералізованого кісткового аллографту (24.69% та 27.04% відповідно).
Результати цього дослідження узгоджуються з нещодавнім систематичним оглядом Cochrane, який завершився висновком, що техніки збереження альвеолярного гребеня можуть мінімізувати загальні зміни у висоті та ширині залишкового гребеня після видалення зубів. Проте, докази є дуже невизначеними.
Через відсутність розрахунку розміру вибірки, основним обмеженням цього дослідження була менша вибірка. Іншим обмеженням, яке може змінити внутрішню та зовнішню валідність результатів, була відсутність калібрування хірургів. Проте всі хірурги, залучені до цього дослідження, були навчены виконувати два пояснювальні випадки перед початком випробування. Нарешті, верхня щелепа та нижня щелепа мають різні темпи та патерни резорбції кістки, що може вплинути на прогноз. Проте, рандомізація дозволила отримати дві збалансовані групи, без статистичних відмінностей між ними. Тому результати цього попереднього звіту надають кількісні гістологічні дані про кістку, реконструйовану з використанням не резорбованої мембрани d-PTFE, або керованої регенерації кістки для лікування постекстракційних дефектів альвеолярної кістки з імплантатами. Хоча запропонована техніка відкритого загоєння ран була порівняна з класичною керованою реконструкцією кістки, ці попередні результати заохочують цей підхід. Також є дослідження, що порівнюють клітинну дермальну матрицю з мембраною політетрафторетилену (PTFE), досягаючи подібних багатообіцяючих результатів. Тому потрібні подальші клінічні та радіологічні дослідження з тривалішим спостереженням, щоб підтвердити ці багатообіцяючі клінічні результати.
Висновки
З урахуванням обмежень даного пілотного дослідження, реконструкція щічної пластини з навмисно відкритою не резорбованою мембраною, здається, є ефективною та простою процедурою для регенерації резорбованої щічної кісткової пластини, що зменшує потребу в керованій регенерації кістки. Потрібні подальші дослідження з більшою вибіркою, щоб підтвердити цей попередній результат.
Роберто Луонго, Марко Талларіко, Елена Канчані, Даніеле Граціано, Клаудія Деллавія, Марко Гаргарі, Франческо Маттіа Черузо, Даріо Мелодія та Луїджі Канулло
Посилання
- Маркус, С.; Дрюрі, Т.; Браун, Л.; Зіон, Г. Утримання зубів та втрата зубів у постійній зубній системі дорослих: Сполучені Штати, 1988–1991. J. Dent. Res. 1996, 75, 684–695.
- Мекал, А.Р.; Розенфельд, А.Л. Вплив патернів резорбції залишкових гребенів на розташування імплантантів та позицію зубів. Int. J. Periodontics Restor. Dent. 1991, 11, 8–23.
- Ван дер Вейден, Ф.; Делл’Аква, Ф.; Слот, Д.Е. Зміни розмірів альвеолярної кістки після видалення зубів у людей: систематичний огляд. J. Clin. Periodontol. 2009, 36, 1048–1058.
- Мелоні, С.М.; Йованович, С.А.; Пізано, М.; Де Ріу, Г.; Бальдоні, Е.; Талларіко, М. Одноетапна горизонтальна керована регенерація кістки з використанням аутологічної кістки, неорганічної бичачої кістки та колагенових мембран: спостереження за перспективним дослідженням через 30 місяців після навантаження. Eur. J. Oral Implant. 2018, 11, 89–95.
- Кан, J.Y.K.; Рунгчарассаенг, К.; Лозада, J.L.; Циммерман, Г. Стабільність тканини ясен обличчя після негайного встановлення та провізоризації одиночних імплантатів у верхній щелепі: спостереження через 2–8 років. Int. J. Oral Maxillofac. Implant. 2011, 26, 179–187.
- Зубільяга, Г.; Фон Хаген, С.; Саймон, Б.І.; Діасі, М.Й. Зміни висоти та ширини альвеолярної кістки після збільшення гребеня з використанням фіксованої біоабсорбованої мембрани та демінералізованого замороженого остеоіндуктивного трансплантату. J. Periodontol. 2003, 74, 965–975.
- Дарбі, І.; Чен, С.Т.; Бузер, Д. Техніки збереження гребеня для імплантної терапії. Int. J. Oral Maxillofac. Implant. 2009, 24, 260–271.
- Талларіко, М.; Ханарі, Е.; Пізано, М.; Гатті, Ф.; Мелоні, С.М. Заміс зуба моляра з імплантатами діаметром 7 мм: встановити імплантат негайно чи почекати 4 місяці після збереження лунки? Результати через 1 рік після навантаження з рандомізованого контрольованого дослідження. Eur. J. Oral Implant. 2017, 10, 169–178.
- Канулло, Л.; Марін, Г.В.; Талларіко, М.; Канчані, Е.; Мусто, Ф.; Деллавія, К. Гістологічна та гістоморфометрична оцінка постекстракційних ділянок, пересаджених з Mg-бага́тою нано-гідроксиапатитною мембраною: рандомізоване контрольоване дослідження, що порівнює 4 та 12 місяців загоєння. Clin. Implant. Dent. Relat. Res. 2015, 18, 973–983.
- Мелоні, С.М.; Талларіко, М.; Лоллі, Ф.М.; Деледда, А.; Пізано, М.; Йованович, С.А. Збереження лунки після видалення зуба з використанням епітеліальної сполучнотканинної пересадки проти свинячої колагенової матриці. Результати через рік з рандомізованого контрольованого дослідження. Eur. J. Oral Implant. 2015, 8, 39–48.
- Папі, П.; Ді Мурро, Б.; Тромба, М.; Пассареллі, П.Ц.; Д’Аддона, А.; Помпа, Г. Використання не абсорбованої мембрани як оклюзійного бар'єру для збереження альвеолярного гребеня: перспективне когортне дослідження з однорічним спостереженням. Antibiotics 2020, 9, 110.
- Сун, Д.-Дж.; Лім, Х.-Ц.; Лі, Д.-В. Збереження альвеолярного гребеня з використанням відкритого мембранного підходу для лунок з дефіцитом кістки: рандомізоване контрольоване клінічне дослідження. Clin. Implant Dent. Relat. Res. 2018, 21, 175–182.
- Хацопулос, Г.С.; Коїду, В.П.; Сонненбергер, М.; Джонсон, Д.; Чу, Х.; Вольф, Л.Ф. Збереження гребеня після видалення зуба з використанням щільних мембран PTFE: систематичний огляд та мета-аналіз. J. Prosthet. Dent. 2022.
- Карбонель, Дж.М.; Мартін, І.С.; Сантос, А.; Пухоль, А.; Санц-Молінер, Дж.Д.; Нарт, Дж. Мембрани з високої щільності політетрафторетилену в процедурах керованої регенерації кістки та тканин: огляд літератури. Int. J. Oral Maxillofac. Surg. 2014, 43, 75–84.
- Атієх, М.А.; Альсабіха, Н.Х.М.; Пейн, А.Г.Т.; Дункан, В.; Фаджіон, С.М.; Еспозіто, М. Втручання для заміни втрачених зубів: техніки збереження альвеолярного гребеня для розвитку ділянки зубного імплантату. Cochrane Database Syst. Rev. 2021, CD010176.
- Корбелла, С.; Тасчьєрі, С.; Франчетті, Л.; Вайнштейн, Р.; Дель Фаббро, М. Гістоморфометричні результати після загоєння лунки після видалення зуба з різними біоматеріалами: систематичний огляд літератури та мета-аналіз. Int. J. Oral Maxillofac. Implant. 2017, 32, 1001–1017.
- Еліан, Н.; Чо, С.-Ц.; Фрум, С.; Сміт, Р.Б.; Тарнов, Д.П. Спрощена класифікація лунки та техніка ремонту. Pract. Proced. Aesthetic Dent. 2007, 19, 99–104.
- Бузер, Д.; Шапюї, В.; Бельсер, У.Ц.; Чен, С. Встановлення імплантату після видалення зуба в естетичних одиничних ділянках: коли негайно, коли рано, коли пізно? Пародонтологія 2000 2017, 73, 84–102.
- Канчані, Е.; Рагоне, В.; Біффі, К.А.; Валенца, Ф.; Д’Амбросі, Р.; Олімпо, М.; Кристофало, А.; Гальєра, Е.; Деллавія, К. Розуміння ролі модифікації поверхні рандомізованих трабекулярних титанових структур у регенерації кісткової тканини: експериментальне дослідження. Medicina 2022, 58, 315.
- Кан, J.Y.K.; Рунгчарассаенг, К.; Лозада, J.L. Негайне встановлення та провізоризація одиничних імплантатів у верхній щелепі: перспективне дослідження на 1 рік. Int. J. Oral Maxillofac. Implant. 2003, 18, 31–39.
- Бамбіні, Ф.; Орілісі, Г.; Куаранта, А.; Мемè, Л. Біологічно орієнтоване негайне навантаження: новий математичний протокол вертикальної вставки імплантату, п’ятирічне спостереження. Materials 2021, 14, 387.
- Чен, С.Т.; Бузер, Д. Естетичні результати після негайного та раннього встановлення імплантатів у передній верхній щелепі — систематичний огляд. Int. J. Oral Maxillofac. Implant. 2014, 29, 186–215.
- Барті, Б.К. Спрощена техніка збереження гребеня після видалення зуба. Dent. Today 1995, 14, 62–67.
- Лауріто, Д.; Кугнетто, Р.; Лоллобриджида, М.; Герра, Ф.; Вестрі, А.; Джанно, Ф.; Боско, С.; Ламаза, Л.; Де Біазе, А. Збереження лунки з мембраною d-PTFE: гістологічний аналіз новоутвореної матриці після видалення мембрани. Int. J. Periodontics Restor. Dent. 2016, 36, 877–883.
- Бек, Т.М.; Мілі, Б.Л. Гістологічний аналіз загоєння після видалення зуба з збереженням гребеня з використанням мінералізованого людського кісткового аллографту. J. Periodontol. 2010, 81, 1765–1772.
- Борг, Т.Д.; Мілі, Б.Л. Гістологічне загоєння після видалення зуба з збереженням гребеня з використанням мінералізованого та комбінованого мінералізованого-демінералізованого замороженого кісткового аллографту: рандомізоване контрольоване клінічне дослідження. J. Periodontol. 2015, 86, 348–355.
- Краузер, Дж.Т. Мембрани з високою щільністю PTFE: використання з імплантатами у формі кореня. Dent. Implant. Update 1996, 7, 65–69.
- Фотек, П.Д.; Нейва, Р.Ф.; Ван, Х.-Л. Порівняння дермальної матриці та мембрани політетрафторетилену для збільшення кістки лунки: клінічне та гістологічне дослідження. J. Periodontol. 2009, 80, 776–785.
