Рандомізоване контрольоване дослідження регенерації кістки для дефектів пері-імплантації з використанням двох неорганічних матеріалів на основі бичачої кістки, покритих титановими сітками
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Метою цього дослідження є порівняння двох матеріалів з анорганічної коров'ячої кістки, що спечені при низькій температурі (ABBMs), Bio-Oss (Geistlich, Вольгусен, Швейцарія) та A-Oss (Osstem, Сеул, Корея), для GBR у дефектах декісенції. Один імплантат був встановлений одночасно з GBR у щічному або щічно-проксимальному кістковому дефекті шляхом двошарового накладання внутрішнього аллографту та зовнішнього ABBM, покритого попередньо сформованою ультратонкою титановою сіткою та абсорбованою колагеновою мембраною. Зміни обсягу трансплантату оцінювалися за допомогою конусно-променевої комп'ютерної томографії, проведеної до операції (T0), безпосередньо після хірургії імпланта (T1), після повторного втручання (T2) та після доставки остаточного відновлення (T3). Щільність регенерованої кістки оцінювалася шляхом вимірювання глибини зондування в щічному середньому центрі сітки після видалення сітки на T2. Також були зафіксовані післяопераційні наслідки. Зменшення обсягу трансплантату на 46,0% (0.78 ± 0.37 cc) та 40,8% (0.79 ± 0.33 cc) у групі Bio-Oss (8 пацієнтів) та групі A-Oss (8 пацієнтів) відповідно було зафіксовано на T3 (p < 0.001). Не було виявлено значних відмінностей у змінах обсягу трансплантату за періодами часу або щільності кістки між двома групами. Незважаючи на післяопераційне експонування сітки (3 пацієнти), передчасне видалення цих експонованих сіток та додаткове трансплантування не було необхідним, і всі імплантати функціонували протягом 1-річного періоду спостереження. Обидва ABBMs з титановими сітками не показали значних відмінностей у кількості та щільності регенерованої кістки після GBR для пері-імплантаційних дефектів.
Вступ
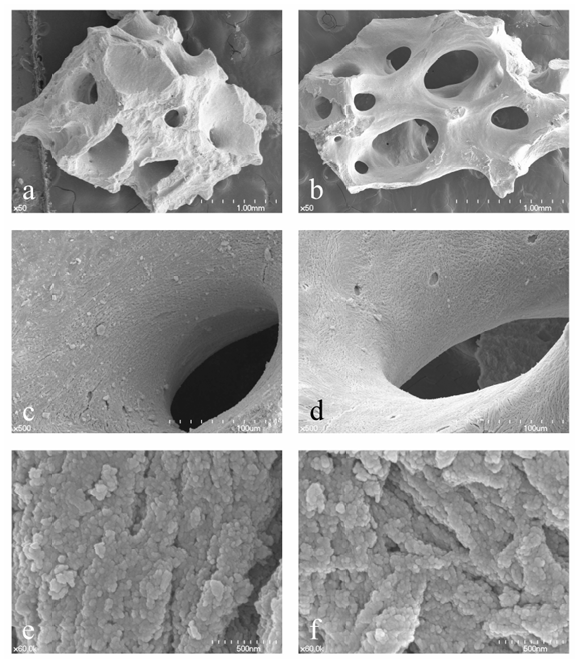
Інноваційні пристрої та технології для зменшення захворюваності, біологічного та хірургічного часу є інтенсивною темою досліджень у імплантології, а керована регенерація кістки (КРК) є хірургічною процедурою збільшення об'єму кістки для зубних імплантів, що використовує різні матеріали для кісткової пересадки з одночасними бар'єрними мембранами. Аноорганічні матеріали з великої рогатої худоби (АМВР) широко використовуються як остеокондуктивний матеріал для операцій підняття синуса, збереження гребеня, хірургії імплантів безпосередньо після видалення зуба та КРК. Унікальною перевагою АМВР є їхня здатність підтримувати об'єм з повільною заміною новою кісткою в порівнянні з аутогенними та алогенними матеріалами для пересадки кістки. Існує багато інших типів АМВР, які спікалися при високій температурі або базуються на свинині та конях; однак, АМВР на основі великої рогатої худоби та спечені при низькій температурі, здається, домінують на стоматологічному ринку. Історично, Bio-Oss (Geistlich, Wolhusen, Швейцарія) довгий час вважався золотим стандартом завдяки сильним науковим доказам; тим не менш, A-Oss (Osstem, Сеул, Корея) є АМВР, виробленим хімічною обробкою з ароматичним та сильним лужним розчинником, а в кінцевому підсумку шляхом процесу низькотемпературного відпалу нижче 400°C з надзвичайно низькою швидкістю нагрівання (<0.3°C за хвилину). Фізико-хімічна характеристика A-Oss, яка може бути суттєво еквівалентною характеристикам Bio-Oss з точки зору як вищої пористості, так і нижчої кристалічності, тісно пов'язана з меншою деградацією та активністю ремоделювання в порівнянні з іншими ксенографтами (Рисунок 1).
У галузі оральної та щелепно-лицевої хірургії титанові сітки широко використовуються для випадків, що потребують великої кількості реконструкції кістки завдяки своїй природній біосумісності та жорсткості як легкого металу. Особливо нещодавнє впровадження попередньо сформованої ультратонкої титанової сітки, яка безпосередньо з'єднується та фіксується на імплантаті, підвищило її популярність у GBR для кісткових дефектів навколо імплантатів. Стійка до колапсу протягом усього періоду загоєння GBR, ця ультратонка титансова сітка має численні пори різного розміру для оптимальних результатів GBR.
Метою цього рандомізованого контрольованого клінічного випробування було порівняти два ABBM, що спікалися при низькій температурі, Bio-Oss та A-Oss, які використовуються в GBR для реконструкції дефекту декомпенсації навколо імплантату, у поєднанні з ультратонкою титановою сіткою. Наскільки нам відомо, це перше дослідження, яке вимірює та порівнює тривимірні об'ємні зміни ABBM для цілей GBR. Нульова гіпотеза полягала в тому, що не було різниці в змінах у обсязі трансплантату (кількість кістки), щільності (якість кістки) відновленої кістки та післяопераційних наслідках між групами.
Матеріали та методи
Це дослідження було спроектовано як рандомізоване контрольоване випробування з паралельним дизайном груп і проводилося в Дивізії оральної та щелепно-лицевої хірургії, Кафедрі стоматології, лікарні Ханянг, між червнем 2018 року та липнем 2019 року. Дослідження було схвалене Інституційною наглядовою радою лікарні Ханянг (IRB No. 2018-03-006) і зареєстроване в міжнародній платформі реєстрації клінічних випробувань ВООЗ (KCT0004906). Воно проводилося відповідно до Декларацій Гельсінкі та міжнародно визнаних рекомендацій для РКВ, включаючи заяву CONSORT (отримано 2 березня 2018 року). Усі хірургічні та протезні процедури виконувалися одним експертом-імплантологом (C.-J.P.).
Вибір пацієнтів
Після передопераційних клінічних та радіологічних обстежень, включаючи конусно-променеву комп'ютерну томографію (КТ), будь-який здоровий пацієнт віком від 18 років, якому потрібно було встановлення одного імплантату в загоєному альвеолярному гребені з GBR для дефекту періімплантної декісації, коли імплантат був змодельований у позиції, що відповідає протезуванню (OneGuide, Osstem, Сеул, Корея), був включений у це дослідження після надання інформованої згоди. Зокрема, кісткові дефекти повинні були обмежуватися лише щічною та/або проксимальною стороною і не повинні були зачіпати поверхню сусіднього зуба або язикову сторону. Критерії виключення включали необхідність у більш ніж двох послідовних імплантатах та наявність системних або локальних протипоказань для встановлення імплантатів, включаючи історію неконтрольованих метаболічних розладів, куріння, бруксизм або неконтрольовану пародонтальну хворобу. Зареєстровані пацієнти були проінформовані про хірургічні процедури, матеріали, що будуть використані, переваги та потенційні ризики і ускладнення цього клінічного дослідження, і була отримана письмова інформована згода.
Хірургічна процедура
Усі процедури виконувалися під місцевою анестезією та помірною внутрішньовенною седативною терапією. Було піднято повнотовстий клапоть, і всі грануляційні тканини були ретельно видалені. Початкове свердління з маркуванням кортикальної кістки виконувалося за допомогою направляючого свердла. Послідовні конусні свердла використовувалися для підготовки місця для імпланта (набір OneGuide або набір 122 Taper, Osstem), і особлива увага приділялася отриманню правильного тривимірного положення імпланта. Дентальний імплант (TS III SOI, Osstem, або T01 SA, Toplan, Сеул, Корея) був встановлений на 1 мм субкресельно до лінгвальної або піднебінної альвеолярної гребінки, і навколо верхівки імпланта виник дефект декісації, що оголив щічні та/або проксимальні різьби імпланта.
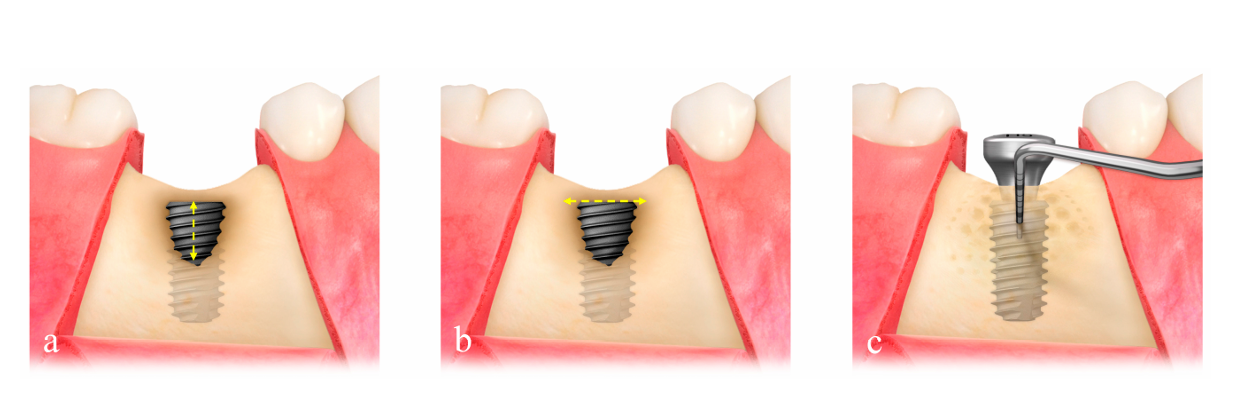
Розмір дефекту (мм) складався з висоти дефекту, яка вимірювалася від верхівки імпланта до першого контакту кістки з імплантом, та ширини дефекту, яка вимірювалася від мезіальної до дистальної кісткової гребінки на рівні верхівки імпланта (Рисунок 2a,b). Попередньо сформована ультратонка титановая сітка (OssBuilder, Osstem), яка найбільше відповідала виміряному розміру дефекту, була обрана з різних лінійок типу I для щічного дефекту декісації та типу II для комбінованого щічно-проксимального дефекту декісації (Рисунок 3). За необхідності було проведено незначне підрізання та контурування титанової сітки для кращого утримання матеріалу для пересадки. Було виконано кілька отворів у кістковому мозку для стимуляції остеогенних клітин для швидшої та кращої регенерації кістки.
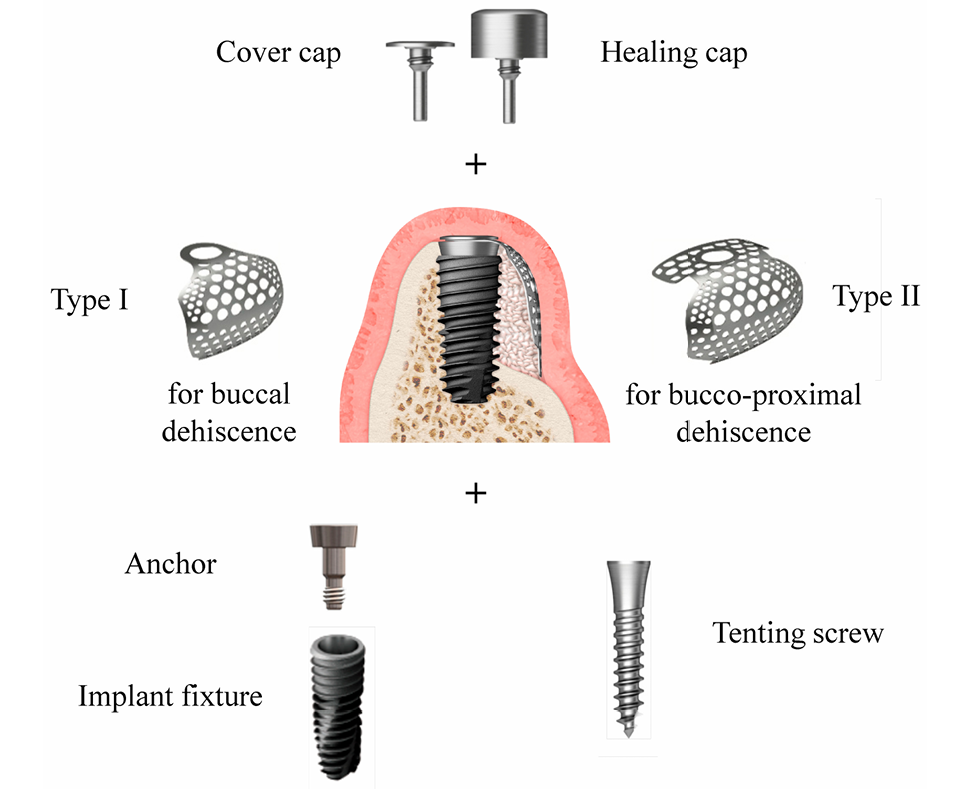
Згідно з конвертом рандомізації, пацієнти були розподілені на дві групи: група Bio-Oss та група A-Oss. Відкриті різьби імпланта були покриті замороженим кістковим алографтом (FDBA; SureOss, HansBiomed, Сеул, Корея) і накриті ABBM, Bio-Oss або A-Oss у співвідношенні 1:1 за об'ємом для підтримки контуру. Закріплювальна частина, яка з'єднує імплант і попередньо формовану ультратонку титанова сітку, була затягнута вручну на імпланті, а вибрана ультратонка титанова сітка була застосована на цьому анкері, щоб утримувати весь матеріал для пересадки (Рисунок 3). Якщо імплант був вставлений з моментом затягування
≤30 Ncm або значення коефіцієнта стабільності імплантату ≤70, кришка була підключена до титанової сітки відповідно до зануреного підходу. Якщо ні, то кришка загоєння була негайно підключена відповідно до незануреного підходу. Абсорбційна колагенова мембрана (OssGuide, SK Bioland, Чеонан, Корея) або OssMem hard (Osstem) була адаптована на титанову сітку, щоб мінімізувати ризик витончення надлишкової ясеневої тканини, що призводить до раннього оголення титанової сітки. Періост повнокомпонентного клаптя був звільнений для безнапружного первинного закриття рани. Пацієнти отримували знеболювальні та антибіотики протягом 10 днів для контролю післяопераційного болю та інфекції. Полоскання рота хлоргексидином також призначалося двічі на день. Шви були видалені через 10 днів після операції.
Через 8 місяців після операції була проведена повторна операція з використанням подібного дизайну клаптя під місцевою анестезією. Після видалення титанової сітки була оцінена щільність кістки за допомогою глибини зондування, яка вимірювалася в регенерованій кістці під серединою титанової сітки, використовуючи контрольовану силу, 0.25 N (Рисунок 2c). Кришка або кришка загоєння була замінена на абатмент загоєння, а клапті були відрегульовані та зашиті. Шви були видалені через 10 днів після операції. Після повторної операції м'яка тканина навколо абатмента загоєння була дозволена загоїтися перед зняттям відбитків. Одна тимчасова реставрація була інтегрована з титановим індивідуальним абатментом для прогресивного навантаження, а остаточна реставрація була доставлена через 12 місяців після операції. Будь-які післяопераційні наслідки в процедурах GBR були зафіксовані відповідно до попередньої класифікації ускладнень GBR та лікувалися тим самим хірургом (C.-J.P.).
Оцінка об'єму трансплантату
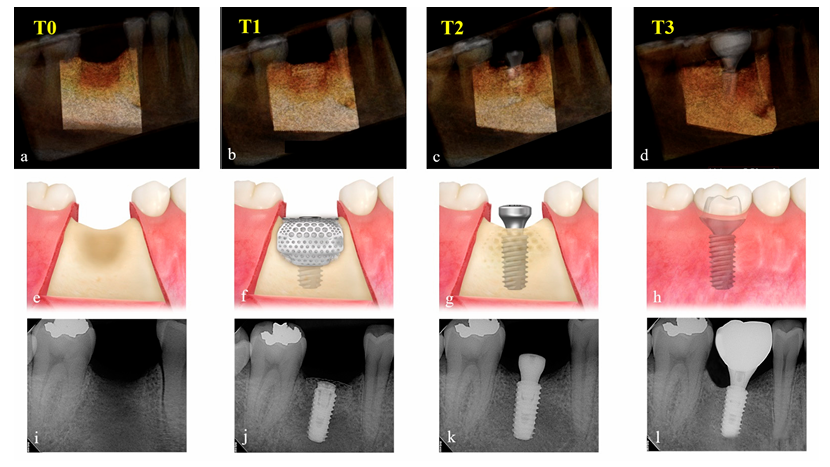
Зміни в збільшеному об'ємі матеріалу трансплантату оцінювалися шляхом порівняння даних КТ з конусним променем (CBCT), отриманих до операції (T0), відразу після хірургії імпланта та GBR (T1), після повторного втручання (T2) та після доставки остаточного відновлення (T3). Параметри експозиції для сканування CBCT (поле зору 35 × 50 мм; розмір вокселя 0.2 мм; час 10.8 с; kV 75; mA 10; доза на одиницю площі 240 мГр·см2) були встановлені на найнижчому рівні, який можна досягти (ALARA). Використовуючи програмне забезпечення Aquarium iNtuition (TeraRecon, Durham, NC, USA), місце імпланта було реконструйовано в тривимірне зображення та сегментовано як область інтересу (ROI) з використанням сусідніх анатомічних структур, таких як сусідні зуби, підлога синуса та нижній альвеолярний канал. Відділи, які є радіологічно однорідними за щільністю та розміром, такі як тіло імпланта та абатмент для загоєння, були відняті, а об'єм (cc) в ROI був розрахований відповідно до часових періодів (Рисунок 4) незалежним сліпим експертом (K.-G.H.). Оскільки це програмне забезпечення широко використовується в медичній сфері для точного виявлення закритої частини основних судин та точного вимірювання об'єму органу для трансплантації, воно було застосоване для цього дослідження для вимірювання об'єму ROI з метою доповнення технології КТ.
Статистичний аналіз
Розмір вибірки був визначений для забезпечення 90% потужності тесту при мінімумі α = 0.05 відповідно до припущення про рівність дисперсій на основі середніх значень всередині групи та між групами з попереднього рандомізованого контрольованого дослідження, що порівнювало Bio-Oss та кальційфосфатне покриття ABBM при збільшенні синуса. Виходячи з цих результатів, мінімальний розмір вибірки був оцінений у 9 осіб у кожній групі, враховуючи можливий рівень відсіву 10% протягом періоду дослідження.
Модель змішаних ефектів була використана для дослідження різниць у змінах обсягу трансплантату між групами Bio-Oss та A-Oss з коригуванням на коваріати, де зміни обсягу трансплантату вимірювалися в три послідовні періоди часу, а також на початковому етапі (T0). Значущість ефектів коваріт та прогнозованих змін обсягу трансплантату
були перевірені при α = 0.05. Крім того, описова статистика загальної інформації про пацієнтів на початковому етапі була підсумована з кількістю випадків та відсотком для категоріальних змінних та зі середнім ± стандартним відхиленням для безперервних змінних.
Всі статистичні аналізи були проведені за допомогою SAS, версія 9.4 (SAS Inc., Кері, Північна Кароліна, США). Статистична значущість була встановлена як p < 0.05.
Результати
Усього було послідовно залучено 18 пацієнтів, і двоє пацієнтів вибули (по одному в кожній групі) через втрату спостереження. Врешті-решт, дані 16 пацієнтів (7 чоловіків і 9 жінок) зі середнім віком 54.3 ± 11.7 років (в діапазоні від 28 до 72 років) були зібрані та оцінені в цьому дослідженні (Таблиця 1). Демографічне порівняння між двома групами показано в Таблиці 2. Існувала значна різниця між групами Bio-Oss та A-Oss лише за довжиною імплантату (p < 0.01).
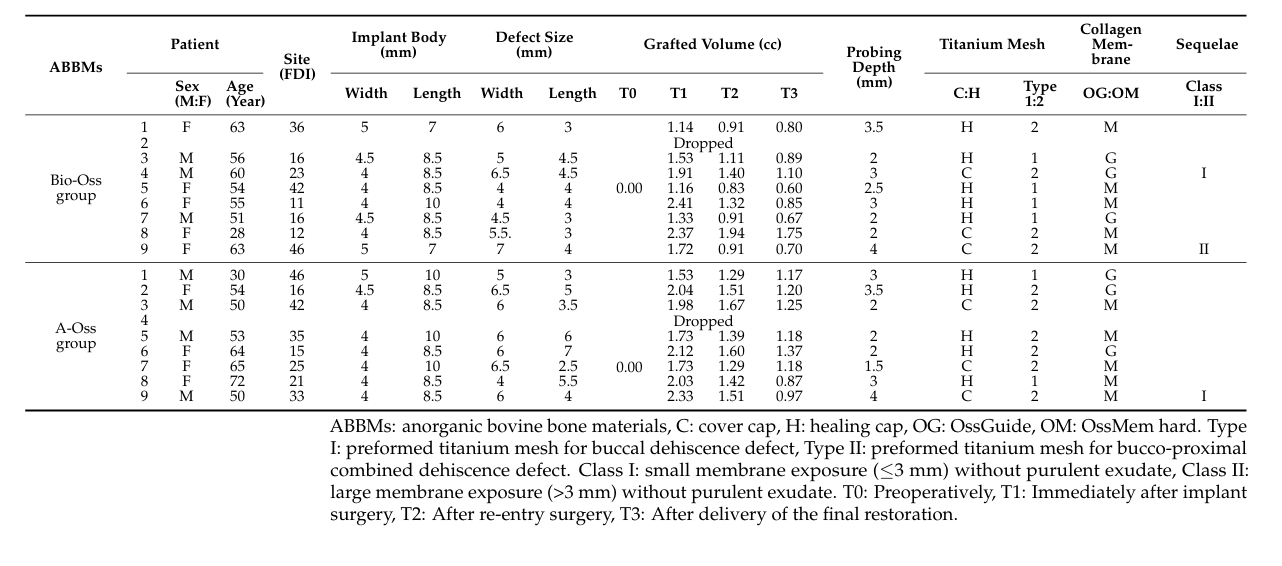
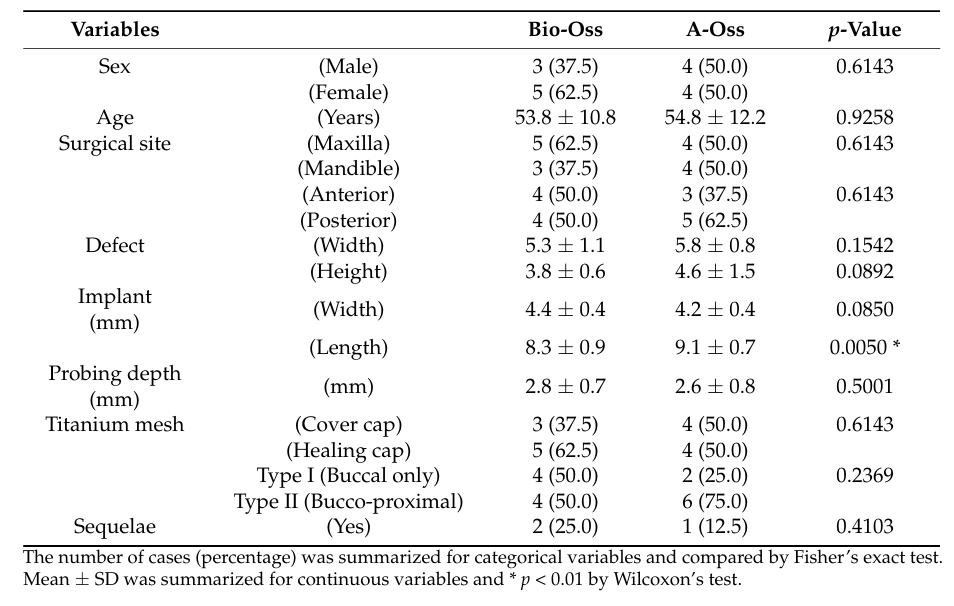
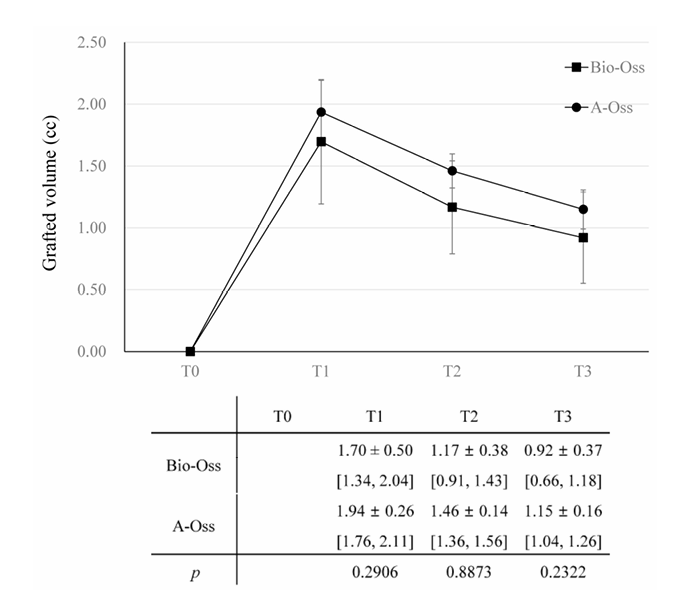
В обох групах обсяг трансплантату, який досяг піку 1.70 ± 0.50 cc у групі Bio-Oss та 1.94 ± 0.26 cc у групі A-Oss на T1, продовжував зменшуватися до T3. Обсяги трансплантату зменшилися до 1.17 ± 0.38 cc у групі Bio-Oss та 1.46 ± 0.14 cc у групі A-Oss на T2 та 0.92 ± 0.37 cc у групі Bio-Oss та 1.15 ± 0.16 cc у групі A-Oss на T3; між періодами спостереження була значна різниця в обсягах трансплантату (p < 0.001, Таблиця 3). Однак між двома групами не було значної різниці в усі періоди спостереження (p > 0.05, Рисунок 5). Крім того, не було значної різниці в щільності регенерованої кістки на T3 між групами (p > 0.05).

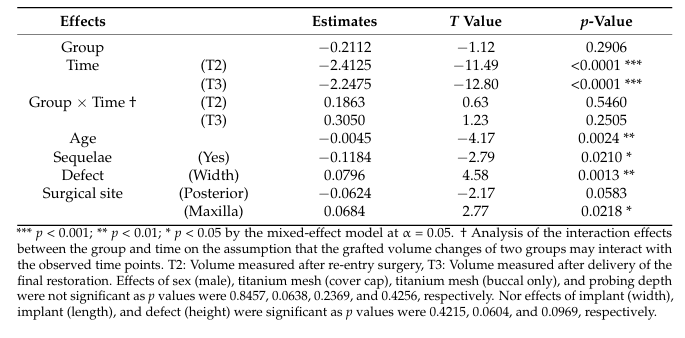
У аналізі моделі змішаних ефектів T2 і T3 як часові періоди (p < 0.001), старший вік (p < 0.01) та наявність наслідків (p < 0.05) вказували на значні зменшення в обсязі пересадки; навпаки, ширший дефект (p < 0.01) та верхня щелепа як хірургічний майданчик (p < 0.05) призводили до меншого зменшення в обсязі пересадки (Таблиця 4). Післяопераційні наслідки були відзначені у трьох пацієнтів, з яких двоє (Клас I та II на місцях швів) у групі Bio-Oss та один (Клас I на буко-мезіальному краю сітки) у групі A-Oss. Усі післяопераційні наслідки виникли у занурених випадках з кришками, і значної різниці між двома групами не було. Пацієнтам було рекомендовано обережно і м'яко чистити сітку м'якою зубною щіткою, змоченою 1% гелем хлоргексидину, двічі на день. Незважаючи на відсутність реепітелізації, що покриває відкриту ділянку сітки, передчасне видалення цих відкритих сіток не було необхідним, і повторне оголення різьблення імплантату та значна втрата матеріалу пересадки з гноєм не спостерігалися протягом усього періоду загоєння; додаткова пересадка не була необхідна на T2.
Обговорення
Це рандомізоване контрольоване дослідження було розроблено для оцінки потенціалу A-Oss у підтримці кількості та якості кістки регенерованої кістки за допомогою GBR як низькотемпературно-синтерованого ABBM у порівнянні з Bio-Oss, і нульова гіпотеза про відсутність різниці була прийнята. Незважаючи на використання об'єму-стабільних ABBM, загалом було втрачено 46,0% (0,78 ± 0,37 cc) та 40,8% (0,79 ± 0,33 cc) пересаджених об'ємів під час процесу заміщення новою кісткою в групах Bio-Oss та A-Oss відповідно. Можливе пояснення більшої резорбції, ніж очікувалося, полягає в тому, що об'єм пересадки, виміряний на T1, був чітко окреслений тонкою рентгеноконтрастною титановою сіткою на CBCT-сканах, тоді як нечітка рентгенологічна периферія між матеріалами пересадки та м'якими тканинами призвела до недооцінки об'єму пересадки після видалення титанової сітки на обох T2 та T3. У порівнянні з 17,3~23,9% втрати об'єму пересадки до 6 місяців після операції підняття синуса, зменшення об'єму пересадки після GBR вважалося більшим, оскільки загальний тиск накладених м'яких тканин може бути вищим, ніж внутрішньосинусний пневматичний тиск. Було проведено лише лінійні вимірювання для оцінки товщини збільшеної області за допомогою GBR на обмежених CBCT-сканах, і наші результати не є несподіваними, враховуючи, що лінійне зменшення коливалося від 20,2% до 42,8% на плечі імплантату після пересадки Bio-Oss. Однак ми повинні визнати, що існував постійний ризик вимірювальних помилок, спричинених металевими артефактами, оскільки різні металеві компоненти, такі як тіло імплантату та титансова сітка, існували одночасно в CBCT.
Зосереджуючись на зміні обсягу пересадки, вплив наявності наслідків і хірургічного місця показав статистично значущі відмінності (p < 0.05). Іншими словами, якщо GBR мав післяопераційні ускладнення або хірургічне місце було заднім (в порівнянні з переднім, p = 0.0583) і не верхньощелепним (в порівнянні з нижньощелепним), то ймовірність більшої резорбції обсягу пересадки була вищою. Задня область нижньої щелепи зазвичай складається з твердого кісткового матеріалу з товстою кортикальною оболонкою, і результат збільшення кістки є менш передбачуваним, навіть якщо поєднаний з великими отворами кісткового мозку. Крім того, вплив віку та ширини дефекту також показав значні відмінності (p < 0.01), що означає, що старші пацієнти та більш вузькі дефекти декомпресії, ймовірно, покажуть більшу резорбцію обсягу пересадки. Старші пацієнти, як правило, мали вищий ризик невдачі імпланта з нижчими потенціалами регенерації кістки після GBR, і було менше резорбції на місці GBR, оскільки більше матеріалів для пересадки кістки було упаковано в ширші дефекти та надійно захищено титановою сіткою, що максимізує стабільність обсягу ABBMs. Попередньо сформована ультратонка титансова сітка була підходящою для ідеального контур кістки, особливо на рівні верхівки імпланта, запобігаючи обвалу пересадки. Припускаючи, що дефект навколо імпланта розташований в межах оригінального кісткового каркасу, дефекти типу фенестрації показали більше заповнення кісткою та менше ускладнень, ніж дефекти типу декомпресії. Таким чином, ми не можемо знайти значний вплив висоти дефекту на зміну обсягу пересадки.
На відміну від ABBM для збереження об'єму, алогенні матеріали для кісткової трансплантації продемонстрували активне утворення кістки з островами нової кістки, які можуть бути інтерпретовані як свідчення індукції кістки, і, здавалося, перебували в більш активному стані обміну та заміни. Техніка нашарування з використанням різних матеріалів для трансплантації зазвичай застосовується для збільшення дегісцированої або недостатньої альвеолярної кістки навколо зубних імплантатів. Загалом, аутогенна кістка використовувалася як внутрішній шар у безпосередньому контакті з імплантатом; однак алогенна кістка також використовувалася, коли об'єм забору аутогенної кістки був недостатнім. У цьому дослідженні зовнішній шар ABBM був розміщений на алотрансплантаті для збереження та підтримки збільшеної кістки, а третій шар абсорбційної колагенової мембрани був розміщений для запобігання вторгненню м'яких тканин та неостеогенних клітин у трансплантовану ділянку. З огляду на вимогу бар'єрної мембрани, титанову сітку використовували для створення простору та стабілізації згустків крові, а накладена абсорбційна колагенова мембрана використовувалася для клітинної оклюзії, щоб запобігти передчасному витончення накладеної ясеневої тканини, повністю розділяючи відсіки для кісткової та епітеліальної регенерації. Як неабсорбційна бар'єрна мембрана, видалення титанової сітки є неминучим; однак повторна операція для її видалення є відмінною можливістю оцінити кількість і якість регенерованої кістки для визначення успіху GBR. Зазвичай, хоча кількість кістки можна оцінити радіологічно за допомогою 3D-реконструкції CBCT-сканів на ділянці GBR, якість кістки оцінювалася гістологічно або гістоморфометрично шляхом отримання та аналізу біопсії кісткового кору з регенерованого гребеня. Проте в нашому дослідженні якість кістки була грубо оцінена шляхом оцінки кортикалізації ділянки GBR за допомогою глибини зондування під час повторного входу, оскільки технічно було важко або часто неможливо отримати зразок кістки з реконструйованої пері-імплантантної ділянки. Після видалення титанової сітки більш детальний огляд загоєної ділянки виявив регенеровану тверду тканину, поверхнево покриту тонким шаром м'якої тканини товщиною 1–2 мм. Цей шар був описаний як "псевдоперіост" і клінічне значення цього гістологічно сполучного та грануляційного шару тканини невідоме; однак цей тонкий шар, здається, стабільний за розміром, і його видалення не було показано під час повторного входу. У нашому дослідженні глибини зондування 2.8 ± 0.7 мм та 2.6 ± 0.8 мм у групах Bio-Oss та A-Oss відповідно, можуть бути товщиною незрілої кістки, включаючи "псевдоперіост", під час процесу кортикалізації під титановою сіткою. Цей підхід до оцінки якості регенерованої кістки вважається основним обмеженням нашого дослідження, і подальше гістологічне та гістоморфометричне дослідження буде необхідним для детального аналізу регенерованої кістки.
Хоча повторна епітелізація не відбулася при малих (2 пацієнти) та великих (1 пацієнт) експозиціях титанової сітки без гнійного ексудату під час періоду загоєння, витоку матеріалу для пересадки не спостерігалося, і не було вказівок на передчасне видалення відкритої титанової сітки та додаткову пересадку. Однак глибина зондування збільшилася до 3~4 мм через компенсаторну присутність товстого "псевдоперіосту", який брав участь у надійному утриманні матеріалу для пересадки в випадках відкритої титанової сітки. Попереднє дослідження також підтвердило, що експозиція титанової сітки не мала негативного впливу на клінічний результат процедури збільшення та успіх процедури пересадки кістки. Особливо, всі післяопераційні наслідки виникли в випадках, коли титанову сітку фіксували та стабілізували кришками, хоча це не було статистично значущим. Оскільки кришки були з'єднані з імплантатом з низькою первинною стабільністю в нашому дослідженні, більше напруження, що виникло через меншу надмірність м'яких тканин, могло бути пов'язане з вищою частотою післяопераційної розкритості рани в зануреному підході в порівнянні з незануреним підходом. Не було значної різниці в післяопераційних наслідках між групами Bio-Oss та A-Oss.
Висновки
В межах обмежень цього дослідження можна зробити висновок, що
- Дефект дегісценції навколо імплантату був успішно реконструйований за допомогою GBR з подвійним шаром аллографту та ABBM, які були покриті попередньо сформованою ультратонкою титановою сіткою та абсорбованою колагеновою мембраною;
- Незважаючи на ефект підтримки обсягу ABBM, приблизно 27,8% резорбції обсягу трансплантату було відзначено на T2, і не було значної різниці між групами Bio-Oss та A-Oss, навіть у якості регенерованої кістки;
- Втрата обсягу трансплантату (приблизно 43,2%) продовжувалася до T3 і не відрізнялася між групами Bio-Oss та A-Oss.
ДжеХьонг Лім, СангХо Чун, Марко Талларіко, Чун-Бом Пак, Де-Хо Пак, Кьонг-Гюн Хванг та Чанг-Чжу Пак
Список літератури
- П'єтурссон, Б.Е.; Тома, Д.; Юнг, Р.; Цваhlen, М.; Зембік, А. Систематичний огляд виживаності та частоти ускладнень фіксованих зубних протезів на імплантатах (FDP s) після середнього періоду спостереження не менше 5 років. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
- Урбан, І.; Капланіс, Н.; Лозада, Дж.Л. Одночасна вертикальна керована регенерація кістки та керована регенерація тканин у задній частині верхньої щелепи з використанням рекомбінантного людського фактора росту, отриманого з тромбоцитів: Клінічний випадок. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
- Адеємо, В.; Рейтхер, Т.; Блох, В.; Коркмаз, Й.; Фішер, Дж.Х.; Золлер, Дж.Е.; Кюблер, А.Ц. Заживлення кісткових трансплантатів на онлай-мандибулярних кістках, покритих колагеновою мембраною або замінниками кістки з великої рогатої худоби: Мікроскопічне та імуногістохімічне дослідження на вівцях. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
- Блок, М.С.; Калім, А. Використання синтерованого ксенографту над аллографтом для збільшення гребеня: Технічна записка. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
- Бузер, Д.; Шапюї, В.; Кухлер, У.; Борнштейн, М.; Віттнебен, Дж.; Бузер, Р.; Кавусоглу, Й.; Бельсер, У.Ц. Довгострокова стабільність раннього імплантаційного розміщення з контурним збільшенням. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
- Йенсен, С.С.; Боссгардт, Д.Д.; Грубер, Р.; Бузер, Д. Довгострокова стабільність контурного збільшення в естетичній зоні: Гістологічна та гістоморфометрична оцінка 12 людських біопсій через 14-80 місяців після збільшення. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
- Чо, Й.С.; Хванг, К.Г.; Чун, С.Х.; Талларіко, М.; Квон, А.М.; Пак, Ч.Й. Радіологічний порівняльний аналіз між заповненням фізіологічним розчином та фібрином, збагаченим тромбоцитами, після гідравлічного транс-крестального підняття синуса без додаткового кісткового трансплантату: Рандомізоване контрольоване дослідження. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
- Невінс, М.; Невінс, М.Л.; Кім, С.-В.; Шупбах, П.; Кім, Д.М. Використання колагенової матриці мукографту для збільшення зони кератинізованої тканини навколо зубів: Пілотне дослідження. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
- Лі, Дж.С.; Шин, Х.К.; Юн, Дж.Х.; Чо, К.С. Рандомізоване клінічне дослідження трансплантації верхньощелепного синуса з використанням депротенізованого свинячого та великорослого кісткового мінералу. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
- Сусін, К.; Лі, Дж.; Фіоріні, Т.; Ку, К.Т.; Шюпбах, П.; Ангст, П.Д.; Фінгер Стадлер, А.; Вайкешйо, У.М. Скринінг кандидатів на біоматеріали для альвеолярного збільшення з використанням моделі критичного розміру дефекту черепа щура. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
- Амара, Х.Б.; Лі, Дж.-В.; Кім, Дж.-Д.; Кан, Й.-М.; Кан, Е.-Дж.; Ку, К.-Т. Вплив rhBMP-2 на керовану регенерацію кістки для розміщення та функціонального навантаження зубних імплантатів: Радіографічне та гістологічне дослідження на собаках. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
- Чо, Дж.С.; Кім, Х.С.; Ум, С.Х.; Рі, С.Х. Підготовка нового неорганічного ксенографту з великої рогатої худоби з підвищеною біоактивністю та остеокондуктивністю. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
- Хер, С.; Кан, Т.; Фієн, М.Дж. Титанові сітки як альтернатива мембрані для збільшення гребеня. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
- Луїс, П.Ж.; Гутта, Р.; Сайд-Ал-Наїф, Н.; Бартолуччі, А.А. Реконструкція верхньої та нижньої щелепи з частинковим кістковим трансплантатом та титановою сіткою для розміщення імплантатів. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
- Рахматія, Й.Д.; Аюкава, Й.; Фурухаші, А.; Кояно, К. Сучасні бар'єрні мембрани: Титанові сітки та інші мембрани для керованої регенерації кістки в стоматологічних застосуваннях. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
- Юнг, Г.-У.; Чон, Дж.-Й.; Хванг, К.-Г.; Пак, Ч.-Дж. Попередня оцінка тривимірної, індивідуальної та попередньо сформованої титанової сітки в регенерації альвеолярної кістки навколо імплантату. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
- Лі, С.-Х.; Мун, Дж.-Х.; Чонг, Ч.-М.; Бе, Е.-Б.; Пак, Ч.-Е.; Чон, Г.-Р.; Лі, Дж.-Дж.; Чон, Й.-С.; Ху, Дж.-Б. Механічні властивості та біометричний ефект 3D попередньо сформованої титанової мембрани для керованої регенерації кістки на дефекті альвеолярної кістки. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
- Талларіко, М.; Черузо, Ф.М.; Муззі, Л.; Мелоні, С.М.; Кім, Й.-Дж.; Гаргарі, М.; Мартіноллі, М. Вплив одночасного імплантаційного розміщення та керованої кісткової реконструкції з ультратонкими титановими мембранами на радіографічні та клінічні параметри через 18 місяців навантаження. Materials 2019, 12, 1710. [CrossRef] [PubMed]
- Фонтана, Ф.; Машера, Е.; Рокк'єтта, І.; Сіміон, М. Клінічна класифікація ускладнень у процедурах керованої регенерації кістки за допомогою не розсмоктувальної мембрани. Int. J. Periodontics Restor. Dent. 2011, 31, 265.
- Ліянедж, Л.; Лі, Н.Ж.; Кук, Т.; Херрманн, Х.Ц.; Джаґасія, Д.; Літт, Х.; Хан, Й. Вплив статі на кальцифікацію серцево-судинної системи у дуже літніх пацієнтів з важким аортальним стенозом. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
- Лодевік, Т.М.; Арнольдуссен, К.В.; Лахай, М.Й.; ван Мірло, К.М.; Нойман, У.П.; Бітс-Тан, Р.Г.; Дейонг, К.Х.; ван Дам, Р.М. Швидка та точна вольометрія печінки перед гепатектомією. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
- Панг, К.-М.; Лі, Дж.-К.; Чхой, С.-Х.; Кім, Й.-К.; Кім, Б.-Дж.; Лі, Дж.-Х. Збільшення верхньощелепного синуса з використанням двошарового анорганічного кісткового матеріалу, покритого кальцієм: Порівняльне багатопрофільне рандомізоване клінічне дослідження з гістологічною та радіографічною оцінкою. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
- Мір-Марі, Дж.; Вуй, Х.; Юнг, Р.Е.; Хаммерле, Ч.Х.; Бенік, Г.І. Вплив закриття рани на стабільність обсягу різних матеріалів GBR: Внутрішньоінститутське дослідження з використанням конусно-променевої комп'ютерної томографії. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed]
- Охе, Дж.Й.; Кім, Г.Т.; Лі, Дж.В.; Аль Навас, Б.; Юнг, Дж.; Квон, Й.Д. Стабільність обсягу гідроксиапатиту та β-трикальційфосфатного біфазного кісткового матеріалу в підвищенні підлоги верхньощелепного синуса: Радіографічне дослідження з використанням 3D конусно-променевої комп'ютерної томографії. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
- Мір-Марі, Дж.; Бенік, Г.І.; Вальмасседа-Кастельйон, Е.; Хаммерле, Ч.Х.; Юнг, Р.Е. Вплив закриття рани на стабільність обсягу часткових та непарних матеріалів GBR: Внутрішньоінститутське дослідження з використанням конусно-променевої комп'ютерної томографії. Частина II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
- Еспозіто, М.; Магхайре, Х.; Грусувін, М.Г.; Зіоунес, І.; Уортінгтон, Х.В. Управління м'якими тканинами для зубних імплантатів: Які найбільш ефективні техніки? Систематичний огляд Корану. Eur. J. Oral. Implant. 2012, 5, 221–238.
- Ємт, Т. Невдачі імплантатів та вік на момент операції: Ретроспективне дослідження імплантації у 2915 частково беззубих щелепах. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
- Йенсен, С.С.; Тергейден, Х. Процедури збільшення кістки в локалізованих дефектах альвеолярного гребеня: Клінічні результати з різними кістковими трансплантатами та матеріалами заміни кістки. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
- Шейер, Е.Т.; Херд, Р.; Янакієвскі, Дж.; Манделаріс, Г.; Невінс, М.Л.; Пікерінг, С.Р.; Річардсон, Ч.Р.; Поуп, Б.; Тобак, Г.; Веласкес, Д.; та ін. Рандомізоване, контрольоване, багатопрофільне клінічне дослідження збереження альвеолярного гребеня після видалення зуба. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
- Ван, Х.-Л.; Міш, К.; Нейва, Р.Ф. Техніка збільшення кістки "сендвіч": Обґрунтування та звіт про пілотні випадки. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
- Сарначіаро, Г.О.; Чу, С.Й.; Сарначіаро, Е.; Готта, С.Л.; Тарнов, Д.П. Негайне розміщення імплантатів у лунках видалення з дефектами дегісценції лабіальної пластини: Серія клінічних випадків. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
- Мелоні, С.М.; Йованович, С.А.; Урбан, І.; Бальдоні, Е.; Пізано, М.; Талларіко, М. Горизонтальне збільшення гребеня з використанням GBR з природною колагеновою мембраною та співвідношенням 1:1 часткового ксенографту та аутохтонної кістки: Перспективне клінічне дослідження через 3 роки після остаточного навантаження. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
- Кучі, А.; Сарторі, М.; Парріллі, А.; Альдіні, Н.Н.; Вігнуделлі, Е.; Корінальдесі, Г. Гістологічний та гістоморфометричний аналіз кісткової тканини після керованої регенерації кістки з використанням нерозсмоктувальних мембран порівняно з розсмоктувальними мембранами та титановою сіткою. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
- Пруссаєфс, П.; Лозада, Дж. Використання титанової сітки для поетапного локалізованого збільшення альвеолярного гребеня: Клінічна та гістологічно-гістоморфометрична оцінка. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
- Сарнакі, К.; Шейгніц, Е.; Мьоргель, М.; Вальтер, Ч.; Аль-Навас, Б.; Вагнер, В. Клінічний результат збільшення альвеолярного гребеня з використанням індивідуалізованої титанової сітки, виготовленої за допомогою CAD-CAM. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
