Покриття піскоструйної та кислотно-етованої поверхні імплантату з агентом, що буферизує pH, після вакуумної УФ-фотофункціоналізації
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Ультрафіолетова (УФ) фотофункціоналізація може скинути біологічне старіння титану після підготовки та зберігання стоматологічних імплантатів, перетворюючи гідрофобні титанові поверхні на супергідрофільні. Формування тромбу навколо імплантату може ініціювати та сприяти процесу загоєння на межі кістка-імплантат. Метою цього дослідження є оцінка та порівняння можливостей зволожуваності поверхні та згортання крові імплантатів з традиційною поверхнею, обробленою піском та кислотним травленням (SA), поверхнею, обробленою піском та кислотним травленням з вакуумним УФ-обробленням (SA + VUV), та поверхнею, обробленою піском та кислотним травленням, покритою буфером pH після вакуумного УФ-оброблення (SA + VUV + BS). Статичні та динамічні тести на зволожуваність поверхні та згортання крові були проведені in vitro для SA + VUV та SA + VUV + BS (n = 5), тоді як гемостаз, що виникає внаслідок згортання крові, оцінювався in vivo для SA, SA + VUV та SA + VUV + BS (n = 4). Тест Крускала-Уолліса показав статистично значущі відмінності (p < 0.05) у всіх тестах, за винятком in vitro тесту статичного згортання крові. Отже, обробка VUV є ефективною для перетворення поверхні SA на супергідрофільну як альтернатива рутинному УФ-C випромінюванню. Додавання буфера pH до SA + VUV також покращило зволожуваність поверхні та згортання крові, що є критично важливими для успішної остеоінтеграції.
Вступ
Титан широко використовується для стоматологічної та ортопедичної реставрації та реконструкції завдяки своїй біосумісності, стійкості до корозії та механічним властивостям. Титан легко окислюється, утворюючи тонкий (1–5 нм), стабільний і пасивний шар, який є саморегульованим і захищає поверхню металу від подальшого окислення. Цей шар діоксиду титану (TiO2) вважається відповідальним за його ефективну біологічну активність завдяки переносу іонів кальцію та фосфору з кісткової матриці в межах шару TiO2. Однак з часом відбуваються значні зменшення остеоінтеграції та інших біологічних можливостей титану, оскільки збільшується вміст вуглецю на поверхні через неминуче осадження вуглецю з атмосфери на шарі TiO2 у формі вуглеводнів. Це явище визначається як біологічне старіння титану, і здатність поверхонь титану притягувати білки та остеогенні клітини зменшується залежно від часу. Іншою помітною зміною на поверхнях титану з часом є зникнення гідрофільності. Відразу після обробки поверхні титану демонструють кут контакту води 0 або менше 5 градусів, і такі поверхні називаються супергідрофільними. Ця характеристика поступово зменшується і стає гідрофобною через 2 та 4 тижні, з кутом контакту більше 40 та 60 градусів відповідно.
Обробка поверхні використовується для модифікації топографії та енергії поверхні зубного імплантату, що призводить до покращення змочуваності, збільшення проліферації та росту клітин, а також прискорення остеоінтеграції. Обробка поверхні може бути досягнута за допомогою адитивної або субтрактивної техніки. Субтрактивна техніка або видаляє, або шорстить шар основного матеріалу, як це показано на поверхні, обробленій піскоструминним методом та кислотним травленням (SA). У адитивній техніці інші матеріали або хімічні агенти додаються поверхнево до поверхні титану через покриття, такі як розпилення титанової плазми, покриття гідроксиапатитом, покриття кальцій фосфатом та інші біоміметичні покриття. Свердління перед установкою імплантату викликає травму кісткової тканини, подібну до перелому. Місце стає відносно гіпоксичним, а екстраклітинний pH стає кислотним. У таких умовах стромальні клітини кісткового мозку демонструють знижену активність лужної фосфатази (ALP) та синтез колагену, обидва з яких є важливими для формування кістки та остеоінтеграції. Гліколіз та синтез ДНК остеобластів також виявляється під впливом кислотних умов. Агрегація тромбоцитів, яка є критичним етапом у формуванні згустку крові або тромбоутворенні, також зменшується через екстраклітинний ацидоз, що опосередковується шляхом входу іонів кальцію. Формування достатнього згустку крові забезпечує прямий і стабільний зв'язок на межі кістка-імплантат і відіграє важливу роль у тромбоутворювальних реакціях та остеоінтеграції. Більше того, було виявлено зв'язок між різними поверхнями імплантатів та ступенем згустку фібрину.
У нашому попередньому дослідженні було представлено нову поверхню SA, покриту буфером pH після обробки вакуумним УФ (VUV). Ця поверхня була тісно пов'язана з більшою афінністю до білків, клітин і тромбоцитів, що сприяло швидкому та стабільному згортанню крові, тромбоутворенню та остеоінтеграції. Метою даного дослідження було оцінити та порівняти змочуваність поверхні та здатність до згортання крові різних імплантаційних поверхонь, включаючи звичайну поверхню SA (SA), поверхню SA з обробкою VUV (SA + VUV) та поверхню SA, покриту буфером pH після обробки VUV (SA + VUV + BS), за допомогою in vitro та in vivo аналізів.
Матеріали та методи
2.1. Підготовка імплантаційних фіксаторів
Імплантаційні фіксатори з комерційно чистого титану (група IV) були підготовлені як SA, SA + VUV (TS III SA, Osstem, Сеул, Корея) та SA + VUV + BS (TS III SOI, Osstem) для використання в цьому дослідженні. Як показано на малюнку 1a,b, шорсткість поверхні імплантаційних фіксаторів була виміряна на 2.5 ± 0.5 мкм значення Ra, а обробка VUV для фотофункціоналізації була досягнута шляхом експонування імплантаційного фіксатора до ламп низького тиску з ртутним дуговим розрядом, що випромінюють UV-C та VUV в УФ-озоновому очищувачі протягом 1 години. Покриття поверхні імпланта з буфером pH, що складається як з позитивно, так і з негативно заряджених іонних груп, з pKa значенням 7.31 при 37°C, було доповнене для кращої супергідрофільності (малюнок 1c).
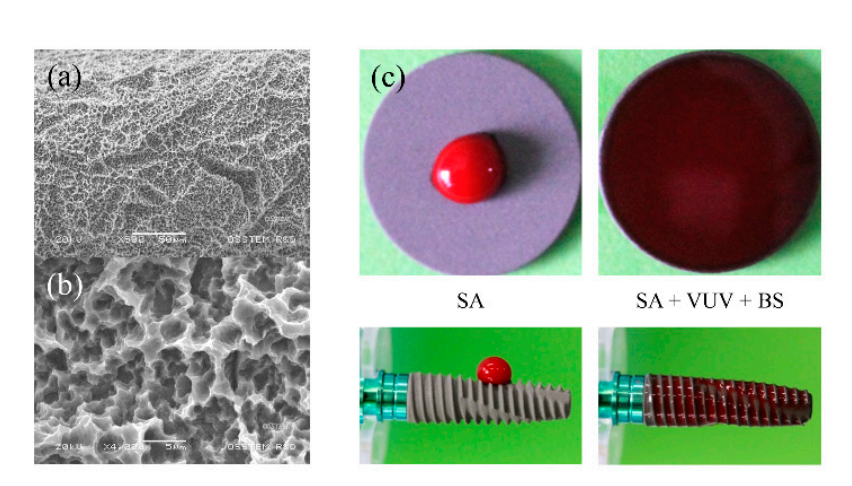
2.2. Вітро Тести
2.2.1. Статична Вологість Поверхні
Гепаринізована овеча кров була налита в посудину діаметром 3,5 см на глибину 2-3 см. Імплантаційні фіксатори SA + VUV та SA + VUV + BS (n = 5, відповідно) були занурені в кров до верхньої межі апікальних різьблень, і час, необхідний для досягнення верхньої частини імплантаційного фіксатора, був зафіксований для розрахунку швидкості зволоження. Час не враховувався від апексу імплантаційного фіксатора, оскільки наявність перерви в апікальних різьбах призвела до раптової зупинки поглинання крові.
2.2.2. Динамічна Вологість Поверхні
Щоб змоделювати клінічні ситуації встановлення імплантаційних фіксаторів, у прозорій акриловій пластині були зроблені отвори для забезпечення видимості, відповідно до протоколу свердління виробника для щільності твердих кісток, використовуючи набір 122 Taper Kit (Osstem). У кожен отвір акрилової пластини було поміщено 130 мкМ зразок дефібринованої овечої крові, а імплантаційні фіксатори SA + VUV та SA + VUV + BS (n = 5, відповідно) були занурені в отвір за допомогою вимірювача зусилля (MX-500N, Imada Co., Токіо, Японія) зі швидкістю 50 мм/хв, і часи, коли кров досягала 2 мм та 4 мм точок центральної осі фіксатора над горизонтальною пластиною, відповідно, були зафіксовані (Рисунок 2).

2.2.3. Статичне згортання крові
Імплантаційні фіксатори SA + VUV та SA + VUV + BS, довжиною 11,5 мм та діаметром 4,5 мм (n = 5 відповідно), були занурені до своїх кінців у посудину діаметром 3,5 см, заповнену 3 мл негіпаринізованої овечої крові. Вага (г) кров'яного згустку навколо імплантаційного фіксатора вимірювалася через 5 хв, 7,5 хв, 10 хв та 12,5 хв відповідно.
2.2.4. Динамічне згортання крові
Ця модель активного згортання крові була розроблена для імітації безперервного постачання крові капілярами. Імплантаційні фіксатори SA + VUV та SA + VUV + BS, які мали довжину 10 мм та діаметр 4,0 мм (n = 5), були вставлені з попередньо встановленим моментом вставки 5 N cm у модифіковану трубку Еппендорфа, яка була підключена до шприцевого насоса, що вводив овечу кров, змішану з 1 IU/mL гепарину, на дні при 37°C. Після 30 хвилин постачання крові з швидкістю інфузії 0,05 мл/хв, було виміряно час (хв), поки кров не перестала капати через утворення згустку крові навколо імплантаційного фіксатора, та об'єм (мл) крові, який був зібраний у нижній трубці об'ємом 15 мл під трубкою Еппендорфа.
2.3. Випробування in Vivo
Було використано модель щелепи собаки бігля. Усі процедури проводилися з дозволу Етичного комітету експериментів на тваринах Інституційного комітету з догляду та використання тварин (CRONEX-IACUC 20191002; Cronex, Хвасунг, Корея) відповідно до рекомендацій Дослідження тварин: Звітність про експерименти in Vivo (ARRIVE).
Чотири самки біглів віком 18 місяців піддалися двосторонньому видаленню їхніх нижніх премолярів та першого моляра під загальною анестезією. Анестезіологічний протокол для всіх хірургічних процедур включав 1 мл внутрішньом'язової ін'єкції з дозою 15 мг/кг тилетаміну/золазепаму (Zoletil 50, Virbac, Сеул, Корея) та 5 мг/кг ксилазину (Rompun, Bayer Korea, Сеул, Корея). Після місцевої анестезії був піднятий повнотовстий мукоперіостальний клапоть поряд з нижніми премолярами та молярами (Рисунок 3). Зуби були розділені навпіл під рясним зрошенням з використанням маленького фісурного бору. Видалення проводилося з використанням ліфтів та щипців. Клапті були зашиті одиничними переривчастими швами. Протокол післяопераційного догляду включав антибіотики та контроль болю. Протягом цього періоду всі собаки отримували м'яку їжу та воду без обмежень.
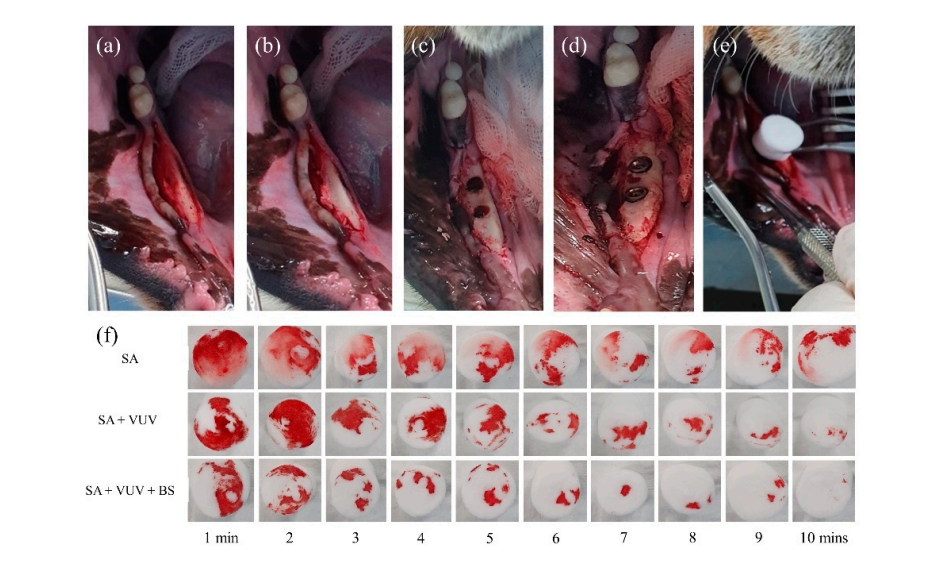
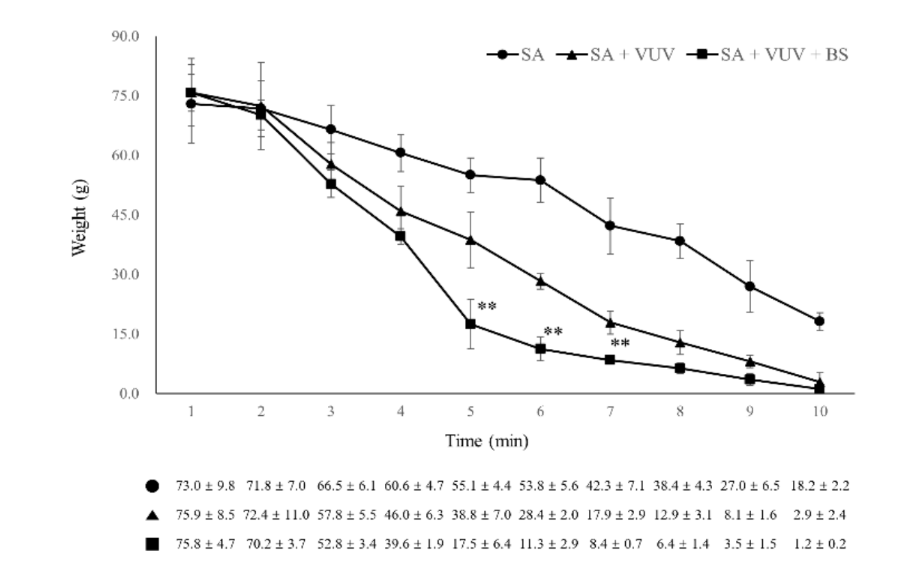
Три місяці після видалення зубів було проведено хірургічне встановлення зубних імплантів у загоєних місцях видалення в стерильних умовах. Після місцевої анестезії був піднятий повнотовстий клапоть, щоб оголити альвеолярний гребінь, і нерівний альвеолярний гребінь був вирівняний. Послідовні свердління були виконані для наступних місць імплантації, які були більшими за імплантаційний елемент, з використанням направляючого свердла, 2.2 мм спірального свердла, 3.0 мм конусного свердла, 4.0 мм конусного свердла та 6.0 мм ультра-конусного свердла. Всього було встановлено 12 імплантаційних елементів SA, SA + VUV та SA + VUV + BS, довжиною 8.5 мм з діаметром 3.5 мм, які були встановлені з обох боків з попередньо встановленим моментом вставки 35 Н см. Уся кров, що витікала з проміжку між отвором та імплантаційним елементом, була вбрана в ватний кульок до 10 хвилин після встановлення імпланта, і вага (г) ватного кулька вимірювалася щохвилини, щоб оцінити потенціал згортання крові імплантаційних елементів. Усі експериментальні тварини були принесені в жертву після операції шляхом внутрішньовенного передозування хлориду калію.
2.4. Статистичний аналіз
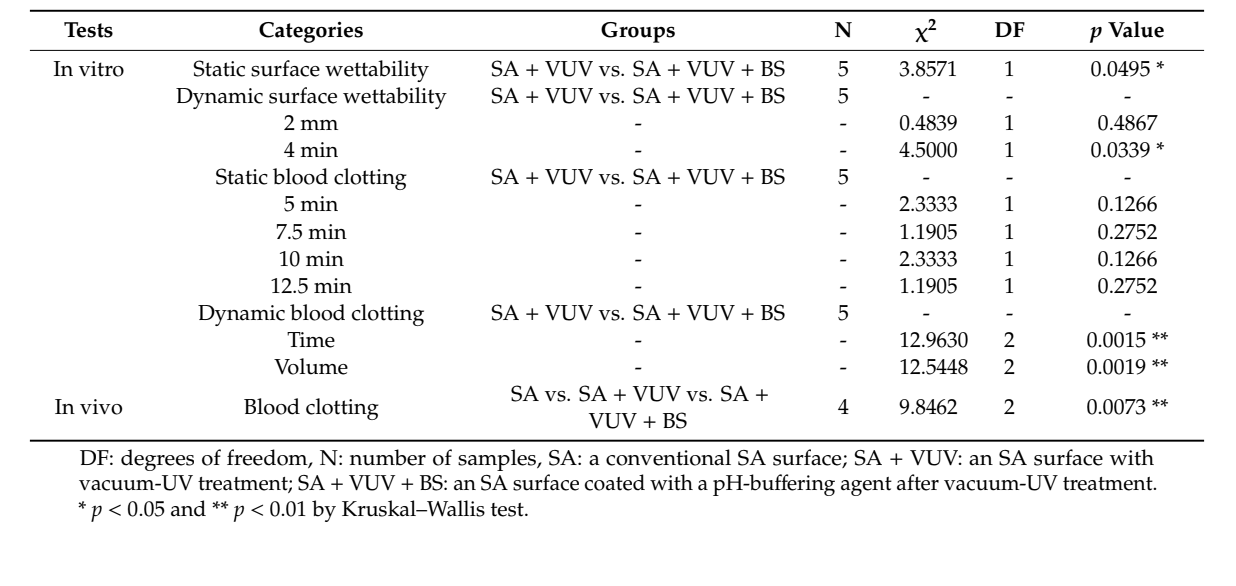
Через малий розмір вибірки ми провели тест Крускала–Уолліса, який є непараметричним порівнянням різниці середніх без припущення нормальності, щоб дослідити різниці між SA + VUV та S + VUV + BS in vitro та серед SA, SA + VUV і SA + VUV + BS in vivo, з статистичною значущістю p < 0.05 при α = 0.05. Усі статистичні аналізи були виконані за допомогою SAS, версія 9.4 (SAS Inc., Кері, Північна Кароліна, США).
Результати
3.1. In Vitro Тести
3.1.1. Статична змочуваність поверхні
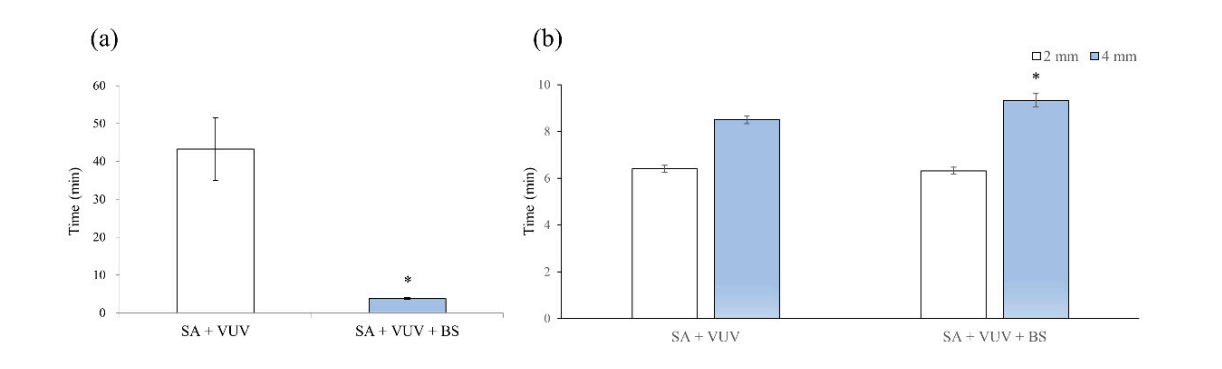
Час, протягом якого кров досягала верхньої частини імплантаційного фіксатора, становив 43.3 ± 8.3 хв та 3.8 ± 0.3 хв для SA + VUV та SA + VUV + BS відповідно, і статистично значуща різниця (p < 0.05) між ними була очевидною (Рисунок 4a).
3.1.2. Динамічна змочуваність поверхні
Час, протягом якого кров досягала 2 мм над горизонтальною пластиною, становив 6.4 ± 0.1 хв та 6.3 ± 0.2 хв, а для 4 мм над горизонтальною пластиною – 8.5 ± 0.2 хв та 9.3 ± 0.3 хв для SA + VUV та SA + VUV + BS відповідно. Статистично значуща різниця (p < 0.05) між SA + VUV та SA + VUV + BS була виявлена лише для часу, коли кров досягала 4 мм над горизонтальною пластиною (Рисунок 4b).
3.1.3. Статичне згортання крові
У SA + VUV вага згустку крові, що утворився навколо імпланта, яка вимірювалася через 5 хв, 7.5 хв, 10 хв і 12.5 хв після занурення імпланта в кров, становила 0.04 ± 0.01 г, 0.09 ± 0.03 г, 0.23 ± 0.06 г і 0.39 ± 0.16 г відповідно. У SA + VUV + BS вага становила 0.07 ± 0.03 г, 0.12 ± 0.02 г, 0.39 ± 0.20 г і 0.61 ± 0.18 г відповідно, і не було статистично значущих відмінностей між SA + VUV та SA + VUV + BS в будь-який момент часу (p > 0.05).
3.1.4. Динамічне згортання крові
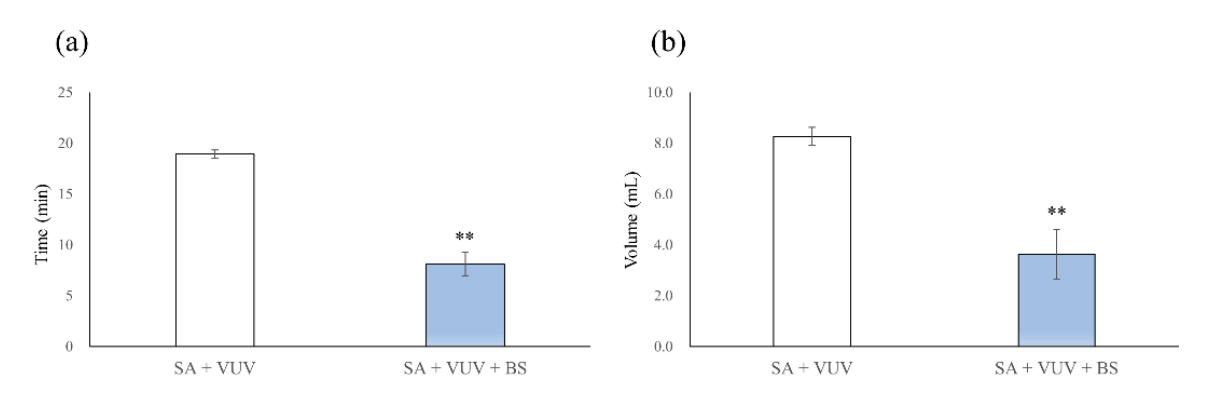
Час для досягнення повної гемостазу становив 19.0 ± 0.4 хв і 8.1 ± 1.2 хв у SA + VUV та SA + VUV + BS відповідно, і була статистично значуща різниця між SA + VUV та SA + VUV + BS (p < 0.01, Рисунок 5a). Крім того, обсяги крові, зібраної в нижньому трубці, становили 8.27 ± 0.36 мл і 3.64 ± 0.99 мл у SA + VUV та SA + VUV + BS відповідно, з очевидною статистично значущою різницею (p < 0.01, Рисунок 5b) між SA + VUV та SA + VUV + BS.
3.2. In Vivo Тест
Серед SA, SA + VUV та SA + VUV + BS були статистично значущі відмінності в вагах цільної крові, поглинутої в бавовняному гранулі, виміряній через 5 хв, 6 хв та 7 хв (p < 0.01, Рисунок 6). Узагальнені статистичні дані цього дослідження наведені в Таблиці 1.
Обговорення
UV фотофункціоналізація, метод модифікації титанових поверхонь після UV обробки, що включає зміну фізико-хімічних властивостей та підвищення біосумісності, була запропонована для скидання біологічного старіння титану. Після обробки ультрафіолетовим випромінюванням, шар TiO2 титанової поверхні, що містить вуглеводні, став помітно гідрофільним або супергідрофільним. Відомо, що кількість вуглецю на поверхні змінюється в залежності від віку поверхні і, за повідомленнями, може збільшуватися до приблизно 60% до 70% атомних компонентів поверхні. UV обробка очищає такі забруднені вуглецем титанові поверхні, зменшуючи відсоток вуглецю до менше 20% і одночасно підвищуючи рівень остеоінтеграції. У спектрі UV як UV-A, так і UV-C перетворюють біологічно старі титанові поверхні з гідрофобних на супергідрофільні, але тільки UV-C (200–280 нм) відомий своєю ефективністю у зменшенні вуглецю на поверхні до рівня, еквівалентного новій поверхні, та підвищенні біоактивності. UV-C здатний видаляти вуглеводні з шару TiO2 титану шляхом прямого фотодекомпозиції, що є більш ефективним, ніж фотокаталіз UV-A. У нашому дослідженні всі імплантаційні фіксатори були фотофункціоналізовані UV-C та VUV (100–200 нм), а радикальне видалення вуглеводнів з шару TiO2 титану могло забезпечити більшу супергідрофільність. VUV швидко поглинається водою в атмосфері і, отже, здатний генерувати різні реактивні види кисню, розриваючи водневі зв'язки у молекулах води через гідроліз. Гідроліз, ініційований VUV, є ефективним методом отримання гідроксидних або гідроксильних груп на шарі TiO2, що забезпечує стійку супергідрофільність. Оскільки обробка VUV має тенденцію генерувати більше озону в атмосфері та гідроксильних радикалів у воді, її слід суворо обмежити лише в лабораторних або заводських умовах, а не в клінічних.
Щоб прискорити загоєння кістки та покращити анкерування кістки до імплантату, інтерфейс кістка/імплантат можна покращити топографічно та біохімічно, включаючи неорганічні фази, такі як фосфат кальцію, та органічні молекули, такі як білки, ферменти або пептиди, на або в шарі TiO2. Наноструктуровані поверхні імплантатів, які мають велику площу поверхні, високу вільну енергію поверхні та зволожуваність, здається, здатні модифікувати відповідь тканини господаря. Поверхні SA імплантатів продемонстрували передбачувані клінічні результати і вважаються стандартною поверхнею імплантату. Супергідрофільність SA + VUV + BS, яка раніше була виявлена на плоскій поверхні дисків, була підтверджена в нашому тесті статичної зволожуваності поверхні. Оскільки здатність притягувати кров до верхньої частини імплантату (приблизно 4 мм над горизонтальною пластиною в нашому дослідженні) є тим, що більшість клініцистів в кінцевому підсумку віддають перевагу перевіряти в клінічних умовах, ми додали новий динамічний тест зволожуваності поверхні, щоб детальніше порівняти швидкості зволоження SA + VUV та SA + VUV + BS. Оскільки SA є сухою поверхнею, яка не контактувала з жодною рідиною, зволожуваність поверхні SA + VUV + BS може бути значно вищою, ніж у SA лише через ефект буферного агента pH SA + VUV + BS. Однак, враховуючи, що імплантати встановлюються з сухими поверхнями або без додаткової гідратації в реальних клінічних ситуаціях, ми вибрали наївний SA, а не SA, гідратований у розчині, як контроль. Раніше було виявлено, що більш гідрофільна поверхня тісно пов'язана з кращою та швидшою остеоінтеграцією. Крім того, відомо, що зволожуваність поверхні змінює біологічні реакції поверхонь імплантатів щодо адгезії білків та інших молекул, а також взаємодії клітин.
Оскільки утворення тромбу сигналізує про початок процесу загоєння, взаємодія між імплантатом і кров'ю вважається важливою для успішної остеоінтеграції титанових імплантатів після імплантації. Утворення тромбу на шорстких титанових поверхнях може індукувати рекрутмент клітин і стимулювати загоєння ран, і було виявлено, що як преостеобласти, так і остеобласти можуть прикріплюватися до поверхні імплантату, покритої тромбоцитами та фібрином, де вони диференціюються під впливом остеогенних факторів і цитокінів, що вивільняються з періімплантного тромбу. Утворення тромбів на імплантаті з різними поверхнями імплантатів вважається вирішальним фактором для ефективного утримання фібрину і може критично впливати на загоєння кістки та остеоінтеграцію, впливаючи на транспортування макромолекул, поведінку клітин і контактну/дистанційну остеогенезу. У тесті статичного згортання крові SA + VUV + BS показав вищу абсорбцію крові навколо імплантаційних фіксаторів у порівнянні з SA + VUV, але не до статистично значущого ступеня. Це вказує на те, що поверхня SA, фотофункціоналізована VUV, має принаймні таку ж здатність до згортання крові. Ми спроектували нові експерименти для підтвердження згортання крові шляхом гемостазу безперервних капілярних кровотеч, щоб якомога точніше змоделювати реальні клінічні ситуації. У тесті in vitro динамічного згортання крові тромби утворювалися значно швидше, і загальний об'єм крові, що збирається через проміжок між отворами та імплантаційним фіксатором до гемостазу, був значно меншим у SA + VUV + BS, ніж у SA + VUV. Тест in vivo також показав значну різницю в загальній вазі кровотечі між надмірно підготовленим отвором і імплантаційним фіксатором серед SA, SA + VUV і SA + VUV + BS. Це свідчить про те, що SA + VUV + BS може індукувати швидше утворення тромбу навколо поверхні імплантату, що призводить до більш ефективної взаємодії між кісткою та імплантатом для остеоінтеграції. З клінічної точки зору ці особливості SA + VUV + BS важливі для візуалізації хірургічного сайту та одночасної направленої регенерації кістки, що часто вказується для адекватної кількості та якості періімплантних тканин для більш естетичних і функціональних результатів, оскільки швидке згортання крові тісно пов'язане зі стабілізацією матеріалу для пересадки та бар'єрної мембрани. Нарешті, SA + VUV може бути альтернативою SA + VUV + BS для SA з точки зору потенціалу утворення тромбу на поверхнях імплантатів.
Під час свердління імплантів у кістці, що створює слабо кисле середовище, буфер pH може допомогти підтримувати постійний рівень pH. Як матеріал покриття, буферний агент pH, здається, контролює вивільнення запальних медіаторів і покращує умови для активності остеобластів, підтримуючи постійний рівень pH або, принаймні, запобігаючи значним змінам. Активність тромбоцитів у згортанні крові, а також активність остеобластів і рівень ALP для формування кістки також пригнічуються екстрацелюлярною ацидозою. SA + VUV + BS можуть максимізувати активність тромбоцитів, тромбогенез, активність остеобластів і рівень ALP на інтерфейсі кістка-імплант завдяки буферному ефекту pH. Подальші дослідження будуть необхідні для вивчення SA + VUV + BS щодо його безпеки та ефективності в клінічних умовах. Також слід провести рандомізовані контрольовані випробування, щоб підтвердити його доцільність у різних клінічних умовах, таких як встановлення імплантів безпосередньо після видалення зуба або з одночасним збільшенням кістки.
Чанг-Чжу Парк, Дже Хьонг Лім, Марко Талларіко, Кьонг-Гюн Хванг, Хьок Чой, Гю-Джанг Чо, Чанг Кім, Іл-Сок Чанг, Джу-Донг Сонг, Емі М. Квон, Санг Хо Чон та Хьон-Кьонг Парк
Посилання
- Özcan, M.; Hämmerle, C. Титан як матеріал для реконструкції та імплантації в стоматології: Переваги та підводні камені. Materials 2012, 5, 1528–1545. [CrossRef]
- Ehrenfest, D.M.D.; Coelho, P.G.; Kang, B.S.; Sul, Y.T.; Albrektsson, T. Класифікація оссеоінтегрованих поверхонь імплантатів: матеріали, хімія та топографія. Trends Biotechnol. 2010, 28, 198–206. [CrossRef]
- Milošev, I.; Metikoš-Hukovic´, M.; Strehblow, H.H. Пасивна плівка на ортопедичному сплаві TiAlV, що утворюється в фізіологічному розчині, досліджена за допомогою рентгенівської фотоелектронної спектроскопії. Biomaterials 2000, 21, 2103–2113. [CrossRef]
- Lee, J.H.; Ogawa, T. Біологічне старіння титанових імплантатів. Implant Dent. 2012, 21, 415–421. [CrossRef]
- Hori, N.; Att, W.; Ueno, T.; Sato, N.; Yamada, M.; Saruwatari, L.; Suzuki, T.; Ogawa, T. Вік-залежне зниження здатності до адсорбції білка титану. J. Dent. Res. 2009, 88, 663–667. [CrossRef]
- Hori, N.; Ueno, T.; Suzuki, T.; Iwasa, F.; Yamada, M.; Att, W.; Okada, S.; Ohno, A.; Aita, H.; Kimoto, K. Обробка ультрафіолетовим світлом для відновлення вікової деградації біоактивності титану. Int. J. Oral Maxillofac. Implant. 2010, 25, 49–62.
- Ogawa, T. Ультрафіолетова фотофункціоналізація титанових імплантатів. Int. J. Oral Maxillofac. Implant. 2014, 29, e95–e102. [CrossRef] [PubMed]
- Rosales-Leal, J.; Rodríguez-Valverde, M.; Mazzaglia, G.; Ramón-Torregrosa, P.; Díaz-Rodríguez, L.; García-Martínez, O.; Vallecillo-Capilla, M.; Ruiz, C.; Cabrerizo-Vílchez, M. Вплив шорсткості, зволожуваності та морфології інженерних титанових поверхонь на адгезію остеобластоподібних клітин. Colloids Surf. Physicochem. Eng. Aspects 2010, 365, 222–229. [CrossRef]
- Cicciù, M.; Fiorillo, L.; Herford, A.S.; Crimi, S.; Bianchi, A.; D’Amico, C.; Laino, L.; Cervino, G. Біоактивні титанові поверхні: Взаємодії еукаріотичних та прокаріотичних клітин нано-пристроїв, застосованих у стоматологічній практиці. Biomedicines 2019, 7, 12. [CrossRef]
- Li, D.; Ferguson, S.J.; Beutler, T.; Cochran, D.L.; Sittig, C.; Hirt, H.P.; Buser, D. Біомеханічне порівняння піскоструйно обробленої та кислотно-етованої та обробленої механічно та кислотно-етованої титанової поверхні для стоматологічних імплантатів. J. Biomed. Mater. Res. 2002, 60, 325–332. [CrossRef]
- Kaysinger, K.K.; Ramp, W.K. Позаклітинний pH модулює активність культурованих людських остеобластів. J. Cell. Biochem. 1998, 68, 83–89. [CrossRef]
- Marumo, M.; Suehiro, A.; Kakishita, E.; Groschner, K.; Wakabayashi, I. Позаклітинний pH впливає на агрегацію тромбоцитів, пов'язану з модулюванням входу Ca2+ з резервуара. Thromb. Res. 2001, 104, 353–360. [CrossRef]
- Hong, J.; Kurt, S.; Thor, A. Гідрофільна поверхня стоматологічного імплантату виявляє тромбоцитарні властивості in vitro. Clin. Implant Dent. Relat. Res. 2013, 15, 105–112. [CrossRef]
- Di Iorio, D.; Traini, T.; Degidi, M.; Caputi, S.; Neugebauer, J.; Piattelli, A. Кількісна оцінка розширення фібринового згустку на різних поверхнях імплантатів: in vitro дослідження. J. Biomed. Mater. Res. 2005, 74, 636–642. [CrossRef]
- Pae, H.C.; Kim, S.K.; Park, J.Y.; Song, Y.W.; Cha, J.K.; Paik, J.W.; Choi, S.H. Біоактивні характеристики поверхні імплантату, покритої буферним агентом pH: in vitro дослідження. J. Periodontal Implant. Sci. 2019, 49, 366–381. [CrossRef]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Радіологічний порівняльний аналіз між заповненням фізіологічним розчином та фібрином, збагаченим тромбоцитами, після гідравлічного транс-крестального підняття синуса без додаткової кісткової пересадки: рандомізоване контрольоване дослідження. Clin. Oral Implant. Res. 2020. [CrossRef] [PubMed]
- Att, W.; Hori, N.; Iwasa, F.; Yamada, M.; Ueno, T.; Ogawa, T. Вплив UV-фотофункціоналізації на час-залежну біоактивність титану та сплавів хрому-кобальту. Biomaterials 2009, 30, 4268–4276. [CrossRef]
- Shie, J.L.; Lee, C.H.; Chiou, C.S.; Chang, C.T.; Chang, C.C.; Chang, C.Y. Кінетика фотодеградації формальдегіду за допомогою джерел світла UVA, UVC та UVLED у присутності складеного фотокаталізатора срібного титанової оксиду. J. Hazard. Mater. 2008, 155, 164–172. [CrossRef]
- McGivney, E.; Carlsson, M.; Gustafsson, J.P.; Gorokhova, E. Впливи UV-C та вакуумно-UV TiO2 на процеси окиснення на гостру смертність мікроводоростей. Photochem. Photobiol. 2015, 91, 1142–1149. [CrossRef]
- Westall, J.; Hohl, H. Порівняння електростатичних моделей для оксидного розчинного інтерфейсу. Adv. Colloid Interface Sci. 1980, 12, 265–294. [CrossRef]
- Tang, L.; Thevenot, P.; Hu, W. Хімія поверхні впливає на біосумісність імплантатів. Curr. Top. Med. Chem. 2008, 8, 270–280. [CrossRef]
- Coelho, P.G.; Granjeiro, J.M.; Romanos, G.E.; Suzuki, M.; Silva, N.R.; Cardaropoli, G.; Thompson, V.P.; Lemons, J.E. Основні методи дослідження та сучасні тенденції поверхонь стоматологічних імплантатів. J. Biomed. Mater. Res. 2009, 88, 579–596. [CrossRef]
- Puleo, D.; Nanci, A. Розуміння та контроль інтерфейсу кістка-імплантат. Biomaterials 1999, 20, 2311–2321. [CrossRef]
- Morra, M.; Cassinelli, C.; Cascardo, G.; Mazzucco, L.; Borzini, P.; Fini, M.; Giavaresi, G.; Giardino, R. Поверхні титану, покриті колагеном I: адгезія мезенхімальних клітин та in vivo оцінка в імплантатах з трабекулярної кістки. J. Biomed. Mater. Res. 2006, 78, 449–458. [CrossRef] [PubMed]
- Morra, M. Біохімічна модифікація титанових поверхонь: пептиди та білки ECM. Eur. Cell. Mater. 2006, 12, 15. [CrossRef]
- Makowiecki, A.; Hadzik, J.; Błaszczyszyn, A.; Gedrange, T.; Dominiak, M. Оцінка супергідрофільних поверхонь стоматологічних імплантатів - систематичний огляд та мета-аналіз. BMC Oral Health 2019, 19, 79. [CrossRef]
- Khandelwal, N.; Oates, T.W.; Vargas, A.; Alexander, P.P.; Schoolfield, J.D.; Alex McMahan, C. Звичайні SLA та хімічно модифіковані SLA імплантати у пацієнтів з погано контрольованим цукровим діабетом 2 типу - рандомізоване контрольоване дослідження. Clin. Oral Implant. Res. 2013, 24, 13–19. [CrossRef]
- Kokovic, V.; Jung, R.; Feloutzis, A.; Todorovic, V.S.; Jurisic, M.; Hämmerle, C.H. Негайне порівняння навантаження SLA імплантатів у задній частині нижньої щелепи: 5-річні результати рандомізованого контрольованого клінічного дослідження. Clin. Oral Implant. Res. 2014, 25, e114–e119. [CrossRef]
- Cesaretti, G.; Botticelli, D.; Renzi, A.; Rossi, M.; Rossi, R.; Lang, N.P. Радіографічна оцінка імплантатів, які були негайно навантажені, що підтримують 2–3 одиниці фіксованих мостів у задній частині верхньої щелепи: 3-річне спостереження в рамках проспективного рандомізованого контрольованого багатопрофільного клінічного дослідження. Clin. Oral Implant. Res. 2016, 27, 399–405. [CrossRef]
- Buser, D.; Broggini, N.; Wieland, M.; Schenk, R.; Denzer, A.; Cochran, D.; Hoffmann, B.; Lussi, A.; Steinemann, S. Підвищена остеоінтеграція до хімічно модифікованої SLA титанової поверхні. J. Dent. Res. 2004, 83, 529–533. [CrossRef]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Раннє оссеоінтеграція до гідрофільних та гідрофобних поверхонь імплантатів у людей. Clin. Oral Implant. Res. 2011, 22, 349–356. [CrossRef] [PubMed]
- Gittens, R.A.; Scheideler, L.; Rupp, F.; Hyzy, S.L.; Geis-Gerstorfer, J.; Schwartz, Z.; Boyan, B.D. Огляд зволожуваності поверхонь стоматологічних імплантатів II: Біологічні та клінічні аспекти. Acta Biomater. 2014, 10, 2907–2918. [CrossRef]
- Shiu, H.T.; Goss, B.; Lutton, C.; Crawford, R.; Xiao, Y. Формування кров'яного згустку на біоматеріальних імплантатах впливає на загоєння кістки. Tissue Eng. Part B Rev. 2014, 20, 697–712. [CrossRef]
- Yang, J.; Zhou, Y.; Wei, F.; Xiao, Y. Кров'яний згусток, що утворився на шорсткій титановій поверхні, індукує раннє залучення клітин. Clin. Oral Implant. Res. 2016, 27, 1031–1038. [CrossRef]
- Gassling, V.; Hedderich, J.; Açil, Y.; Purcz, N.; Wiltfang, J.; Douglas, T. Порівняння фібрину, збагаченого тромбоцитами, та колагену як каркасів, населених остеобластами, для застосувань у тканинній інженерії кістки. Clin. Oral Implant. Res. 2013, 24, 320–328. [CrossRef]
