Радіологічний порівняльний аналіз між заповненням фізіологічним розчином та тромбоцитарно-багатим фібрином після гідравлічного транс-крестцевого підняття синуса без додаткової кісткової присадки: рандомізоване контрольоване дослідження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Оцінити виживаність імплантів, будь-які ускладнення та зміни в залишковій альвеолярній висоті (RABH) за допомогою заповнення фізіологічним розчином або фібрином, збагаченим тромбоцитами (PRF), після гідравлічного транс-крестального підняття синуса.
Методи: Стоматологічні імпланти були встановлені після гідравлічного транс-крестального підняття синуса та заповнення фізіологічним розчином (20 пацієнтів) або PRF (20 пацієнтів). Оцінювальні показники включали виживаність імплантів, будь-які ускладнення та зміни RABH. КТ з конусним променем (CBCT) були виконані та порівняні до операції (T0), відразу після операції (T1), через 3 місяці (T2), 6 місяців (T3) та 12 місяців після операції (T4) відповідно.
Результати: Усього у 40 пацієнтів було встановлено 45 імплантів середньою довжиною 10.4 ± 0.8 мм у задній частині верхньої щелепи зі середньою RABH 6.8 ± 1.1 мм. Збільшення RABH досягло піку на T1, і спостерігалося постійне провисання мембрани синуса, але стабілізувалося на T3. Тим часом поступове збільшення радіопрозорості було виявлено під піднятою мембраною синуса. Заповнення PRF спричинило радіографічний приріст кістки в синусі на 2.6 ± 1.1 мм, що було значно більше, ніж 1.7 ± 1.0 мм заповнення фізіологічним розчином на T4 (p < .05). Усі імпланти функціонували без значних ускладнень протягом одного року спостереження.
Висновки: У цьому рандомізованому дослідженні випадків і контролю було підтверджено можливість гідравлічного транс-крестового підняття синуса без кісткового трансплантату, і PRF може бути кращим заповнювачем для підтримки піднятої синусової мембрани. Однак додаткове кісткове трансплантування все ще слід вказувати для випадків, які потребують більше ніж 2–3 мм приросту кістки в синусі.
Вступ
Встановлення зубних імплантів у беззубій задній щелепі часто обмежене через резорбцію альвеолярного процесу під максилярним синусом після втрати зуба. Щоб подолати ці недоліки, було розроблено різні техніки та інструменти для хірургії підняття синуса. Трансальвеолярний (або транс-крестовий) підхід був введений Татумом, а інструмент, відомий як "формувач лунки", використовувався для інфракції підлоги синуса та переміщення її в більш апікальному напрямку (Татум, 1986). Жоден матеріал для трансплантації не використовувався для збільшення та підтримки об'єму піднятої області. Різні матеріали, включаючи аутогенний, аллогенний або ксеногенний кісткові трансплантати, були додані в простір, створений під піднятою синусовою мембраною (Уоллес та ін., 2012). Однак немає переконливого дослідження, яке б повідомляло про переваги кісткового трансплантату, вставленого в апікальну частину імпланта (Андреасі Басі, Лопес, Конфалоне та Карінчі, 2015). Крім того, може існувати ризик перфорації мембрани через гострі краї гранул трансплантату (Кхер та ін., 2014).
Нещодавно було продемонстровано, що послідовне збільшення кістки в верхньощелепній пазусі може бути досягнуто без додавання будь-якого матеріалу для пересадки кістки (Lundgren, Andersson, Gualini, & Sennerby, 2004; Nedir, Bischof, Vazquez, Szmukler-Moncler, & Bernard, 2006; Nedir, Nurdin, Vazquez, Abi Najm, & Bischof, 2016; Palma et al., 2006; Sohn, Lee, Ahn, & Shin, 2008). Здається, що існує все більше доказів того, що імплантат сам по собі функціонує як "опора намету", щоб запобігти обваленню піднятої мембрани пазухи. Більше того, мембрану пазухи можна піднімати більше і довше під час фази утворення нової кістки, якщо є матеріали, що заповнюють простір між підлогою пазухи та піднятою мембраною пазухи; фізіологічний розчин, власна венозна кров пацієнта та колагенові губки, просочені цими рідинами, зазвичай використовуються для цієї мети (Lundgren et al., 2004; Palma et al., 2006; Sohn et al., 2008).
Фібрин, збагачений тромбоцитами (PRF), є аутохтонним концентратом тромбоцитів, що містить фактори росту, похідні з тромбоцитів (PDGF), інсуліноподібний фактор росту (IGF), фактори росту ендотелію судин (VEGF), трансформуючий фактор росту бета (TGF-β) та ангіогенетичні фактори, похідні з тромбоцитів (Peterson et al., 2010). PRF використовувався як матеріал для пересадки в процедурах збільшення верхньощелепної пазухи самостійно або в комбінації з матеріалами для пересадки, щоб сприяти регенерації кістки та збільшити кількість новоутвореної кістки, збільшуючи кількість остеопрогеніторних клітин (Mazor et al., 2009; Nizam et al., 2018).
Метою цього рандомізованого контрольованого дослідження було оцінити, чи може введення фізіологічного розчину або PRF вплинути на виживаність імплантату, а також визначити будь-які зміни у висоті залишкової альвеолярної кістки (RABH) після гідравлічного підняття синусової мембрани з використанням транс-крестального підходу. Нульова гіпотеза полягала в тому, що немає різниці в збільшенні RABH між групами.
Матеріали та методи
Це дослідження було спроектовано як рандомізоване контрольоване дослідження і проведено в двох центрах (Відділення щелепно-лицевої хірургії/Кафедра стоматології, лікарня Ханянг, та стоматологічна лікарня Апсун) з вересня 2016 року по серпень 2017 року. Дослідження було затверджено Інституційним наглядовим комітетом лікарні Ханянг (IRB No. 2016–05–039) та зареєстровано в міжнародній платформі реєстрації клінічних випробувань ВООЗ (KCT0005252). Воно проводилося відповідно до Декларацій Гельсінкі та міжнародно визнаних рекомендацій для РКД, включаючи заяву CONSORT (www.consort-statement.org). Усі хірургічні та протезні процедури виконували два експерти (YSC та CJP).
Для початкового скринінгу використовувалися періапікальні та панорамні рентгенограми. У це дослідження були включені всі здорові пацієнти віком від 18 років і старше, які мали адентію в задній частині верхньої щелепи та зменшену RABH, що унеможливлювало встановлення імплантатів довжиною більше 8,5 мм, після надання інформованої згоди. Критерії виключення включали RABH менше 5 мм, виміряний на комп'ютерній томографії з конусним променем (CBCT), а також системні або локальні протипоказання для встановлення імплантатів, включаючи історію неконтрольованих метаболічних розладів, звичку куріння, бруксизм або неконтрольовану пародонтальну хворобу. Пацієнти, які брали участь у дослідженні, були проінформовані про хірургічні процедури, матеріали, що будуть використані, переваги, а також потенційні ризики та ускладнення цього клінічного дослідження.
Після місцевої анестезії був піднятий повнотканинний клапоть для оголення альвеолярного гребеня. Було проведено маркування кортикальної кістки, і використовували свердло діаметром 2,2 мм для свердління на глибину 1 мм нижче дна синуса. Для розширення остеотомічного сайту та отримання доступу до мембрани синуса використовувалася спеціальна система свердління (OneCAS Kit; Osstem) (Gatti et al., 2018). Ін'єкція та відбір фізіологічного розчину повторювалися поступово, щоб гідравлічно відокремити та підняти мембрану від дна синуса. Будь-яке пошкодження мембрани виключалося негативним тиском, що виникає внаслідок аспірації введеного фізіологічного розчину. Після рандомізації перед хірургією пацієнти були розподілені на дві групи: фізіологічний розчин або PRF. У групі фізіологічного розчину було введено 5 мл фізіологічного розчину для підтримки піднятої мембрани синуса, тоді як у групі PRF було отримано таку ж кількість лейкоцитарного та тромбоцитарного багатого фібрину (L-PRF) за допомогою протоколу приблизно 480 g протягом 12 хвилин (відносна центрифугальна сила (RCF) згустку = 408 g) за допомогою центрифуги (кут ротору 33°, радіус 50 мм на згустку, 80 мм при максимальному, Intra-Lock, Boca Raton, FL) у скляних пластикових трубках з покриттям об'ємом 9 мл (Miron, Pinto, Quirynen, & Ghanaati, 2019) та введено en masse під підняту мембрану синуса через отвір для свердління імплантату.
У жодній з груп не було додано матеріалів для пересадки кістки. Довжина імплантатів визначалася шляхом вибору найближчого фіксатора, який був у два рази більший за RABH, без перевищення 11,5 мм. Усі імплантати (TS III SOI, Osstem) були встановлені з моментом затягування понад 25 Ncm. Імплантати мали піскоструйну та кислотно-етичну поверхню, покриту буферним агентом pH, щоб ввести гідрофільні властивості, сприяти остеоінтеграції під час раннього періоду загоєння та прискорити утворення нової кістки. Після підключення загоювального абатмента клапті були зашиті без будь-якого натягу. Пацієнти отримували знеболювальні та антибіотики протягом 10 днів, а також було призначено полоскання рота 0,2% хлоргексидину тричі на день. Постопераційні ускладнення були зафіксовані, а шви були видалені через 10 днів після операції.
Результативні показники включали рівні виживання імплантатів, біологічні або механічні ускладнення та зміни в RABH. Рівні виживання імплантатів оцінювалися незалежним оцінювачем (KGH), і імплантат вважався невдалим, якщо він проявляв рухливість, прогресивну втрату країв кістки, інфекцію або будь-які ускладнення, які робили імплантат непридатним. Будь-які біологічні (біль, набряк, гній, тощо) та/або механічні (такі як перелом) ускладнення, які виникли протягом однорічного періоду спостереження, були зафіксовані та лікувалися тими ж експертами.
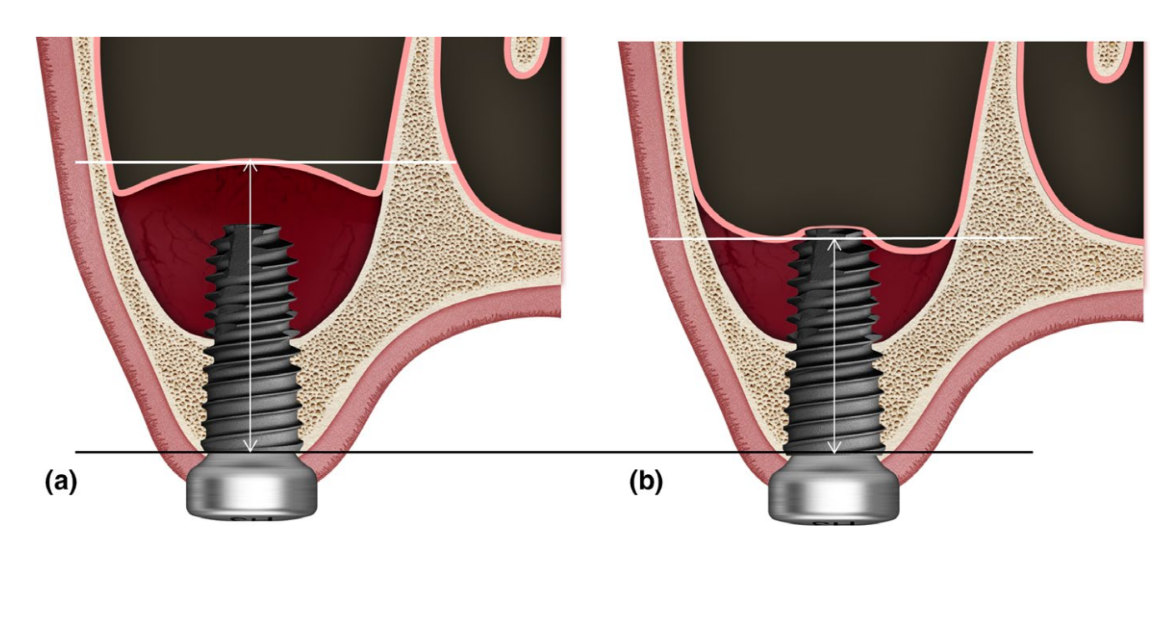
Зміни в RABH оцінювалися на зображеннях CBCT, зроблених до операції (T0), відразу після операції (T1), а також через 3 (T2), 6 (T3) та 12 місяців (T4) після операції незалежним сліпим експертом (SHJ). Параметри експозиції для сканування CBCT (поле зору 35 × 50 мм; розмір вокселя 0.2 мм; час 10.8 с; kV 75; mA 10; доза площі 240 мГр·см2) були встановлені на максимально можливий рівень, що досягається (ALARA). RABH вимірювався як найвіддаленіша відстань від альвеолярного гребеня до верхнього інтра-синусного радіопрозорого краю, який вважався піднятою синусовою мембраною, паралельно довгій осі кожного імплантату на реконструйованому корональному зображенні CBCT (Рисунок 1). Зокрема, коли цей радіопрозорий край опускався нижче верхівки імплантату, проникаюча верхівка імплантату не враховувалася як верхній радіопрозорий край, а в випадках з кількома імплантатами відстані, виміряні на кожному імплантаті, підсумовувалися та середньоарифметично обчислювалися. Накладення та аналіз зображень CBCT виконувалися за допомогою програмного забезпечення OnDemand3D (Cybermed Inc).
Статистичний аналіз
За припущенням про рівність дисперсій, розмір вибірки був визначений з рівнем альфа 0.05 для досягнення потужності 90% за допомогою RABH, що коливався від 1.5 до 6.0 мм зі стандартним відхиленням 0.9 мм з попереднього дослідження за участю PRF (Mazor et al., 2009). На основі цих результатів мінімальний розмір вибірки був оцінений у 21 особу в кожній групі з урахуванням можливого рівня втрат 10% протягом періоду дослідження. Повторний аналіз дисперсії (ANOVA) був використаний для аналізу впливу групи та часу на RABH, а також ад хок тест на основі корекції Бонферроні для порівняння впливу групи на RABH у конкретний період часу. Усі статистичні аналізи були виконані за допомогою SPSS, версія 20 (SPSS Inc). Статистична значущість була встановлена як p < .05.
Результати
Усього було послідовно залучено 42 пацієнти, і двоє пацієнтів вибули (один з кожної групи) через втрати на етапі спостереження. Врешті-решт, дані 40 пацієнтів (21 чоловік і 19 жінок) зі середнім віком 45.6 років (від 27 до 70 років) були зібрані та оцінені в цьому дослідженні (Таблиця 1). Загалом, середній RABH становив 6.8 ± 1.1 мм (від 5.3 до 8.1 мм), і було встановлено 45 імплантатів зі середньою довжиною 10.4 ± 0.8 мм у задній частині верхньої щелепи. У групі з фізіологічним розчином було 22 імплантати, а в групі PRF - 23 імплантати відповідно.
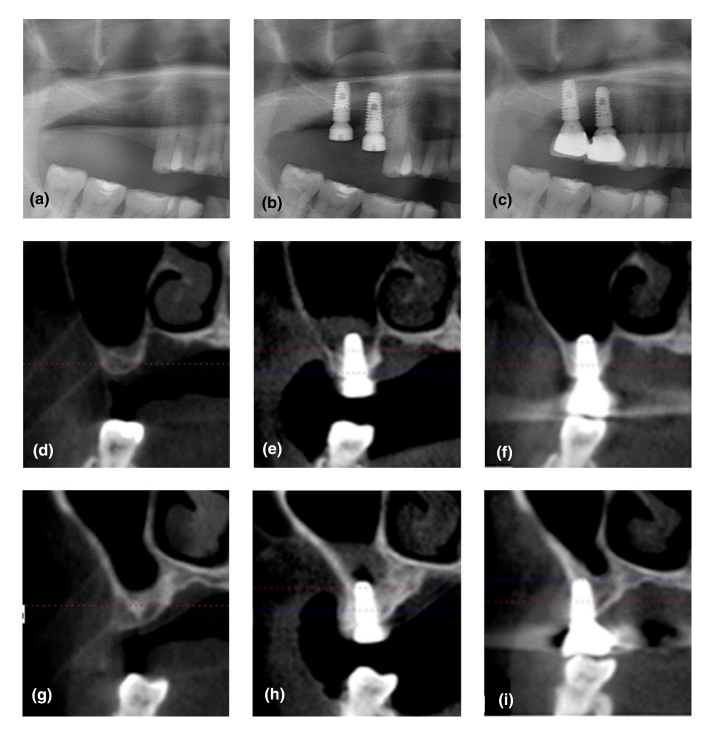
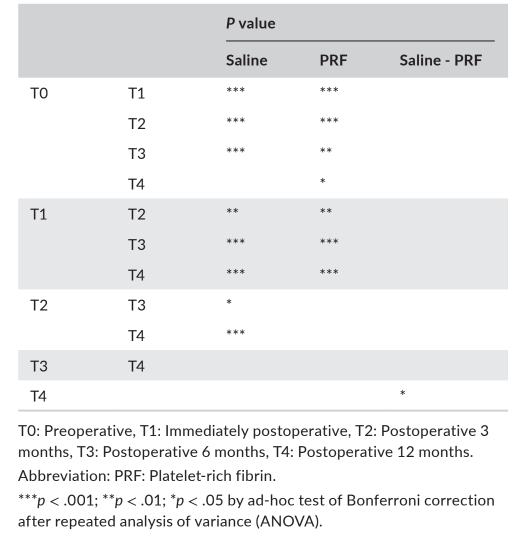
Жоден імплантат не зазнав невдачі, і жодних значних ускладнень, за винятком фізіологічного набряку після хірургічного втручання, не спостерігалося в жодній групі протягом періоду спостереження. Верхній інтра-синусовий радіопрозорий край, який був чітко окреслений на T1, був майже не відрізняється від залишкової альвеолярної кістки на T4 на панорамних та CBCT зображеннях (Рисунок 2). Хоча жоден матеріал для кісткової пластики не використовувався, спостерігалося збільшення RABH, виміряного навколо імплантатів, яке досягло піку на T1 і продовжувало зменшуватися до T4. Збільшення RABH було показано зі середнім значенням, стандартним відхиленням та 95% довірчим інтервалом (Рисунок 3), а потужність цього тесту була оцінена як 98.44%. Щодо впливу групи на збільшення RABH, значна різниця була виявлена лише на T4 (p < .05).
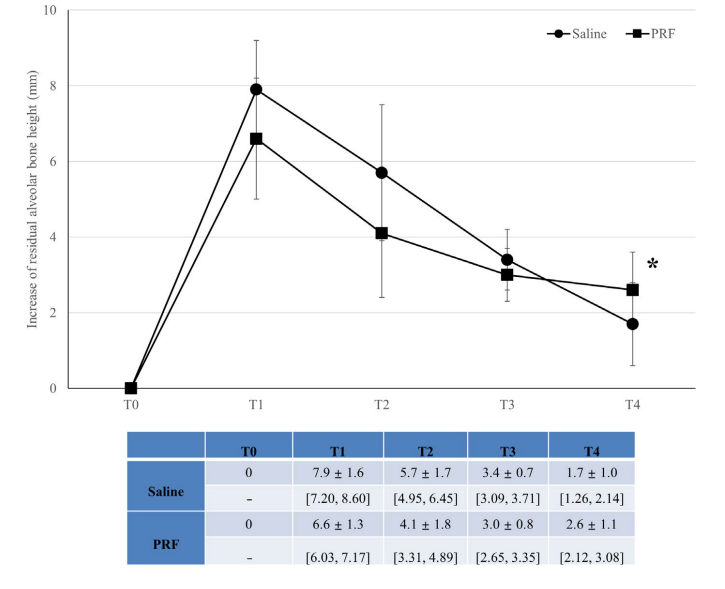
У таблиці 2 представлені статистичні значущості різниці в вимірюваннях між часами та групами. У групі з фізіологічним розчином була статистично значуща різниця серед RABH на всіх часових періодах (p < .001), а тести множинного порівняння Бонферроні показали статистично значущі різниці на T0-T1, T0-T2, T0-T3, T1-T3, T1-T4, T2-T4 (p < .001), T1-T2 (p < .01) та T2-T3 (p < .05). У групі PRF також була статистично значуща різниця серед RABH на всіх часових періодах (p < .001), а тести множинного порівняння Бонферроні показали статистично значущі різниці на T0-T1, T0-T2, T1-T3, T1-T4 (p < .001), T0-T3 (p < .01) та T0-T4 (p < .05).
Обговорення
Це рандомізоване контрольоване дослідження було розроблено для оцінки рівня виживання імплантів, ускладнень та змін у RABH з використанням фізіологічного розчину або PRF після гідравлічного транс-крестального підняття синуса без вставки додаткової кісткової пластини. Кілька клінічних публікацій продемонстрували, що ефекти "тент-поля" імплантів, які були встановлені одночасно, запобігли обваленню піднятої синусової мембрани (Лундгрен, Крикіо, Пальма, Салата та Сеннербі, 2008; Сон та ін., 2008). Коли абсорбційна желатинова губка була вільно вставлена під підняту синусову мембрану як альтернатива кістковому заповнювачу, було також виявлено, що вона діє як утримувач простору для нової кісткової тканини в верхньощелепному синусі (Сон та ін., 2008). Наші результати підтвердили висновки попередніх досліджень, включаючи обвисання піднятої синусової мембрани або повторну пневматизацію верхньощелепного синуса (Лундгрен та ін., 2004, 2008; Недір та ін., 2016; Сон та ін., 2008). Цей процес був стабілізований через 6 місяців після операції, однак тривав до 12 місяців у обох групах.
У цьому дослідженні було виявлено радіографічне збільшення кістки на 1.7 ± 1.0 мм та 2.3 ± 1.9 мм у синусовій порожнині через рік після гідравлічного підняття синуса без кісткових трансплантатів з додаванням фізіологічного розчину та PRF відповідно. Раніше повідомлялося, що імплантати, встановлені в синусах 40 пацієнтів за допомогою остеотомної техніки без матеріалів для кісткових трансплантатів, мали середнє збільшення RABH на відсканованих панорамних рентгенограмах 2.9 ± 1.2 мм через 6 місяців (Leblebicioglu, Ersanli, Karabuda, Tosun, & Gokdeniz, 2005); крім того, як і в даному дослідженні, рівень виживання імплантатів становив 100%. Нове утворення кістки на 2.5 ± 1.2 мм від дна синуса до верхівки імплантату на періапікальних рентгенограмах через рік після підняття дна синуса за технікою остеотомії без трансплантації (Nedir et al., 2006), а також збільшення кістки на 1.7 ± 2.0 мм на періапікальних рентгенограмах через 3 роки після встановлення імплантату (Pjetursson & Lang, 2014) були продемонстровані. На відміну від цих попередніх досліджень, наше дослідження використовувало зображення CBCT для більш точного вимірювання змін у піднятті синусової мембрани. Незважаючи на те, що суттєві клінічно значущі зміни були чітко виявлені при порівнянні T1 і T4, а серійні CBCT мали підвищений ризик опромінення, CBCT були зроблені на T2 і T3 виключно для дослідницьких цілей. Більш конкретно, T2 було включено для уточнення суттєвого осідання піднятої синусової мембрани, яке в основному спостерігалося через 3 місяці після операції (Lundgren et al., 2008), а T3 вважалося важливим з точки зору внутрішньосинусної регенерації кістки, оскільки оклюзійне навантаження зазвичай застосовується до імплантатів через 6 місяців після операції.
Деякі клініцисти можуть сумніватися в доцільності використання терміна RABH, оскільки м'які та тверді тканини змішуються протягом усього періоду дослідження. Оскільки комплексне вимірювання м'яких і твердих тканин у синусі вважалося важливим для розуміння змін у синусі до утворення кістки, ми прийняли термін RABH і виміряли найвіддаленішу відстань до верхнього радіопрозорого краю в синусі. Іноді було технічно важко чітко розділити їх.
Радіопрозорість відсіку, заповненого або фізіологічним розчином, або PRF під піднятою мембраною синуса, спостерігалася поступово зростаючою, і подальші дослідження будуть необхідні для підтвердження утворення нової кістки в цьому відсіку. Цікаво, що попередні гістологічні дослідження в основному повідомляли про утворення нової кістки після підняття мембрани синуса без кісткового трансплантату (Лундгрен та ін., 2008; Пальма та ін., 2006); однак одне дослідження не показало помітного утворення нової кістки (Аhn, Чо, Бірн, Кім та Шин, 2011).
Багато клінічних досліджень повідомляли про успішні результати операції підняття синуса з використанням остеотомів (Giannini et al., 2015; Komarnyckyj & London, 1998). Однак ускладнення, що виникає внаслідок повторної тупої травми внутрішнього вуха від ударів молотком, такі як доброякісний пароксизмальний позиційний запаморочення, можливе, і його поширеність може збільшитися у випадках жорсткої кортикальної основи синуса або основи синуса з перегородкою (Ahn, Park, & Kim, 2012; Hatano, Sennerby, & Lundgren, 2007). Щоб подолати обмеження традиційної техніки остеотомії, на ринок імплантів було введено багато інноваційних інструментів, і гідравлічний підйомник у наборі CAS також розроблений для гідравлічного підняття мембрани синуса замість фізіологічного розчину. Іншою перевагою гідравлічного підйомника є те, що мембрану синуса можна підняти набагато ширше і вище (Додаткові дані).
У нашому дослідженні фізіологічний розчин або PRF були заповнені в новому відсіку під піднятою мембраною синуса як прокладка для підтримки мембрани синуса, і всі імпланти були успішними. Хоча на T1 були деякі порожнечі, радіопрозорості під піднятою мембраною синуса зросли з зникненням порожнеч у обох групах з часом. Наші результати також свідчать про те, що PRF може ефективніше заповнювати простір, створений під піднятою мембраною синуса, ніж фізіологічний розчин, і викликати більше утворення кістки в синусі без додаткової кісткової пересадки під час гідравлічного транс-крестового підняття синуса. Попереднє дослідження показало, що PRF поступово вивільняє аутохтонні фактори росту і викликає сильний і тривалий ефект на проліферацію та диференціацію остеобластів (He, Lin, Hu, Zhang, & Wu, 2009). Крім того, використання PRF як єдиного заповнювального матеріалу під час одночасного підняття синуса та імплантації було зареєстровано для стабілізації великого обсягу природно регенерованої кістки в підсинусовій порожнині до кінчика імплантів (Mazor et al., 2009). Оскільки PRF є простим і недорогим біоматеріалом, його використання здається більш актуальним варіантом, ніж будь-який інший заповнювальний матеріал під час операції підняття синуса без кісткових пересадок. Однак загальний приріст кістки обмежений 2–3 мм, і невелика різниця між групами фізіологічного розчину та PRF повинні бути враховані перед рутинним застосуванням PRF як єдиного заповнювального матеріалу. Більше того, як показано на малюнку 2f, ефект "тент-поля" імпланта не зміг зберегтися до 12 місяців після операції, і провисання тонкої та гнучкої мембрани синуса було неминучим майже в усіх випадках. Строгі критерії включення для цієї процедури є обов'язковими, і використання матеріалів для кісткових пересадок повинно бути вказано для випадків, що потребують більшого утворення кістки в синусі, особливо над верхівкою імпланта.
Головним обмеженням нашого рандомізованого контрольованого дослідження було те, що не було встановлено ні негативного контролю без фізіологічного розчину та PRF, ні позитивного контролю з пересадкою. Враховуючи сліпу природу транс-крестового підняття синуса, особливо гідравлічного підняття, практично дуже важко підтвердити повне видалення фізіологічного розчину, який використовувався для відокремлення та підняття мембрани синуса. Тому групу без фізіологічного розчину було майже неможливо встановити як негативний контроль, і ми натомість суворо контролювали загальний об'єм фізіологічного розчину, використаного під час операції. Група з фізіологічним розчином також була обрана як негативний контроль, щоб зробити дві процедури, заповнення фізіологічним розчином та PRF, якомога більш схожими. Останні дослідження повідомляли про здатність нової кісткової тканини формуватися лише за рахунок підняття мембрани синуса без пересадки кістки (Lundgren et al., 2004, 2008; Nedir et al., 2006, 2016; Palma et al., 2006; Sohn et al., 2008; Sohn, Moon, Moon, Cho, & Kang, 2010; Winter, Pollack, & Odrich, 2003). Виходячи з цих обнадійливих результатів, групу з пересадкою кістки не було встановлено як позитивний контроль, оскільки це дослідження мало на меті з'ясувати, чи може PRF запропонувати якісь додаткові переваги в порівнянні з відсутністю пересадки кістки. Також було враховано, що існувала різноманітність результатів щодо формування кістки в синусі, які не можуть бути сформульовані відповідно до матеріалів для пересадки кістки.
Висновки
В межах обмежень цього дослідження можна зробити такі висновки:
- Після гідравлічного підняття синуса, використання фізіологічного розчину або PRF як єдиного матеріалу для заповнення може призвести до збільшення RABH, що стало результатом приросту кістки в синусі, на T4. Усі імплантати вижили, і під час періоду спостереження не було виявлено значних ускладнень.
- Незважаючи на ефект "тент-поля" імплантатів, опущення мембрани синуса було стабілізовано на T3, проте продовжувалося до T4.
- Заповнення PRF призвело до значно більшого збільшення RABH, ніж фізіологічний розчин на T4. Однак, додаткове кісткове пересадження все ще слід вказувати для випадків, які потребують більшого приросту кістки в синусі, враховуючи загальний приріст кістки в синусі, обмежений 2–3 мм.
Йонг-Сок Чо, Кюн-Гюн Хванг, Санг Хо Джун, Марко Талларіко, Емі М. Квон, Чанг-Джу Парк
Посилання
- Аhn, J. J., Cho, S. A., Byrne, G., Kim, J. H., & Shin, H. I. (2011). Нове утворення кістки після підняття мембрани синуса без пересадження кістки: гістологічні знахідки у людей. International Journal of Oral Maxillofacial Implants, 26(1), 83–90.
- Аhn, S. H., Park, E. J., & Kim, E. S. (2012). Підняття піднебінного синуса за допомогою реамера без остеотомії та одночасне встановлення імплантатів у зоні верхніх молярів: клінічні результати 391 імплантату у 380 пацієнтів. Clinical Oral Implants Research, 23(7), 866–872. https://doi.org/10.1111/j.1600-0501.2011.02216.x
- Андреасі Басі, М., Лопес, М. А., Конфалоне, Л., & Карінчі, Ф. (2015). Гідравлічна техніка підняття синуса у розвитку майбутніх ділянок: клінічний та гістоморфометричний аналіз людських біопсій. Implant Dentistry, 24(1), 117–124. https://doi.org/10.1097/ID.0000000000000200
- Гатті, Ф., Гатті, Ч., Талларіко, М., Томмасато, Г., Мелоні, С. М., & Чіапаско, М. (2018). Підняття мембрани верхньощелепного синуса за допомогою спеціальної системи свердління та гідравлічного тиску: 2-річне проспективне когортне дослідження. International Journal of Periodontics & Restorative Dentistry, 38(4), 593–599. https://doi.org/10.11607/prd.3403
- Джанніні, С., Сіньйоріні, Л., Бонаноме, Л., Северіно, М., Корпачі, Ф., & Чіело, А. (2015). Доброякісне пароксизмальне позиційне запаморочення (BPPV): може виникнути після стоматологічної імплантації. Міні огляд. European Review for Medical and Pharmacological Sciences, 19(19), 3543–3547.
- Хатано, Н., Сеннербі, Л., & Лундгрен, С. (2007). Підвищення верхньощелепного синуса за допомогою підняття мембрани синуса та периферичної венозної крові для реабілітації на основі імплантатів атрофічної задньої верхньої щелепи: серія випадків. Clinical Implant Dentistry and Related Research, 9(3), 150–155. https://doi.org/10.1111/j.1708-8208.2007.00043.x
- Хе, Л., Лінь, Й., Ху, Х., Чжан, Й., & У, Х. (2009). Порівняльне дослідження тромбоцитарного багатого фібрину (PRF) та тромбоцитарної плазми (PRP) на ефект проліферації та диференціації остеобластів щурів in vitro. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 108(5), 707–713. https://doi.org/10.1016/j.tripleo.2009.06.044
- Кхер, У., Іоанну, А. Л., Кумар, Т., Сіорппас, К., Міціас, М. Е., Мазор, З., & Котсакис, Г. А. (2014). Клінічна та рентгенографічна серія випадків імплантатів, встановлених за допомогою спрощеної малоінвазивної техніки підняття мембрани в задній частині верхньої щелепи. Journal of Cranio-Maxillofacial Surgery, 42(8), 1942–1947. https://doi.org/10.1016/j.jcms.2014.08.005
- Комарницький, О. Г., & Лондон, Р. М. (1998). Остеотомічне одноетапне встановлення стоматологічних імплантатів з підняттям синуса та без: клінічний звіт. International Journal of Oral Maxillofacial Implants, 13(6), 799–804. Леблебіджіоглу, Б., Ерсанлі, С., Карабуда, Ч., Тосун, Т., & Гокденіз, Х. (2005). Рентгенографічна оцінка стоматологічних імплантатів, встановлених за допомогою остеотомічної техніки. Journal of Periodontology, 76(3), 385–390.https://doi.org/10.1902/jop.2005.76.3.385
- Лундгрен, С., Андерссон, С., Гуаліні, Ф., & Сеннербі, Л. (2004). Реформація кістки з підняттям мембрани синуса: нова хірургічна техніка для підвищення рівня піднебінного синуса. Clinical Implant Dentistry and Related Research, 6(3), 165–173. https://doi.org/10.1111/j.1708-8208.2004.tb00224.x
- Лундгрен, С., Кріччо, Г., Пальма, В. Ч., Салата, Л. А., & Сеннербі, Л. (2008). Підняття мембрани синуса та одночасне встановлення стоматологічних імплантатів: нова хірургічна техніка в підвищенні рівня піднебінного синуса. Periodontology, 2000(47), 193–205. https://doi.org/10.1111/j.1600-0757.2008.00264.x
- Мазор, З., Хоровіц, Р. А., Дель Корсо, М., Прасад, Х. С., Рорер, М. Д., & Дохан Еренфест, Д. М. (2009). Підвищення рівня синуса з одночасним встановленням імплантатів за допомогою тромбоцитарного багатого фібрину Чоукруна як єдиного матеріалу для пересадки: рентгенологічне та гістологічне дослідження через 6 місяців. Journal of Periodontology, 80(12), 2056–2064. https://doi.org/10.1902/jop.2009.090252
- Мірон, Р. Дж., Пінто, Н. Р., Квірінен, М., & Ганааті, С. (2019). Стандартизація відносних центрифужних сил у дослідженнях, пов'язаних з тромбоцитарним багатим фібрином. Journal of Periodontology, 90(8), 817–820. https://doi.org/10.1002/JPER.18-0553
- Недір, Р., Бішоф, М., Вазкес, Л., Сзмуклер-Монклер, С.,& Бернар, Ж. П.(2006). Підняття рівня синуса без матеріалу для пересадки: 1-річне проспективне пілотне дослідження з імплантатами ITI. Clinical Oral Implants Research, 17(6), 679–686. https://doi.org/10.1111/j.1600-0501.2006.01264.x
- Недір, Р., Нурдін, Н., Вазкес, Л., Аби Найм, С., & Бішоф, М. (2016). Підняття рівня синуса без пересадки: 10-річне проспективне дослідження. Clinical Implant Dentistry and Related Research, 18(3), 609–617. https://doi.org/10.1111/cid.12331
- Нізам, Н., Ерен, Г., Аккалі, А., & Донос, Н. (2018). Підвищення рівня верхньощелепного синуса з тромбоцитарним багатим фібрином та депротейнізованим мінералом биків: гістологічне та гістоморфометричне дослідження з розділеними щелепами. Clinical Oral Implants Research, 29(1), 67–75. https://doi.org/10.1111/clr.13044
- Пальма, В. Ч., Магро-Фільо, О., де Олівейра, Дж. А., Лундгрен, С., Салата, Л. А., & Сеннербі, Л. (2006). Реформація кістки та інтеграція імплантів після підняття мембрани верхньощелепного синуса: експериментальне дослідження на приматах. Clinical Implant Dentistry and Related Research, 8(1), 11–24. https://doi.org/10.2310/j.6480.2005.00026.x
- Петерсон, Дж. Е., Зураковскі, Д., Італіано, Дж. Е. молодший, Мішель, Л. В., Фокс, Л., Клемент, Г. Л., & Фолкман, Дж. (2010). Нормальні діапазони регуляторних білків ангіогенезу в людських тромбоцитах. American Journal of Hematology, 85(7), 487–493. https://doi.org/10.1002/ajh.21732
- П'єтурссон, Б. Е., & Ланг, Н. П. (2014). Підняття рівня синуса з використанням трансальвеолярного підходу. Periodontology 2000, 66(1), 59–71. https://doi.org/10.1111/prd.12043
- Сон, Д. С., Лі, Дж. С., Аhn, М. Р., & Шин, Х. І. (2008). Нове утворення кістки в верхньощелепному синусі без пересадки кістки. Implant Dentistry, 17(3), 321–331. https://doi.org/10.1097/ID.0b013e318182f01b
- Сон, Д. С., Мун, Дж. В., Мун, К. Н., Чо, С. С., & Кан, П. С. (2010). Нове утворення кістки в верхньощелепному синусі з використанням лише абсорбуючого желатинового спонжа. Journal of Oral Maxillofacial Surgery, 68(6), 1327–1333. https://doi.org/10.1016/j.joms.2010.02.014
- Татум, Х. молодший (1986). Реконструкції імплантатів верхньої щелепи та синуса. Dental Clinics of North America, 30(2), 207–229.
- Уоллес, С. С., Тарнов, Д. П., Фрум, С. Дж., Чо, С. С., Заде, Х. Х., Ступель, Дж., … Тесторі, Т. (2012). Підняття верхньощелепного синуса за допомогою латерального вікна: еволюція технології та техніки. Journal of Evidence Based Dental Practice, 12(3), 161–171. https://doi.org/10.1016/S1532-3382(12)70030-1
- Вінтер, А. А., Поллак, А. С., & Одріч, Р. Б. (2003). Тентування синуса/альвеолярного гребеня (SACT): нова техніка для встановлення імплантатів в атрофічних верхньощелепних гребенях без пересадки кістки або мембран. International Journal of Periodontics Restorative Dentistry, 23(6), 557–565.
