Вплив одночасного імплантаційного розміщення та керованої реконструкції кістки з використанням ультратонких титанових мембран на радіографічні та клінічні параметри через 18 місяців навантаження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Передумови: Метою даного проспективного дослідження випадків було оцінити виживаність імплантів і протезів, ускладнення та втрату краєвого кісткового обсягу за допомогою ультратонкої титанової сітчастої мембрани з одночасним встановленням імплантів, щоб забезпечити підтримку простору, необхідну для керованої реконструкції кістки альвеолярного дефекту.
Матеріали та методи: пацієнти були залучені та лікувалися в приватній клініці в Римі, Італія, між березнем 2016 року та жовтнем 2017 року. Самонарізні конічні імпланти були встановлені за допомогою комп'ютерно-орієнтованого шаблону. Автогенна кістка була розміщена сама по собі на відкритій поверхні імпланта, а потім змішана з неорганічним бичачим кістковим матеріалом. Нарешті, мембрана була підключена та сформована для надійного закриття області трансплантату, а капсула загоєння була підключена та закріплена на висотному з'єднувачі. Критерії оцінки результатів: невдача імпланта та протеза, біологічні та механічні ускладнення, зміни краєвого та об'ємного рівня кістки, естетична оцінка, проведена відповідно до рожевої естетичної оцінки (PES).
Результати: всього сім пацієнтів (п’ять жінок, двоє чоловіків) зі середнім віком 52.7 ± 20.3 років (діапазон: 27–71) отримали 10 саморізних конічних імплантатів та одночасну спрямовану регенерацію кістки з використанням ультратонких титанових сіток. Протягом усього періоду спостереження не було зафіксовано жодного випадку відмови імплантатів та протезів. У одного пацієнта через місяць після встановлення імплантату спостерігалося незначне оголення мембрани. Середня втрата краєвої кістки (MBL) під час навантаження імплантату становила 0.13 ± 0.09 мм (95 % ДІ 0.08–0.19). На 18-місячному контрольному обстеженні середня MBL становила 0.28 ± 0.33 мм (95 % ДІ 0.07–0.50). Різниця не була статистично значущою (0.15 ± 0.31; 95% ДІ 0.05–0.35; P = 0.1888). Середня ширина горизонтального альвеолярного гребеня становила 3.72 ± 1.08 мм (95% ДІ 3.22–4.22 мм). Під час II-етапу хірургії середня ширина кістки становила 8.79 ± 0.98 мм (95% ДІ 8.51–9.07 мм). Середній приріст кістки становив 5.06 ± 1.13 мм (95% ДІ 4.68–5.44 мм; P = 0.000). Середній об’єм пересадженої кістки, розрахований за допомогою техніки накладення, становив 0.99 ± 0.38 CC (95% ДІ 0.75–1.23 CC). Середній PES під час навантаження імплантату становив 8.2 ± 0.8 мм (95 % ДІ 7.7–8.7). На 18-місячному контрольному обстеженні середній PES становив 12.0 ± 0.7 мм (95 % ДІ 11.5–12.5). Різниця була статистично значущою (3.8 ± 0.4; 95 % ДІ 3.5–4.1; P = 0.0000).
Висновок: з обмеженнями даного проспективного дослідження, керована реконструкція кістки з використанням ультратонкої титанової сітки з одночасним встановленням імплантату, здається, забезпечує хороші та стабільні результати в успіху імплантів/протезів. Необхідні подальші дослідження з тривалішим спостереженням та більшою вибіркою, щоб підтвердити результати з цього попереднього звіту.
Вступ
Атрофія альвеолярної кістки є хронічною та прогресуючою клінічною ситуацією, що характеризується помірною до важкої втратою об'єму кістки через втрату або видалення зубів. Крім того, місцеві умови або захворювання, такі як травматичне видалення, пародонтальна хвороба та травма, можуть посилити цю патологічну ситуацію, ускладнюючи або роблячи встановлення зубних імплантів важким або невигідним з функціональної та естетичної точки зору. Щоб подолати ці можливі недоліки, були введені техніки реконструкції кістки. Серед них, керована регенерація кістки (GBR) є хірургічною процедурою, яка використовує матеріал для пересадки як каркас, ізольований та захищений мембраною від неостеогенних клітин, що походять з сусідньої сполучної тканини. Таким чином, бар'єрний ефект мембрани має дозволити лише остеогенним клітинам, що походять з навколишньої кістки та судин, проникати в дефект кістки, що дозволяє формування кістки через наявність стимулюючих сигналів.
Як резорбовані, так і нерезорбовані мембрани використовувалися для ізоляції та підтримки правильного і запланованого біологічного каркасу, необхідного для формування нової кісткової тканини. Враховуючи природу їхньої функції, нерезорбована мембрана повинна бути більш передбачуваною та безпечною у використанні. Однак основним обмеженням є те, що необхідна додаткова хірургія для видалення мембрани. Тим не менш, керована реконструкція кістки зазвичай виконується в два етапи або за протоколом зануреного імплантату, коли вона виконується в один етап. Таким чином, мембрану можна видалити під час встановлення імплантату або на другому етапі, якщо GBR була виконана одночасно з імплантом.
У повсякденній практиці нерезорбовані мембрани з розширеного політетрафлуороетилену (e-PTFE) можуть вважатися першим вибором у реконструкціях горизонтальних і вертикальних кісткових дефектів. Тим не менш, з 1990-х років різні дослідники вивчали клінічне використання ультратонкої титанової сітки (Ti-сітки) для реконструкції атрофічної щелепи та верхньої щелепи. Титан є більш стійким до обвалення, ніж e-PTFE та резорбовані мембрани. Отже, жорсткість титану може працювати як каркас, підтримуючи простір, необхідний для регенерації кістки, навіть у випадках великого кісткового дефекту, такого як вертикальна реконструкція кістки.
Пористість титанових сіток може бути змінена для досягнення кращої інтеграції тканин та формування. Зміна пористості титанових сіток дозволяє рідині та поживним речовинам проходити через мембрану, уникаючи проникнення клітин.
Сьогодні запропоновані різні форми титанових мембран, щоб максимізувати формування нової кістки, стабілізувати матеріали трансплантату під мембраною та зменшити ризик експозиції мембрани, що може призвести до обвалення та/або проростання сусідньої м'якої тканини.
Метою даного проспективного дослідження серії випадків було оцінити виживаність імплантів та протезів, ускладнення, втрату краєвої кістки, використовуючи ультратонку титанову мембрану та одночасне встановлення імплантів, щоб забезпечити підтримку простору, необхідну для збільшення кістки при дефектах альвеолярної кістки. Це випробування відповідало положенням Зміцнення звітності спостережних досліджень в епідеміології (STROBE).
Матеріали та методи
Це дослідження було спроектовано як дослідження серії випадків для оцінки клінічних та рентгенографічних результатів одночасної направленої реконструкції кістки та встановлення імплантів з ультратонкою титановою мембраною. Пацієнти були залучені та лікувалися в приватній клініці в Римі, Італія, між березнем 2016 року та жовтнем 2017 року. Хірургічні процедури виконувалися експертним клініцистом (MT), сертифікованим у терапії на основі імплантів в Європейській асоціації остеоінтеграції у 2013 році. Всім пацієнтам було повідомлено про природу дослідження, і вони надали письмову згоду на хірургічні та протезні процедури, а також на використання рентгенологічних та клінічних даних для публікації. Принципи, закладені в Гельсінкській декларації 2013 року, були суворо дотримані. Крім того, рентгенологічний протокол був затверджений Науково-технічним та етичним комітетом Університету Сассарі (2069/CE).
Будь-які послідовні пацієнти віком 18 років або старше, які звернулися з частковою адентією верхньої або нижньої щелепи, здатні зрозуміти та підписати інформовану згоду, та які потребують відновлення на імплантатах, вважалися такими, що відповідають критеріям включення в це дослідження. Пацієнти були остаточно включені, якщо у них була атрофія залишкової альвеолярної гребені класу IV до VI за класифікацією Кавуда та Хоуела на обстеженні за допомогою комп'ютерної томографії конусного променя. Пацієнти були виключені, якщо у них були загальні протипоказання до імплантаційної хірургії (такі як опромінення області голови та шиї протягом попередніх п'яти років до імплантації або неконтрольований цукровий діабет); вагітність або лактація; зловживання наркотиками; психіатрична терапія або нереалістичні очікування; попереднє або поточне лікування внутрішньовенними біфосфонатами; нелікована пародонтит або погана гігієна порожнини рота (кровотеча при зондуванні та/або індекс нальоту ≥ 25%); важкі курці (≥11 сигарет на день); постекстракційні ділянки.
Перед імплантаційною хірургією було проведено сканування CBCT (CBCT, CRANEX 3D; Soredex, Tuusula, Фінляндія) та внутрішньоротовий цифровий відбиток (CS 3600 внутрішньоротовий сканер, Carestream Dental, Атланта, Джорджія, США). Сканування CBCT було налаштоване з полем зору 80 мм× 150 мм; розмір вокселя 0.3 мкм; 90 KV; 6.3–10 мА протягом 4.5 с, що призвело до дози-обсягу продукту 579.7–920.2 (мГрсм2). Дані STL та DICOM (Цифрова візуалізація та зв'язок у медицині) були імпортовані в спеціалізоване програмне забезпечення для діагностики та планування імплантації (3Diagnosys версія 4.2, 3DIEMME srl, Кантù, Італія). Після цього імплантати, орієнтовані на протезування, були віртуально сплановані.
За годину до операції профілактично було введено одноразову дозу антибіотиків (2 г амоксициліну та клавуланової кислоти або 600 мг кліндаміцину у разі алергії на пеніцилін). Перед операцією було проведено полоскання рота 0,2% розчином хлоргексидину диглюконату протягом двох хвилин.
Усі пацієнти були лікувані під оральною седативною терапією з діазепамом 10 мг (Валліум, Roche S.p.A., Монца, Італія). Було проведено місцеву анестезію з використанням артикаїну з адреналіном 1:100 000. Середньокресельний розріз був зроблений у кератинізованій тканині за допомогою хірургічного скальпеля леза № 15C. Повнотовстий клапоть був піднятий за межі мукогінгівального з'єднання. Потім було зроблено два вертикальні розрізи на відстані одного зуба від кісткового дефекту або принаймні 5 мм у випадку беззубої ділянки. Потім місце отримання було очищено шляхом видалення всіх залишків м'яких тканин. Саморізний конусний імплант TSIII (Osstem Implant, Сеул, Корея) був встановлений за допомогою комп'ютерно-орієнтованого шаблонного підходу на рівні кістки або на 1 мм глибше, відповідно до протоколу свердління, запропонованого виробником. Усі хірургічні шаблони підтримувалися зубами і були виготовлені без металевих рукавів. Основною характеристикою мембрани OssBuilder є те, що вона фіксується безпосередньо до імпланта в одностадійному підході. Щоб закріпити мембрану на імпланті, необхідно використовувати спеціальний інструмент під назвою висотний з'єднувач (Osstem Implant). Цей інструмент доступний у різних висотах для з'єднання мембрани з імплантом на різному рівні в залежності від залишкової кістки та глибини імпланта. Використовуючи шестигранний драйвер 1.2, висотний з'єднувач був закручений у фіксатор з моментом 5 до 8 Н·см. Потім аутогенна кістка була отримана з сусідньої ділянки, використовуючи мінімально інвазивний колектор кортикальної кістки (Micross, Meta, Італія). Кістка була отримана в ділянці мезіально або дистально близько до дефекту. Після цього кістковий дефект був виміряний для визначення відповідної форми та розміру титанової сіткової мембрани (OssBuilder, Osstem Implant). Усі використані мембрани були з чистого титану 2-го класу і мали пори діаметром від 0,6 до 1 мм.
Автогенна кістка була розміщена самостійно на відкритій поверхні імплантату. Потім другий шар, що складається з автогенної кістки, змішаної з неорганічним матеріалом з коров'ячої кістки (Bio-OSS, Geistlich Biomaterials Italia S.r.l.) у співвідношенні 1:1, був використаний для заповнення залишкового дефекту. Кістковий графт був надмірно контурований, щоб компенсувати остаточну резорбцію графту. Нарешті, мембрана була підключена до висотного з'єднувача і сформована так, щоб надійно закрити область графту, а загоювальна кришка була підключена і закручена на висотний з'єднувач за допомогою драйвера кришки з моментом 5 до 8 Н·см. Було зроблено періостальне розріз, щоб дозволити пасивну, безнапружену адаптацію та закриття клаптя. Рана була зашита в два шари за допомогою шва 4-0 поліглактину 910 (Vicryl V271; Ethicon, West Somerville, NJ, USA) (Рисунки 1–3). Антибіотикотерапія була призначена на сім днів (1 г амоксициліну та клавуланової кислоти або 300 мг кліндаміцину двічі на день) після операції. Було призначено полоскання рота 0,2% хлоргексидину диглюконату протягом однієї хвилини, двічі на день, протягом трьох тижнів, і рекомендована м'яка дієта на чотири тижні. Ібупрофен 400 мг (або парацетамол 1 г) слід приймати у разі болю.
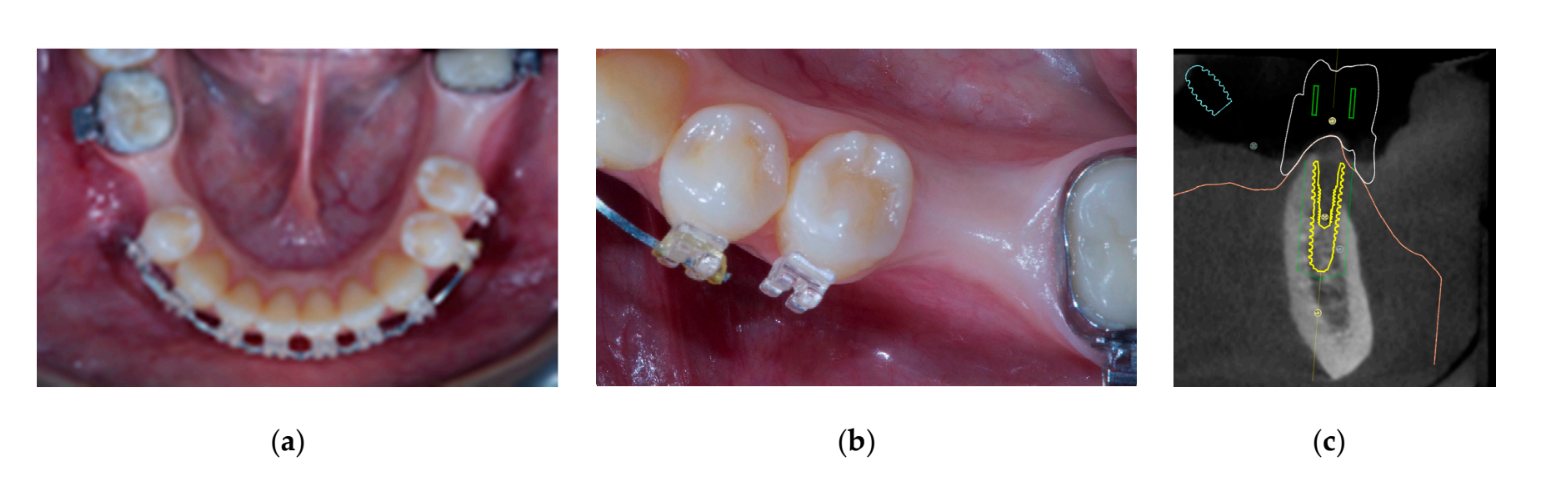
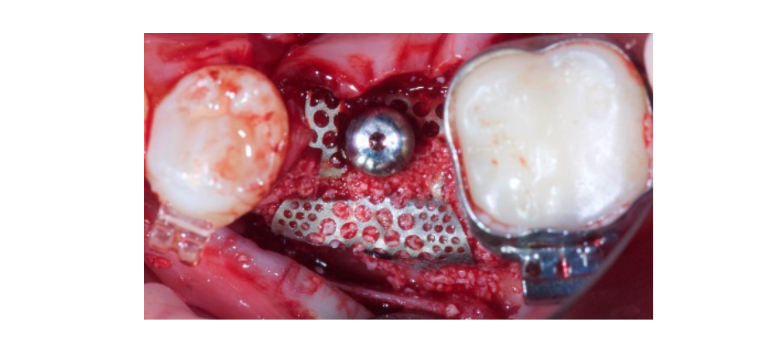
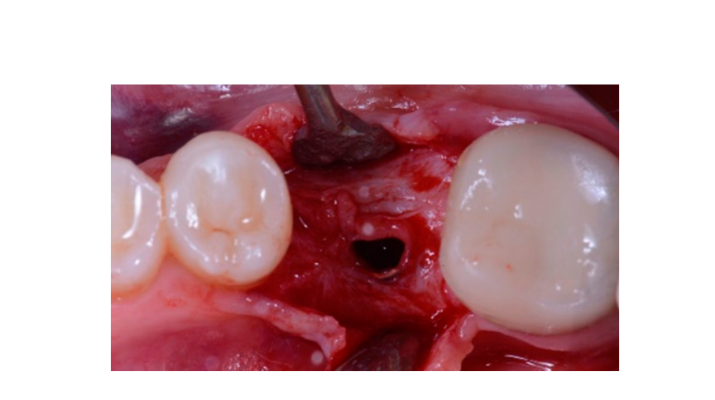
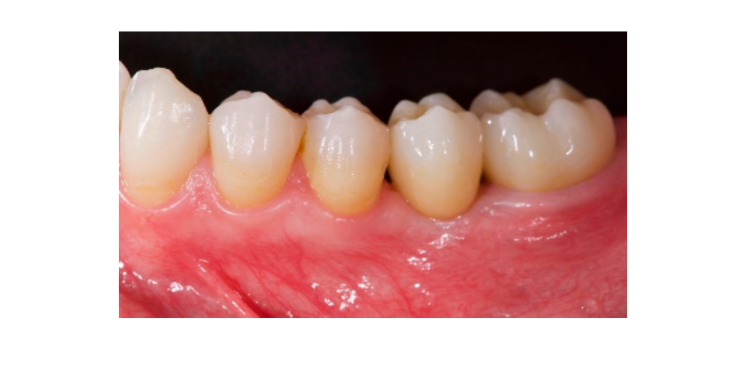
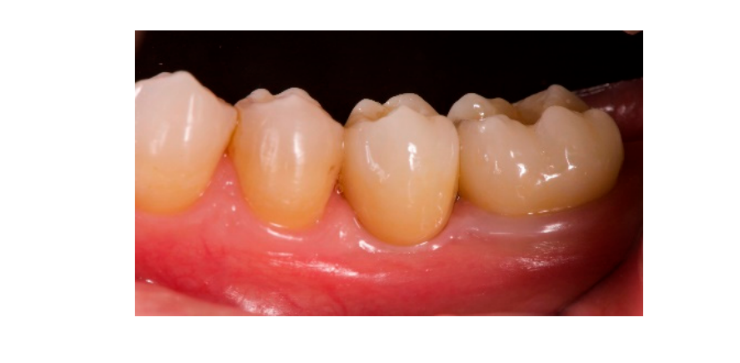
Сім-вісім місяців після встановлення імплантату пацієнт пройшов повторне КТ-сканування для оцінки реконструкції кістки. КТ-сканування було налаштоване з полем зору 60 мм × 80 мм; розмір вокселя 0.3 мкм; 90 кВ; 4–6.3 мА протягом 2.3 с, що призвело до дози-області продукту 192.4–307.8 (мГрсм2). Потім була проведена хірургічна процедура другого етапу, при цьому було забезпечено збереження кератинізованої тканини навколо зубного імплантату. Ультратонка титансова сітка була обережно видалена, і на фіксатор був закручений абатмент для загоєння (Рисунок 4). Потім мембрана, багата тромбоцитами (PRF), була адаптована над реконструйованою кісткою, і клапоть був витягнутий коронально та зашитий. Через два тижні була надана тимчасова реставрація. Через три-чотири місяці була доставлена реставрація з цирконію, закріплена гвинтом CAD/CAM (Рисунки 5 і 6). Оклюзія була відрегульована, щоб уникнути передчасних контактів. Були зроблені періапікальні рентгенограми та клінічні фотографії. Візити для спостереження планувалися кожні три місяці після встановлення імплантату (Рисунки 7 і 8).
Включені показники результатів:
- Коефіцієнт виживання імплантів: імплант вважався невдалим, якщо він мав будь-яку рухливість, перелом імпланта або інфекцію, що вимагала видалення імпланта.
- Відновлення вважалося невдалим, якщо його потрібно було замінити альтернативним відновленням.
- Наявність біологічних (біль, набряк, гній, тощо) або механічних (ослаблення гвинта або перелом каркаса і/або матеріалу облицювання, тощо) ускладнень.
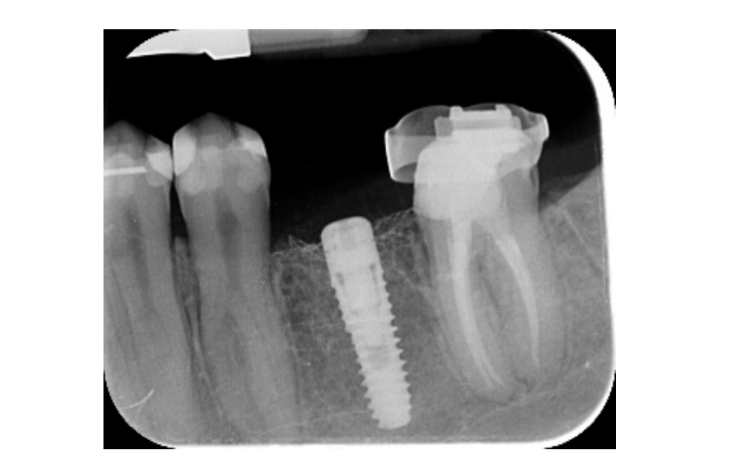
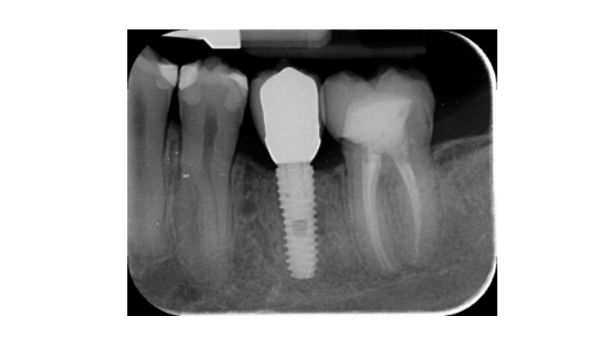
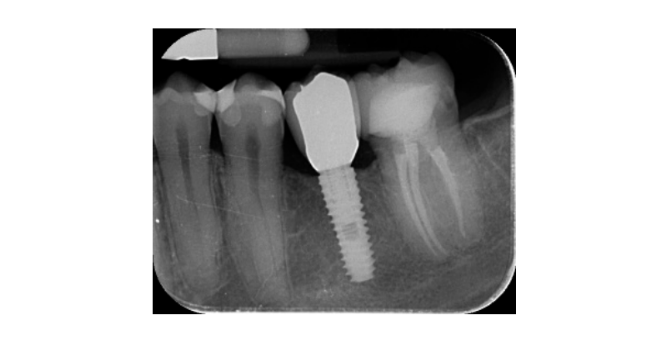
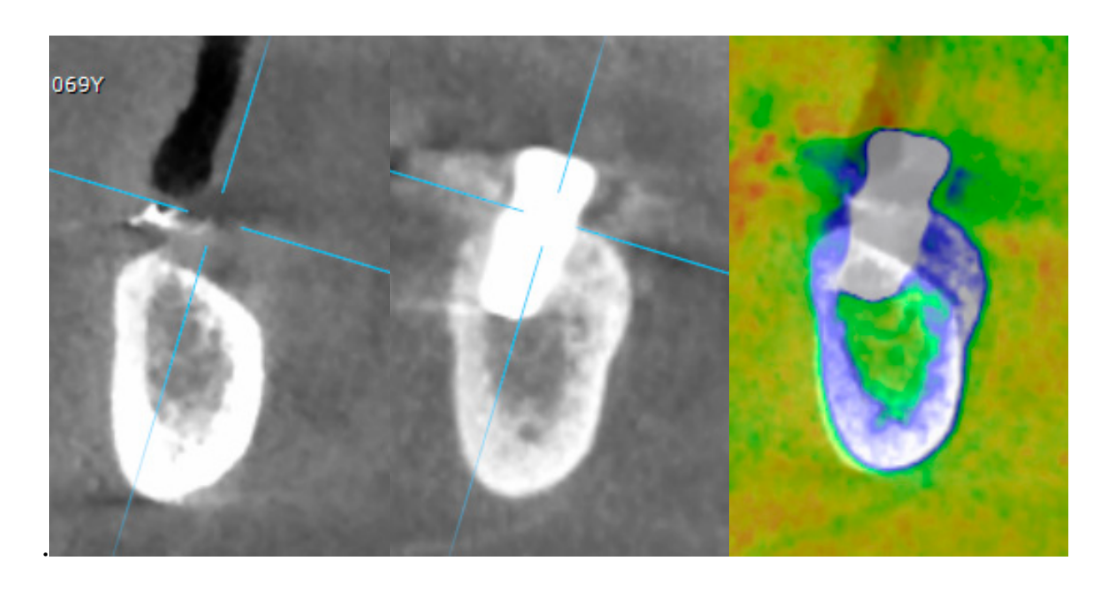
- Зміни рівня краєвого кістки оцінювалися за допомогою цифрових періапікальних рентгенограм (Digora Optime; Soredex, Tuusula, Фінляндія) з використанням паралельної техніки та комерційно доступних тримачів для плівки. Оцінювалися три часові точки: під час встановлення імпланта (базовий рівень), відразу після вставки відновлення та через рік після навантаження. Середні мезіальні та дистальні відстані від найбільш коронального краю імпланта до першого контакту кістки з імплантом вимірювалися до найближчих 0,01 мм і бралися за рівень краєвого кістки. Різниця в рівнях між часовими точками бралася за втрату краєвого кістки (MBL).
- Горизонтальне збільшення кістки оцінювалося на сканах CBCT, на 1 мм нижче оригінального кісткового гребеня. Об'ємні дані накладалися з використанням сусідніх зубів як контрольних точок, і новий набір даних DICOM зберігався як окремі файли. Вимірювання проводилися до і після лікування, а різниця між цими двома вимірюваннями бралася за горизонтальне збільшення кістки (Рисунок 9).
- Об'ємні вимірювання реконструйованої кістки виконувалися автоматично на об'єднаному наборі об'ємних даних CBCT, використовуючи модуль Fusion програмного забезпечення OnDemand 3D (Cybermed Inc., Сеул, Корея), відповідно до раніше опублікованого протоколу [8].
- Естетична оцінка проводилася відповідно до рожевого естетичного балу (PES) на вестибулярних та оклюзійних знімках, на яких було знято щонайменше один сусідній зуб з кожного боку. Значення оцінювалися через 6 і 12 місяців після навантаження (спостереження через 18 місяців). Сім змінних (мезіальна папіла, дистальна папіла, рівень м'яких тканин, контур м'яких тканин, дефіцит альвеолярного процесу, колір і текстура м'яких тканин) оцінювалися за шкалою 2-1-0 (2 - найкращий, 0 - найгірший) тим самим сліпим стоматологом.
Хірургічні ставки імплантації та протезування, а також ускладнення оцінювалися тими ж клініцистами, які виконали всі випадки (MT). Втрата краєвого кісткового обсягу та оцінка естетики рожевого кольору оцінювалися будь-яким незалежним оцінювачем, який раніше не брав участі в дослідженні (MM). Описовий аналіз був проведений для середнього значення ± стандартного відхилення (SD), медіани та 95% довірчого інтервалу (CI) за допомогою Numbers (Версія 5.2) для Mac OS High Sierra 10.X. Порівняння між контрольними точками проводилися за допомогою парного t-тесту Ст'юдента з використанням SPSS (Версія 22.0; IBM Corporation, Армонк, NY, США) для Mac OS High Sierra 10.X. Усі статистичні порівняння проводилися на рівні значущості 0.05. Статистичною одиницею був імплантат.
Результати
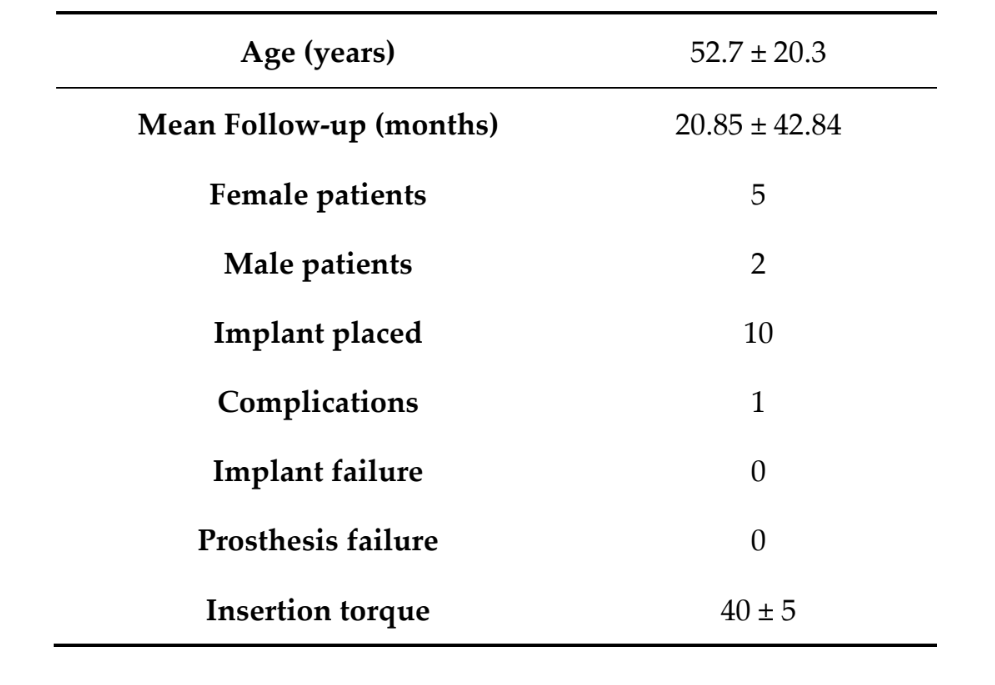
Всього сім пацієнтів (п’ять жінок, двоє чоловіків) зі середнім віком 52.7 ± 20.3 років (діапазон: 27–71) отримали 10 самонарізних конічних імплантатів TSIII (Osstem Implant) та одночасну керовану регенерацію кістки з використанням ультратонких титанових сіток (OssBuilder; Osstem Implant). Через 18 місяців після навантаження жоден з пацієнтів не вибув, і жодних відхилень від початкового протоколу не сталося. Середній час спостереження становив 20.85 ± 42.84 місяців після встановлення імплантатів (діапазон: 18–24 місяці). Усі імплантати були встановлені з крутними моментами між 35 і 45 N·cm за допомогою комп’ютеризованого, шаблонно-орієнтованого підходу (Таблиця 1).
Протягом періоду спостереження не було зафіксовано жодного випадку відмови імплантів або протезів. У одного пацієнта через місяць після встановлення імпланта було зафіксовано незначне оголення мембрани. Пацієнтам було рекомендовано обережно чистити мембрану м'якою зубною щіткою та застосовувати спрей з хлоргексидином двічі на день. Повне загоєння м'яких тканин було зафіксовано через чотири тижні.
Усі імпланти були встановлені на рівні кістки або на 1 мм глибше. Середня втрата краєвої кістки під час навантаження імпланта становила 0.13 ± 0.09 мм (95% ДІ 0.08–0.19). Під час обстеження через 18 місяців середня втрата краєвої кістки становила 0.28 ± 0.33 мм (95% ДІ 0.07–0.50). Різниця не була статистично значущою (0.15 ± 0.31; 95% ДІ 0.05–0.35; P = 0.1888) (Таблиця 2).

Середня горизонтальна ширина альвеолярного гребеня становила 3.72 ± 1.08 мм (95% ДІ 3.22–4.22 мм). На II-му етапі хірургії середня ширина кістки становила 8.79 ± 0.98 мм (95% ДІ 8.51–9.07 мм). Середнє збільшення об'єму кістки становило 5.06 ± 1.13 мм (95% ДІ 4.68–5.44 мм; P = 0.000). Середній об'єм пересадженої кістки, розрахований за допомогою техніки накладення, становив 0.99 ± 0.38 CC (95% ДІ 0.75–1.23 CC).
Середній PES при навантаженні імплантату становив 8.2 ± 0.8 мм (95% ДІ 7.7–8.7). На 18-місячному контрольному обстеженні середній PES становив 12.0 ± 0.7 мм (95% ДІ 11.5–12.5). Різниця була статистично значущою (3.8 ± 0.4; 95% ДІ 3.5–4.1; P = 0.0000) (Таблиця 2).
Обговорення
Дане дослідження було проведено для оцінки клінічних та радіологічних даних, через рік після навантаження, при керованій регенерації кістки з використанням ультратонкої титанової сітки з одночасним встановленням імплантату, щоб забезпечити ефект каркаса (підтримка простору), необхідний для відновлення кістки при дефектах кістки на гребені. Оскільки це дослідження було спроектовано як проспективне дослідження серії випадків, його основним обмеженням є відсутність контрольної групи. Головним обмеженням даного дослідження був малий розмір вибірки. Проте, це дослідження було спроектовано як проспективне дослідження серії випадків. Це обмеження можна вирішити, провівши подальші випробування з більшими розмірами вибірки, які можна було б розрахувати на основі попередніх результатів даного дослідження. Іншим обмеженням цього дослідження, яке могло б бути фактором, що спотворює результати, було те, що біотип ясен не був врахований. Проте, результати даного дослідження були узгоджені з раніше опублікованими звітами. Насправді, кілька дослідників підтвердили ідеальні механічні властивості титанової сітки з точки зору жорсткості, пластичності та еластичності. Крім того, титанові сітки, здається, менш сприйнятливі до бактеріального забруднення в порівнянні з резорбованими матеріалами. Щоб підкреслити цю концепцію, автори спостерігали лише одне незначне виступання мембрани через місяць після встановлення імплантату. Пацієнтам було рекомендовано обережно чистити мембрану м'якою зубною щіткою та застосовувати спрей хлоргексидину двічі на день. Повне загоєння м'яких тканин було зафіксовано через чотири тижні. Ця незначна ускладненість свідчить про ефективність цієї титанової сітки. Крім того, в цьому проспективному дослідженні жоден імплантат і жодна протеза не зазнали невдачі протягом періоду спостереження. Завдяки цим даним можна вважати цю процедуру безпечною та легкою для клініциста. Кілька характеристик бар'єрних мембран необхідні для успішної керованої регенерації кістки, такі як клінічна керованість, біосумісність, здатність до створення простору, виключення клітин та інтеграція тканин. Титанові сітки є нерезорбованими мембранами, і їх пористість може варіюватися для досягнення сумісності з тканиною. У даному дослідженні використовувалася ультратонка мембрана з чистого титану 2-го класу. Товщина титанової сітки становила 100 мкм, тоді як пористість була від 0.6 до 1 мм в діаметрі. Пори діаметром 1 мм можуть забезпечити оптимальне кровопостачання та дифузію факторів росту, необхідних для сприяння загоєнню та регенерації кістки. Проте, пори діаметром 0.6 мм можуть запобігти зміщенню або міграції матеріалу для пересадки кістки, дозволяючи при цьому дифузію кровопостачання. Крім того, ці мембрани мали деякі бічні перфорації, які повинні були зберігати високу механічну міцність, одночасно дозволяючи гнучкість для формування та модифікації.
Проте, експозиція мембрани та інфекція є відносно поширеними. На відміну від мембрани PTFE, яка є відносно товстою, приблизно 200 мкм, і схильною до бактеріального захоплення через свою пористу структуру, титанові мембрани можуть бути виготовлені в тоншій формі.
Нещодавно виявлено, що ультратонкі поверхневі візерунки, пов'язані з порами, каналами та іншими особливостями в біоскелетах, впливають на міграцію, проліферацію та диференціацію клітин. Таким чином, технологія лазерної обробки є сприятливою для створення різноманітних ультратонких поверхневих візерунків.
Щоб досягти хорошого та передбачуваного відновлення кістки, кістковий графт повинен включати три характеристики:
(1) Клітини остеобластів або мезенхімальні стовбурові клітини; (2) Фактори росту, щоб забезпечити прогрес відновлення; та (3) «Скелет», здатний забезпечити механічну підтримку для прикріплення та проліферації клітин.
Автори висунули гіпотезу, що ця ультратонка структура, використана в цьому перспективному дослідженні, дозволяє мінімізувати проростання м'яких тканин у мікроперфорації та зберігає проникність поживних речовин або тканинної рідини через мембрану, що сприяє прикріпленню, міграції та проліферації клітин, отриманих з кісткового мозку, що призводить до більшого відновлення кістки.
Протягом останнього десятиліття тривалі дослідження оцінювали та підкреслювали, що GBR є успішною та передбачуваною технікою для клініциста, щоб отримати вертикальне та горизонтальне збільшення гребеня. GBR можна досягти двома різними підходами: застосуванням або політетрафторетиленової (PTFE) титанової армованої мембрани (тобто, не резорбованої мембрани) та ультратонкої титанової сітки або колагенової мембрани (тобто, резорбованої мембрани). Імплантати були встановлені за допомогою комп'ютерно-орієнтованого шаблону, на рівні кістки або на 1 мм глибше, відповідно до протоколу свердління, запропонованого виробником. На нашу думку, цей керований підхід дозволяє краще встановлювати імплант, орієнтуючись на протезування, і дозволяє регенерацію кістки відповідно до необхідного протезу.
Результати даного дослідження узгоджуються з нещодавньою літературою, опублікованою про імпланти, встановлені після або під час процедури GBR.
Висновки
З обмеженнями даного перспективного дослідження, керована реконструкція кістки з використанням ультратонкої титанової сіткової мембрани з одночасним встановленням імпланта, щоб забезпечити підтримку простору, необхідну для збільшення кістки альвеолярних дефектів, здається, забезпечує успіх імпланта/протезу. Потрібні подальші дослідження з більшою вибіркою та тривалішим спостереженням, щоб підтвердити ці попередні результати.
Марко Талларіко, Франческо Маттіа Черузо, Леонардо Музі, Сільвіо Маріо Мелоні, Йонг-Джин Кім, Марко Гаргарі та Маттео Мартінолі
Посилання
- Атвуд, Д.А. Зменшення залишкових гребенів: основна оральна хвороба. J. Prosthet. Dent. 1971, 26, 266–279.
- Чіапаско, М.; Касентіні, П.; Занібоні, М. Процедури збільшення кістки в імплантології. Int. J. Oral Implant. 2009, 24, 237–259.
- Рахматія, Й.Д.; Джінно, Й.; Фурухаші, А.; Кояно, К.; Аюкава, Й. Аналіз мікрокомп'ютерної томографії раннього етапу загоєння кістки з використанням мікропористої титанової сітки для направленої регенерації кістки: попередній експеримент на собачій моделі. Odontology 2017, 8, 25–417.
- Мелоні, С.М.; Йованович, С.А.; Пізано, М.; Де Ріу, Г.; Бальдоні, Е.; Талларіко, М. Одноетапна горизонтальна направлена регенерація кістки з автологічною кісткою, неорганічною бичачою кісткою та колагеновими мембранами: спостереження за перспективним дослідженням через 30 місяців після навантаження. Eur. J. Oral Implantol. 2018, 11, 89–95.
- Беккер, В.; Беккер, Б.; Меллоніг, Дж. Перспективне багатопрофільне дослідження, що оцінює регенерацію пародонту при класі II вторинних вторгнень і інфрабонних дефектах після лікування з використанням біорозчинної бар'єрної мембрани: результати через 1 рік. J. Periodontol. 1996, 67, 641–649.
- Цитцманн, Н.У.; Наеф, Р.; Шарер, П. Розчинні та нерозчинні мембрани в поєднанні з Bio-Oss для направленої регенерації кістки. Int. J. Oral Maxillofac. Implants 1997, 12, 844–852.
- Мерлі, М.; Москателлі, М.; Маріотті, Г.; Ротундо, Р.; Бернарделлі, Ф.; Ньєрі, М. Зміна рівня кістки після вертикального збільшення гребеня: розчинні бар'єри проти титанових бар'єрів. 6-річне подвійне сліпе рандомізоване клінічне дослідження. Int. J. Oral Maxillofac. Implants 2014, 29, 905–913.
- Мелоні, С.М.; Йованович, С.А.; Урбан, І.; Канулло, Л.; Пізано, М.; Талларіко, М. Горизонтальне збільшення гребеня з використанням GBR з натуральною колагеновою мембраною та співвідношенням 1:1 частикованого ксенографту та автологічної кістки: 1-річне перспективне клінічне дослідження. Clin. Implant Dent. Relat. Res. 2017, 19, 38–45.
- Соттосанті, Дж.С. Сульфат кальцію: цінне доповнення до комплексу імплантації/регенерації кістки. Dent. Implant. Updat. 1997, 8, 25–29.
- Роккуццо, М.; Рамієрі, Г.; Спада, М.Ц.; Б'янкі, С.Д.; Берроне, С. Вертикальне збільшення альвеолярного гребеня за допомогою титанової сітки та аутогенних кісткових трансплантатів. Clin. Oral Implant. 2004, 15, 73–81.
- Рахматія, Й.Д.; Аюкава, Й.; Фурухаші, А.; Кояно, К. Сучасні бар'єрні мембрани: титанові сітки та інші мембрани для направленої регенерації кістки в стоматологічних застосуваннях. J. Prosthodont. 2013, 57, 3–14.
- Талларіко, М.; Мартінолі, М.; Кім, Й.; Коккі, Ф.; Мелоні, С.М.; Алуші, А.; Ханарі, Е. Точність комп'ютерно-асистованого імплантаційного розміщення з використанням двох різних хірургічних шаблонів, розроблених з металевими рукавами або без них: рандомізоване контрольоване дослідження. Dent. J. 2019, 7, 41.
- Талларіко, М.; Кім, Й.Й.; Коккі, Ф.; Мартінолі, М.; Мелоні, С.М. Точність нових шаблонів з рукавами для вставки стоматологічних імплантатів: перспективне багатопрофільне клінічне дослідження. Clin. Implant Dent. Relat. Res. 2019, 21, 108–113.
- Фюрхаузер, Р.; Флореску, Д.; Бенеш, Т.; Хаас, Р.; Майлат, Г.; Ватзек, Г. Оцінка м'яких тканин навколо одиночних імплантатів: рожевий естетичний бал. Clin. Oral Implant. 2005, 16, 639–644.
- Чіокка, Л.; Лізіо, Г.; Бальдісара, П.; Самбуко, А.; Скотті, Р.; Корінадесі, Г. Протезування CAD-CAM – направлене збільшення кістки атрофічних щелеп з використанням індивідуальної титанової сітки: попередні результати відкритого перспективного дослідження. J. Oral Implant. 2018, 44, 131–137.
- Шоппер, К.Х.; Горівода, В.; Мозер, Д. Довгострокові результати після направленої регенерації кістки з розчинними та мікропористими титановими мембранами. J. Oral Maxillofac. Surg. Clin. North Am. 2001, 13, 449–458.
- Скантлебурі, Т.В. 1982-1992: десятиліття розвитку технологій для направленої регенерації тканин. J. Periodontol. 1993, 64, 1129–1137.
- A Фугаццотто, П. Рівні успіху та невдачі оссеоінтегрованих імплантатів у функції в регенерованій кістці протягом 72 до 133 місяців. Int. J. Oral Implant. 2005, 20, 77–83.
- Кім, Й.-К.; Юн, П.-Й.; Кім, С.-Г.; О, Д.С. Порівняння внутрішньої поверхні відкритих та закритих нерозчинних мембран за допомогою скануючої електронної мікроскопії. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2009, 107, e5–e11.
- Ватцингер, Ф.; Люкш, Й.; Мілесі, В.; Шоппер, К.; Нойгебауер, Й.; Мозер, Д.; Еверс, Р. Направлена регенерація кістки з титановими мембранами: клінічне дослідження. Br. J. Oral Surg. 2000, 38, 312–315.
- Селвіг, К.А.; Керстен, Б.Г.; Чемберлейн, А.Д.Х.; Вікесйо, У.М.Е.; Нілвус, Р.Е. Регенеративна хірургія внутрішньокісткових пародонтальних дефектів з використанням мембран ePTFE: скануюча електронна мікроскопічна оцінка вилучених мембран проти клінічного загоєння. J. Periodontol. 1992, 63, 974–978.
- Хасегава, Х.; Масуї, С.; Ісіхата, Х.; Канеко, Т.; Ішіда, Д.; Ендо, М.; Канно, С.; Ямазаки, М.; Кітабатаке, Т.; Уцуномія, С.; та ін. Оцінка нової розробленої мікроперфорованої чистої титанової мембрани для направленої регенерації кістки. Int. J. Oral Maxillofac. Implants 2019, 34, 411–422.
- Робертс, Е.В.; Е Сіммонс, К.; Гаретто, Л.П.; А ДеКастро, Р. Фізіологія та метаболізм кістки в стоматологічній імплантології: фактори ризику остеопорозу та інших метаболічних захворювань кістки. Implant. Dent. 1992, 1, 11–21.
- Вессінг, Б.; Урбан, І.; Монтера, Е.; Цехнер, В.; Хоф, М.; Чаморро, Дж.А.; Мартін Н.А.; Поліцці, Г.; Мелоні, С.; Санс, М. Багатопрофільне рандомізоване контрольоване клінічне дослідження з використанням нової розчинної не перехресно-зв'язаної колагенової мембрани для направленої регенерації кістки на деhisced одиничних імплантаційних ділянках: проміжні результати процедури збільшення кістки. Clin. Oral Implants Res. 2017, 28, e218–e226, doi: 10.1111/clr.12995.
- Урбан, І.; Вессінг, Б.; Аландец, Н.; Мелоні, С.; Гонсалес-Мартін, О.; Поліцці, Г.; Санс-Санчез, І.; Монтера, Е.; Цехнер, В. Багатопрофільне рандомізоване контрольоване дослідження з використанням нової колагенової мембрани для направленої регенерації кістки на деhisced одиничних імплантаційних ділянках: результати при протезуванні та через 1 рік спостереження. Clin. Oral Implants Res. 2019, doi: 10.1111/clr.13426.