Виправлення дефекту букової кістки навколо імплантату після субперіостальної техніки збільшення з використанням блоку або часткового ксенографту: ретроспективне дослідження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Оцінити ефективність техніки субперіостального пері-імплантного підсиленого шару (SPAL), виконаної з використанням депротенізованого мінералу кістки великої рогатої худоби (DBBM), який доставлявся у вигляді частинок (pDBBM) або блоку (bDBBM), для корекції кісткової дегісценції навколо імплантату (PIBD). Також були досліджені імплантати з товстою (≥ 2 мм) буковою кістковою платівкою навколо імплантату (PBBP) під час встановлення.
Матеріали та методи: Пацієнти з PIBD ≥ 1 мм, які лікувалися за допомогою SPAL з використанням або pDBBM (SPALчастинковий) або bDBBM (SPALблок), а також пацієнти з імплантом, що показував PBBP ≥ 2 мм під час вставлення (КОНТРОЛЬ), були включені в дослідження. Повторний вхід був виконаний або через 6 місяців (групи SPAL), або через 3 місяці (КОНТРОЛЬ). Основним результатом була частота пацієнтів, у яких не було PIBD під час повторного входу. Висота кісткової дегісценції (BDH) і ширина (BDW), товщина букових тканин (BTT) та рівень маргінальної кістки (MBL) були вторинними результатами.
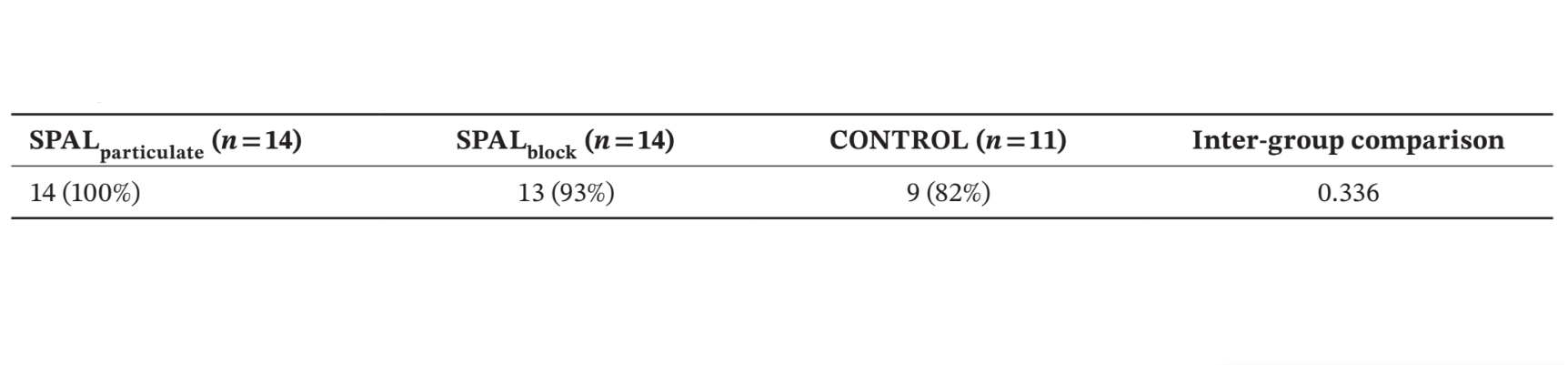
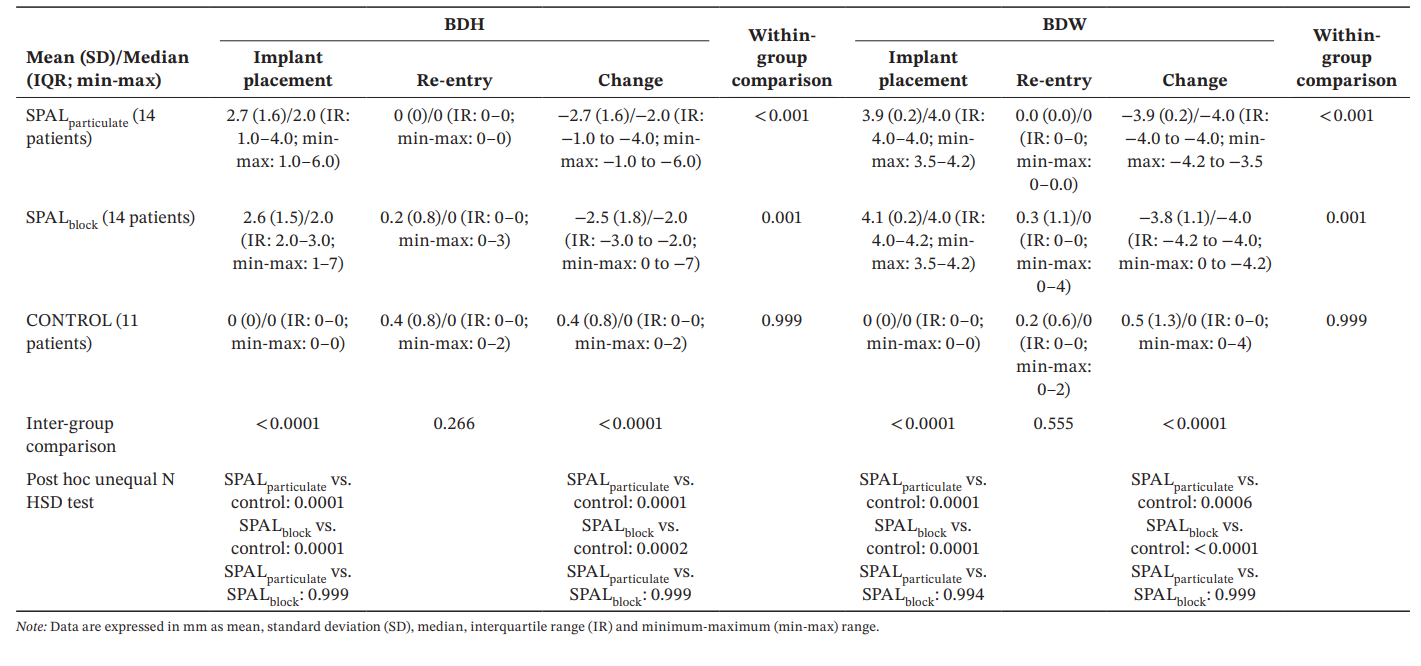
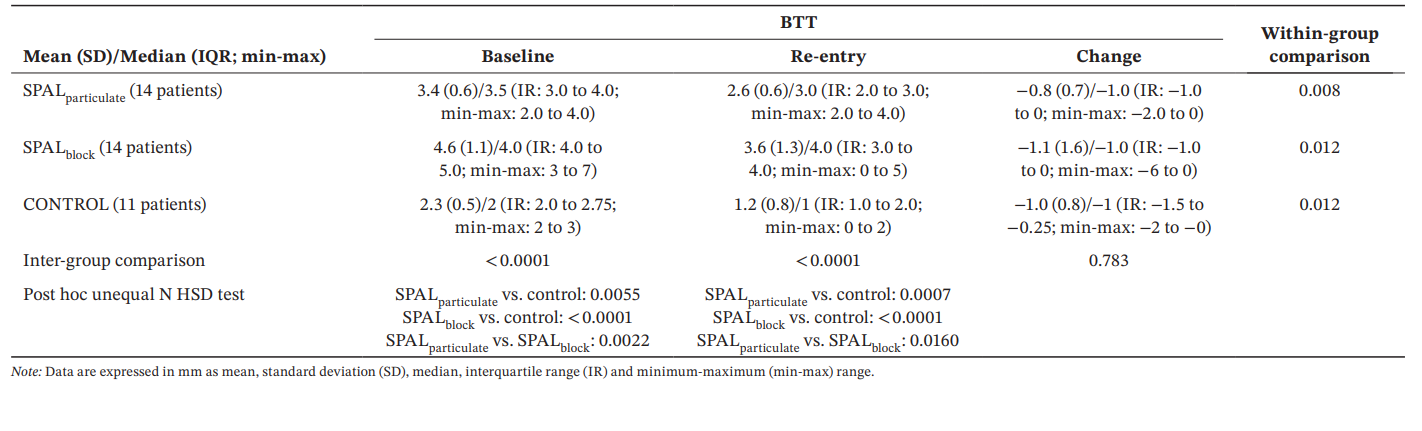
Результати: Тридцять дев'ять імплантатів у 39 пацієнтів (14 у SPALчастинковий, 14 у SPALблок і 11 у КОНТРОЛІ) були проаналізовані. PIBD не було виявлено у SPALчастинковий, тоді як у SPALблок був присутній один PIBD. Два пацієнти в КОНТРОЛІ мали PIBD. Спостерігалося зменшення як BDH, так і BDW як у SPALчастинковий (2.7 ± 1.6 мм для BDH і 3.9 ± 0.2 мм для BDW), так і у SPALблок (2.5 ± 1.8 мм для BDH і 3.8 ± 1.1 мм для BDW). SPALблок показав вищу BTT, ніж SPALчастинковий під час повторного входу (3.6 ± 1.3 мм для SPALблок і 2.6 ± 0.6 мм для SPALчастинковий, p = 0.0160). Усі групи показали подібний MBL.
Вступ
Протезно-орієнтоване розміщення імплантатів у зменшеній горизонтальній кістковій площі часто призводить до декомпенсації кістки навколо імплантату (PIBD) (Bressan et al. 2017; Pramstraller et al. 2018).
Малі дефекти кісткової декомпенсації, залишені для спонтанного загоєння, виявили більше вертикальної втрати кістки на щічній стороні після встановлення імплантату, а також більше маргінальної втрати кістки в порівнянні з ділянками, які лікувалися за допомогою GBR (Jung et al. 2017; Monje et al. 2023). Хоча імплантати з малими, неконтейованими щічними кістковими декомпенсаціями демонстрували високі показники виживання імплантатів та здорові тканини навколо імплантату через 7,5 років спостереження (Waller et al. 2020), наявність явної PIBD була пов'язана з вищою частотою мукозиту та періімплантиту, а також швидшою прогресією періімплантиту в порівнянні з імплантатами, які повністю оточені кісткою (Schwarz, Sahm, and Becker 2012; Monje et al. 2019). Незважаючи на те, що прогностична цінність PIBD для довгострокового здоров'я тканин навколо імплантату залишається суперечливою, нещодавно було рекомендовано коригувати щічну кісткову декомпенсацію під час встановлення імплантату, щоб сприяти стабільності та здоровим умовам тканин навколо імплантату з часом (Herrera, et al. 2023; Monje et al. 2023; Song et al. 2024).
Для лікування PIBD були запропоновані процедури збільшення кістки або м'яких тканин. Обидва методи продемонстрували стабільні клінічні та рентгенографічні результати в середньостроковій та довгостроковій перспективі (Jensen et al. 2023; Monje et al. 2023). Серед різних процедур латерального збільшення кістки під час одночасного встановлення імплантату, методи Guided Bone Regeneration (GBR) та Sub-periosteal Peri-implant Augmented Layer technique (SPAL, Trombelli et al. 2018) були пов'язані з високою ймовірністю повного виправлення PIBD (Severi et al. 2022). Зокрема, SPAL базується на використанні періосту пацієнта як бар'єрної мембрани для утримання трансплантату, що діє як каркас для створення простору. Коли SPAL виконували в поєднанні з частинковим трансплантатом мінералу кістки великої рогатої худоби без білка (DBBM), було показано, що SPAL ефективно виправляє до 90,9% PIBD (Trombelli et al. 2019, 2020). Нещодавнє ретроспективне дослідження порівняло умови жорстких і м'яких тканин навколо імплантатів, які мали або PIBD, лікуваний SPAL, або товстий (≥ 2 мм) PBBP під час встановлення імплантату (Trombelli et al. 2020). Хоча в обох групах були виявлені подібні здорові умови пері-імплантних тканин, у групі SPAL було виявлено більш апікальне положення рентгенографічного рівня краю кістки (MBL), що свідчить про інший патерн ремоделювання трансплантату в порівнянні з рідною кісткою (Trombelli et al. 2020). Ці результати можуть поставити під сумнів значення фізико-хімічних характеристик трансплантату щодо стабільності реконструктивного результату після SPAL. У цьому контексті анекдотичний звіт вказав на те, що використання блоку DBBM (bDBBM) може бути успішною альтернативою в поєднанні з SPAL (Trombelli et al. 2022).
Отже, метою даного ретроспективного дослідження було оцінити ефективність SPAL, проведеного в комбінації з pDBBM або bDBBM, у виправленні PIBD. Крім того, були проаналізовані зміни в твердих тканинах навколо імплантів, що відбулися з моменту встановлення імпланта до повторного втручання для відкриття імпланта. Також була досліджена контрольна група, що складається з імплантів, які показували товстий (≥ 2 мм) PBBP під час встановлення імпланта.
Матеріали та методи
2.1 Етичні аспекти
Дане ретроспективне дослідження було схвалено Етичним комітетом Area Vasta Emilia Centro, Італія (протокол № 523/2024/Oss/UniFe, дата схвалення 16.10.2024). Кожен пацієнт надав письмову інформовану згоду перед хірургічним лікуванням.
Усі клінічні процедури були виконані відповідно до Декларації Гельсінкі та Настанов з доброї клінічної практики (GCP).
2.2 Популяція дослідження
Записи пацієнтів, які пройшли імплантопідтримувану протезну реабілітацію в період з травня 2020 по вересень 2021 року в Науковому центрі вивчення пародонтальних і періімплантних захворювань Університету Феррари та в одному приватному стоматологічному кабінеті, розташованому у Феррарі, були переглянуті для визначення придатності пацієнтів для участі в дослідженні. Дане ретроспективне дослідження було проведено відповідно до рекомендацій/переліку STROBE для крос-секційних досліджень.
На основі стану щічної кісткової пластинки на момент встановлення імплантату та хірургічного втручання пацієнти були розподілені на 2 групи:
- Пацієнти з принаймні одним імплантатом, у яких PIBD ≥ 1 мм, які лікувалися SPAL у поєднанні з pDBBM (група SPALчастинкова);
- Пацієнти з принаймні одним імплантатом, у яких PIBD ≥ 1 мм, які лікувалися SPAL у поєднанні з bDBBM (група SPALблочна).
Групи SPAL складалися з пацієнтів, які лікувалися послідовно, де відповідні клінічні та рентгенографічні вимірювання могли бути отримані для аналізу даних. Якщо два або більше імплантатів у одного пацієнта відповідали критеріям дослідження, для аналізу обирався лише імплантат з PIBD з найбільшою кістковою дегісценцією. Крім того, пацієнти з принаймні одним імплантатом, у яких залишкова товщина PBBP ≥ 2 мм після встановлення імплантату, вважалися контрольною групою (група CONTROL).
Усі обрані імплантати повинні були бути встановлені в загоєному кістковому гребені (імплантати типу 4C, Gallucci et al. 2018) і повинні були демонструвати первинну стабільність, оцінену за допомогою крутного моменту при встановленні. Важкі курці (споживання сигарет > 10 сигарет/день) та пацієнти з цукровим діабетом на момент хірургічного втручання були виключені з дослідження.
2.3 Клінічні процедури
2.3.1 Передопераційні процедури
Перед встановленням імплантатів усі пацієнти пройшли активну терапію для лікування каріозних уражень та захворювань пародонту, а також були залучені до професійного обслуговування з частотою візитів, запланованих відповідно до інструменту оцінки PerioRisk (Trombelli et al. 2009, 2017; Farina et al. 2021).
Усі хірургічні процедури виконувалися двома підготовленими операторами (L.T., M.S.). Пацієнтам було введено 2 г амоксициліну + клавуланової кислоти (Augmentin, GlaxoSmithKline, Верона, Італія) за 1 годину до операції. Місцева анестезія була досягнута за допомогою артикаїну з 1:100,000 адреналіну, введеного шляхом місцевої інфільтрації.
2.3.2 Хірургічні процедури
2.3.2.1 Групи SPAL.
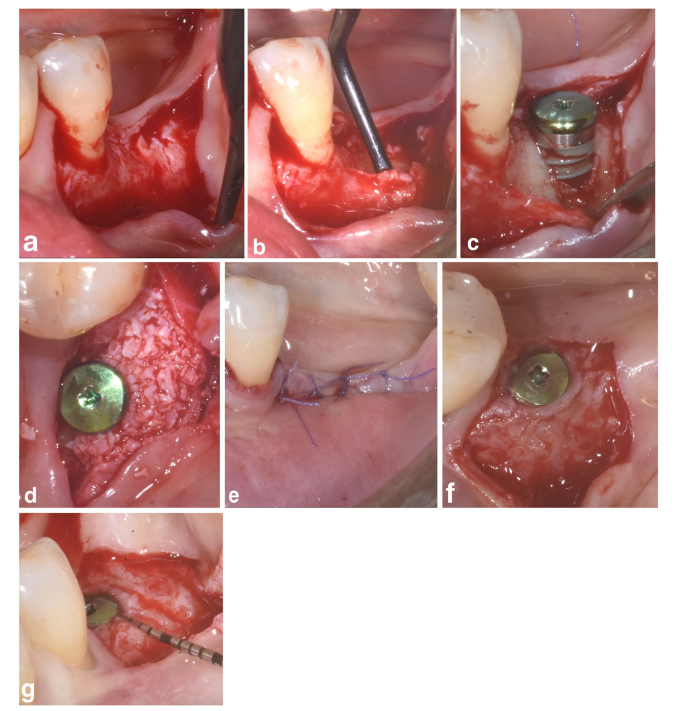
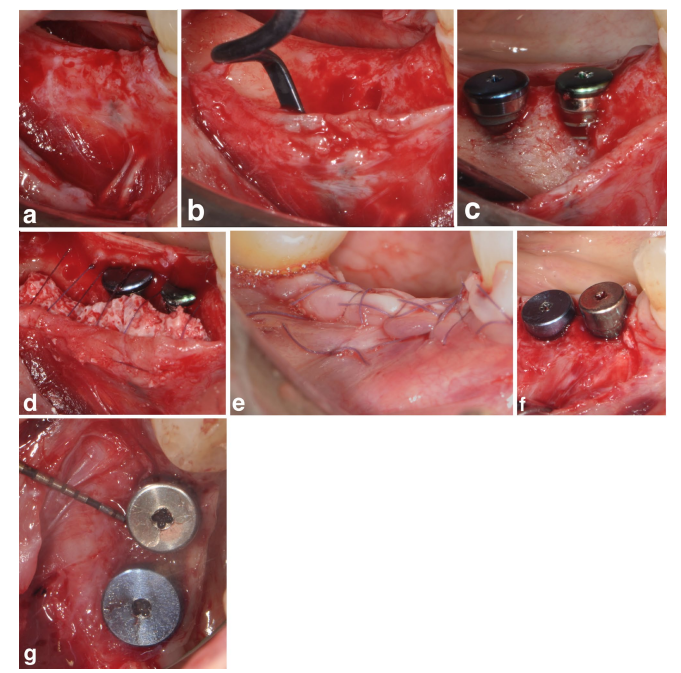
У групах SPALчастинки та SPAL-блоків хірургічний доступ до кісткового гребеня був виконаний відповідно до раніше описаної процедури (Trombelli et al. 2018). Коротко, слизова оболонка була піднята на щічній стороні шляхом дисекції з частковою товщиною за допомогою леза 15C (Рисунки 1a та 2a). Потім періост піднімався з кістки за допомогою періостального підйомника (PTROM, Hu-Friedy, Чикаго, Іллінойс), а також тунельних ножів (KPAX, TKN1X та TKN2X, Hu Friedy, Чикаго, Іллінойс) з різними загостреними краями, створюючи підперіостальний мішок, який міг вмістити трансплантат (Рисунки 1b та 2b). Повнотовстий клапоть був піднятий на оральній (язиковій/небній) стороні. Волокна під'язикового м'яза були відокремлені від язикового клаптя за допомогою тупого інструмента, щоб дозволити корональне просування. Кортикальні перфорації були виконані каліброваним циліндричним карбідним бором для збільшення кровопостачання до хірургічної області (Majzoub et al. 1999; Acar et al. 2016).
Імплантати на рівні тканин (SPI Element; Thommen Medical, Гренхен, Швейцарія) були встановлені з корональним краєм полірувального коміра товщиною 1 мм на рівні кісткового гребеня (Рисунки 1c та 2c).
Ксеноімплантат на основі бичачої кістки, який постачався у вигляді частинок (гранули Bio-Oss спонгіозної кістки, розмір частинок 0.25–1.0 мм; Geistlich Pharma, AG, Вольгусен, Швейцарія) (Тромбеллі та ін. 2018) або блоку (блок Bio-Oss; Geistlich Pharma, AG, Вольгусен, Швейцарія) (Тромбеллі та ін. 2022), використовувався для заповнення хірургічно створеного простору між періостальною оболонкою та відкритою поверхнею імплантату. Блок був розбитий на менші шматочки за допомогою леза 15C або алмазного бора, щоб адаптуватися до розміру субперіостального простору та досягти бажаного контурування щічної пластини. Графтування проводилося для повного коригування PIBD до кісткового гребеня. У всіх випадках субперіостальний графт забезпечував щонайменше 2 мм товщини на полірувальному комірі імплантату.
Корональна частина періостального шару була закріплена до орального клаптя за допомогою резорбованих внутрішніх матрацних швів (Vicryl 6/0, Ethicon, Somerville NJ, USA) (Рисунки 1d та 2d). Після цього слизова оболонка була коронально просунута і зашита до орального клаптя за допомогою горизонтальних внутрішніх матрацних та перерваних швів, щоб забезпечити занурене загоєння як для графта, так і для імплантату (Рисунки 1e–2e).
Через 6 місяців після хірургічного повторного входу для відкриття імплантату, була дисектована щічна клаптева з розщепленою товщиною, щоб розмістити загоювальний абатмент. Для оцінки наявності/відсутності залишкового PIBD, була оцінена наявність твердої тканини навколо поверхні імплантату за допомогою зонда UNC-15. Якщо не було проникнення зонда за межі полірувального коміра імплантату, імплантат класифікувався як “повністю виправлена декомпенсація”.
Для забезпечення адекватних розмірів кератинізованої пері-імплантної слизової (KT) було виконано або апікальне позиціонування клаптя (APF), або вільну гінгівальну трансплантацію (FGG) (Trombelli et al. 2019) (Рисунки 1f,g та 2f). Вибір виконання або APF, або FGG базувався на необхідності забезпечити висоту KT не менше 2 мм як на щічній, так і на язиковій сторонах імпланта.
2.3.2.2 Група CONTROL.
Була піднята щічна та язикова/піднебінна повна товщина клаптя, щоб оголити кістковий гребінь. Місце для імпланта було підготовлено відповідно до інструкцій виробника, і імпланти рівня тканини (SPI Element; Thommen Medical, Гренхен, Швейцарія) були вставлені з корональним краєм 1-мм полірувальної манжети на рівні кісткового гребеня. Жодна процедура збільшення кістки не проводилася. У всіх випадках клапоть був зашитий за допомогою внутрішніх матрацних та перерваних швів (Vicryl 5/0, Ethicon, Сомервілл, Нью-Джерсі, США), щоб забезпечити занурене загоєння.
Через 3 місяці після хірургічного повторного входу для відкриття імпланта, був піднятий щічний клапоть повної товщини, щоб закрутити загоювальний абатмент. Клапоть потім був підрізаний і адаптований до загоювального абатмента, щоб забезпечити адекватні розміри кератинізованої слизової оболонки навколо імпланта.
2.3.2.3 Післяопераційні процедури.
Рятівний протизапальний препарат (тобто, таблетки ібупрофену 600 мг) був призначений негайно після операції, а потім про ре нато на наступні післяопераційні дні. Пацієнтам було наказано не носити жодних знімних протезів, щоб уникнути тиску на хірургічне місце принаймні 4 тижні, і не жувати або чистити в обробленій зоні приблизно 2 тижні. Для контролю хімічного нальоту було призначено домашнє використання розчину хлоргексидину 0,12% (Dentosan, Recor-dati, Мілан, Італія) (ополоснути 1 хв. двічі на день протягом 3 тижнів). Шви були видалені через 2 тижні після операції.
2.4 Параметри дослідження
2.4.1 Клінічні вимірювання
Для оцінки впливу лікування на PIBD були отримані наступні клінічні вимірювання з клінічних карт:
- Висота кісткової дегісценції (BDH): вимірюється на середньо-щічній стороні імплантату як відстань між апікальним краєм полірувальної шийки імплантату та першим контактом кістки з імплантатом;
- Ширина кісткової дегісценції (BDW): вимірюється на щічній стороні імплантату як найширша відкрита частина шорсткої поверхні імплантату.
У всіх групах BDH та BDW оцінювалися відразу після встановлення імплантату та при повторному вході для відкриття імплантату.
Крім того, товщина щічних тканин (BTT) вимірювалася як відстань між щічним контуром полірувальної шийки та зовнішньою стороною або пересадженої ділянки (групи SPAL), або рідного кісткового гребеня (група CONTROL) на середньо-щічній стороні імплантату. Початкова BTT була зафіксована:
- Негайно після встановлення імплантату для контрольної групи;
- Негайно після пересадки для обох груп SPAL; BTT було зафіксовано знову під час повторного хірургічного втручання для всіх груп.
Усі вимірювання були проведені за допомогою пародонтального зонда UNC-15 і округлені до найближчого міліметра.
2.4.2 Радіографічні вимірювання
Періапікальні рентгенограми, зроблені за допомогою довгоконусної паралельної техніки негайно після операції та під час повторного втручання для всіх груп, були оцифровані та проаналізовані за допомогою спеціально розробленого програмного забезпечення (NIS elements v4.2; Nikon Instruments, Campi Bisenzio, Firenze, Italy). Рівень краю кістки (MBL) вимірювався як відстань (округлена до найближчих 0.1 мм) між найапікальнішим краєм полірувальної шийки імплантату та кістковим гребенем на мезіальному (mMBL) та дистальному (dMBL) аспектах кожного імплантату за допомогою збільшення 10×–15×. MBL фіксувався як негативний або позитивний, коли апікальний край полірувальної шийки розташовувався відповідно апікально або коронально до кісткового гребеня.
Референсна мітка висотою 1 мм, присутня на цифровій рентгенограмі, використовувалася для калібрування.
Два експерти (C.F. та M.S.) виконали рентгенометричні вимірювання. Експерти брали участь у сесії калібрування на зразку рентгенограм, отриманих від пацієнтів, не обраних для даного дослідження. Сесія калібрування складалася з двох сесій вимірювань MBL, проведених з інтервалом у 7 днів, і дозволила досягти відмінної узгодженості між експертами та всередині експертів (k-оцінка 0.87).
Статистичний аналіз
Частка пацієнтів, у яких груба поверхня імплантату покривала до апікальної частини полірувального коміра (тобто без PIBD) при повторному вході, вважалася основним результатом. Значення та зміни в BDH, BDW, BTT та MBL були вторинними змінними результату.
Розмір вибірки був розрахований на основі даних, отриманих з попереднього дослідження (Benic et al. 2019), де частка пацієнтів, у яких груба поверхня імплантату покривала до плеча імплантату при повторному вході, становила 91.7% у групах з блоками DBBM та 25.0% у групі частинок DBBM відповідно. Z-тест оцінив, що для досягнення 95% статистичної потужності з помилкою альфа 0.05 потрібно щонайменше 11 пацієнтів для кожної з двох незалежних груп SPAL.
Пацієнт розглядався як статистична одиниця. Дані описувалися за допомогою середнього, стандартного відхилення, медіани, міжквартильного діапазону (IR) та мінімальних і максимальних значень для кількісних змінних, а також процентних пропорцій для категоріальних змінних.
Внутрішньогрупові порівняння для безперервних/ординальних змінних проводилися за допомогою тесту знаків Вілкоксона для парних даних. Міжгрупові порівняння для безперервних/ординальних змінних проводилися за допомогою ANOVA Крускала-Уолліса. У разі значущості за тестом Крускала-Уолліса були обчислені множинні (пост-хок) порівняння середніх рангів; нормальні z-значення були обчислені для кожного порівняння, а також пост-хок ймовірності (виправлені за кількістю порівнянь) для двостороннього тесту значущості. Міжгрупові порівняння для бінарної змінної проводилися за допомогою тестів хі-квадрат максимального правдоподібності з поправкою Йейтса. Зміна вторинних змінних результату статистично оцінювалася за допомогою узагальнених лінійних моделей (GLZ), скоригованих на значущі змішувачі, після чого проводилася ANOVA для повторних вимірювань для міжгрупових порівнянь і з пост-хок тестом HSD з нерівними N.
Результати
4.1 Популяція дослідження
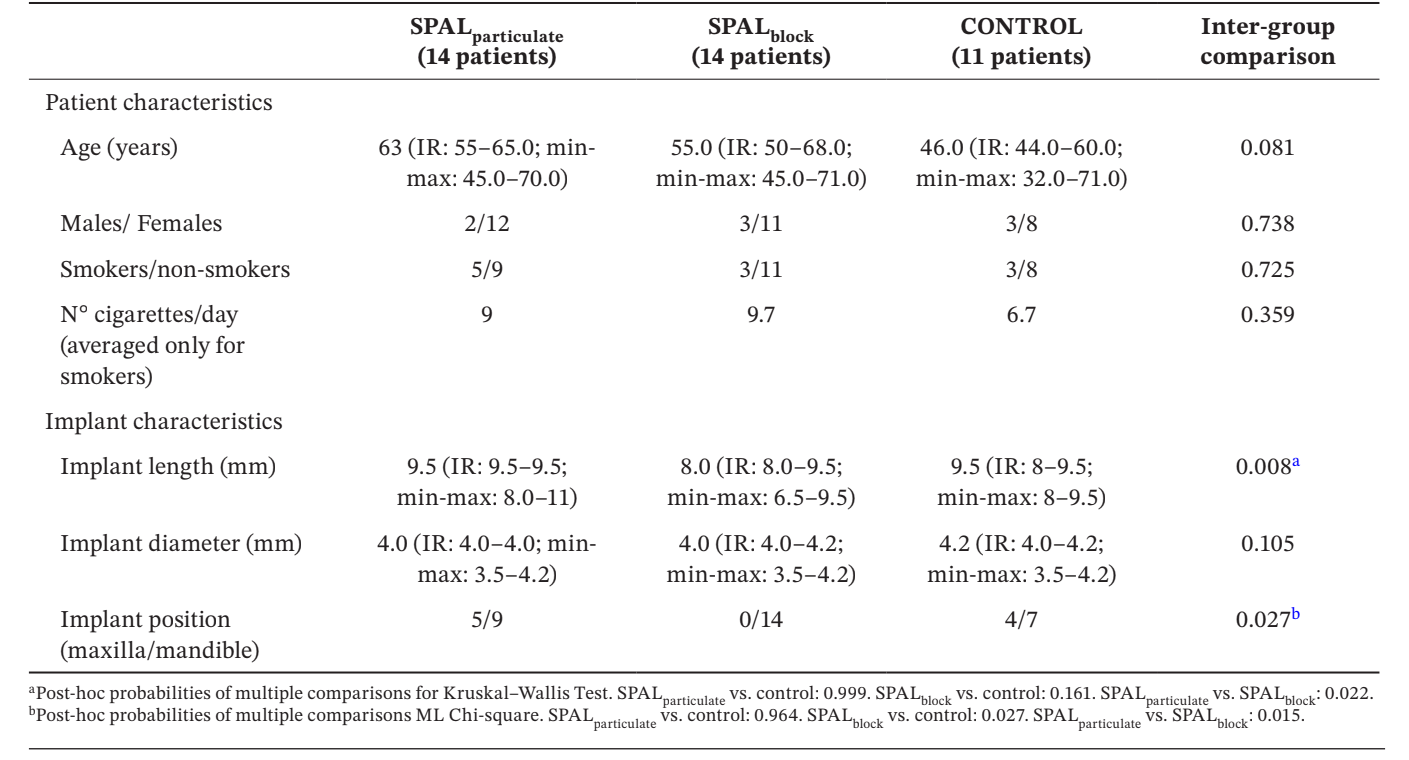
Тридцять дев'ять імплантатів у 39 пацієнтів (14 у групі SPALчастинок, 14 у групі SPALблоків та 11 у контрольній групі) були обрані для аналізу (Таблиця 1). Не було виявлено жодних відмінностей за віком, статтю та статусом куріння серед груп, більшість пацієнтів були некурцями. У групах SPALчастинок та контрольній групі одна третина імплантатів була розташована в верхній щелепі, тоді як усі імплантати були розташовані в нижній щелепі в групі SPALблоків. Ця різниця була статистично значущою (p = 0.027). Імплантати, розміщені в групі SPALблоків, були значно коротшими, ніж ті, що були розміщені в групах SPALчастинок та контрольній групі (p = 0.008).
4.1.1 Післяопераційне загоєння
У групах SPALчастинок та CONTROL раннє загоєння у всіх пацієнтів проходило без ускладнень.
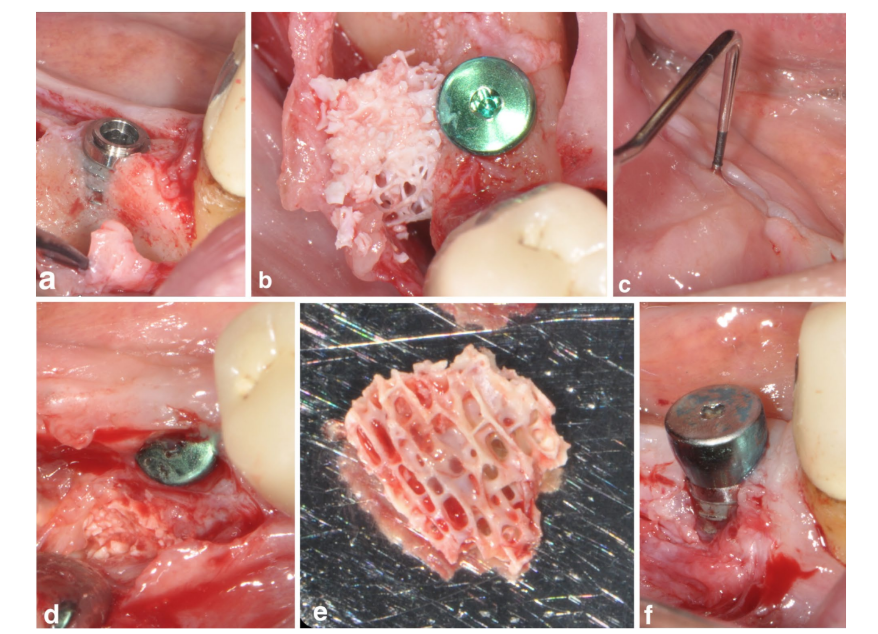
Один пацієнт у групі SPALблоку пережив післяопераційну інфекцію через 4 тижні після хірургічного втручання. Пацієнт повідомив про набряк і біль у хірургічно обробленій ділянці, а також була помітна фістула, що виділяла гнійний ексудат (Рисунок 3a–f). Після підняття клаптя часткової товщини, блокова пересадка DBBM була виявлена в грануляційній тканині і тому була видалена.
4.2 Результати дослідження
4.2.1 Первинний результат
Кількість і % пацієнтів, у яких груба поверхня імплантату була покрита до апікальної частини полірувального коміра при повторному вході (тобто, без PIBD), наведені в таблиці 2. У групі SPALчастинки не було виявлено залишкових дефектів, тоді як у групі SPALблоки пацієнт, у якого виникла післяопераційна інфекція трансплантату, мав залишковий PIBD. Двоє пацієнтів у контрольній групі мали випадковий PIBD при повторному вході (таблиця 2). Різниці між групами не були статистично значущими.
4.2.2 Вторинні результати
Модель GLZ, скоригована на виявлені змішуючі фактори (довжина та позиція імплантату), показала, що як лікування, так і час були значущими предикторами як для BDH, так і для BDW (час, p < 0.0001 для обох; лікування, p < 0.001 для обох). Порівняння всередині групи та між групами для BDH і BDW наведені в таблиці 3. Тест Вілкоксона для парних даних показав значне зменшення часу для обох груп SPALparticulate (p < 0.001 для обох BDH і BDW) та SPALblock (p = 0.001 для обох BDH і BDW). Під час встановлення імплантату групи SPAL були значно відмінні від групи CONTROL (p = 0.0001 для обох BDH і BDW). Однак значних відмінностей між групами не було виявлено під час повторного входу для обох BDH і BDW. У групі SPALblock пацієнт з залишковим PIBD показав BDH 3 мм і BDW 4 мм. У групі CONTROL двоє пацієнтів з інцидентом PIBD під час повторного входу показали BDH 2 мм і BDW 2 мм, а також BDH 2 мм і BDW 4 мм відповідно.
Для BTT модель GLZ, скоригована з урахуванням виявлених факторів, показала, що як лікування, так і час були значущими предикторами (p < 0.0001 для обох факторів). Порівняння всередині груп та між групами для BDH та BDW наведені в таблиці 4. Значна різниця між групами спостерігалася як на початковому етапі, так і при повторному вході (p < 0.0001). Зокрема, група SPALblock показала значно більші значення, ніж SPALparticulate як на початковому етапі (p = 0.0022), так і при повторному вході (p = 0.0160). Порівняння всередині груп показали значне зменшення BTT з часом для всіх груп, величина цього зменшення була подібною серед груп.
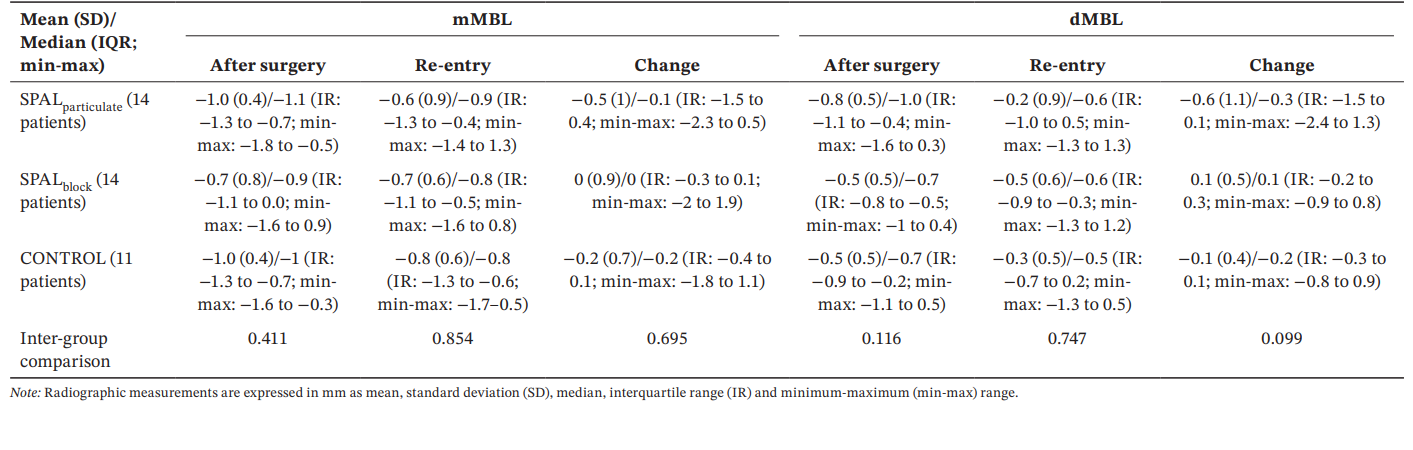
Усі групи показали подібні значення mMBL та dMBL після операції та при повторному вході, а також зміни з часом (Таблиця 5).
Обговорення
Метою цього ретроспективного дослідження було оцінити ефективність техніки SPAL, виконаної в комбінації з DBBM у формі часточок або блоку, для повного виправлення PIBD під час імплантації. Групи SPAL також порівнювалися з групою пацієнтів, у яких після імплантації спостерігалася пері-імплантантна вестибулярна кісткова пластинка щонайменше 2 мм. Результати показали, що, незалежно від форми DBBM, імпланти, оброблені технікою SPAL, продемонстрували однаково високий відсоток пацієнтів з повним виправленням дефекту через 6 місяців повторного обстеження. Група SPALblock показала значно вищий BTT як на початковому етапі, так і під час повторного обстеження. Однак ступінь ремоделювання трансплантату/кістки був подібним серед груп.
Вибір використання рівня повного виправлення декомпенсації як основного результату був зумовлений тим, що неналежно оброблений або частково виправлений PIBD може (i) сприяти виникненню біологічних ускладнень (Monje et al. 2019; Schwarz, Sahm, and Becker 2012) та (ii) призвести до збільшення міжпроксимальної втрати кістки навколо імпланта (Jung et al. 2017). Група CONTROL була включена для оцінки ступеня ремоделювання двох біоматеріалів трансплантату в порівнянні з рідною кісткою.
Ефективність SPAL, виконаного в комбінації з pDBBM для лікування PIBD, відповідала тій, що була зафіксована в попередніх клінічних дослідженнях, де використовувався той самий частковий графт, що показав рівень повного покриття декомпенсації в межах від 80% до 91% (Trombelli et al. 2019, 2020). Ці результати можна частково пояснити біологічними та технічними аспектами, специфічними для регенеративної процедури. У техніці SPAL шар періосту є джерелом остеогенних клітин, які можуть (i) сприяти новому утворенню кістки (Ceccarelli, et al., 2016) та (ii) діяти як індуктор неоангіогенезу, таким чином забезпечуючи ранню васкуляризацію графта DBBM (Nobuto et al. 2005). Крім того, створення ізольованого підперіостального простору може дозволити належне розміщення графта та стабілізацію в найбільш корональній частині імплантату (Trombelli et al. 2018, 2019, 2020). Стабільність графта для підтримки остеокондуктивної активності графта також підвищується за рахунок внутрішніх матрацних швів, які фіксують корональну частину періостального шару до орального клаптя. Послідовно, мережевий мета-аналіз, що порівнює різні варіанти лікування для повного виправлення PIBD, показав, що SPAL з pDBBM має найвищу ймовірність успіху серед включених процедур (Severi et al. 2022).
Нещодавно використання bDBBM у поєднанні з SPAL було запропоновано як перспективну альтернативу частковому трансплантату (Trombelli et al. 2022). Було запропоновано, що bDBBM діє як ефективний остеокондуктивний каркас завдяки своїм механічним властивостям, які включають обмежене зміщення під час маніпуляцій з клаптем, а також вищу розмірну стабільність (Benic et al. 2016; Benic et al. 2017; Mir-Mari et al. 2016). Ефективність bDBBM підтверджується нашими даними, які показали 93% рівень повної корекції PIBD. Більше того, використання bDBBM призвело до більшого BTT, ніж pDBBM, як на початковому етапі, так і при повторному вході. Ці результати узгоджуються з тими, що випливають з дослідження, в якому комбінація bDBBM і колагенової мембрани, одночасно з установкою імплантату, виявилася кращою, ніж комбінація тієї ж мембрани та pDBBM у повному вирішенні дефекту та відновленні товстої щічної пластини (Benic et al. 2019). Однак слід підкреслити, що один пацієнт, який отримав блочний трансплантат, зазнав інфекції трансплантату після операції, що призвело до постійної декісценції через 6 місяців. Попередні дослідження, в яких використовувався ксеногенний кістковий блок для процедури збільшення гребеня, проведеної перед установкою імплантату, повідомляли про рівень інфекції трансплантату та подальшого видалення від 33% (Ortiz-Vigón et al. 2017) до 40% (Schwarz et al. 2021) з лікуваних випадків. Преклінічні (Benic et al. 2016; Benic et al. 2017) та клінічні (Laas, et al., 2020) дослідження показали, що bDBBM погано колонізується новою кісткою в порівнянні з pDBBM. Спостережене обмежене утворення кістки було пов'язане з порушеною васкуляризацією блоку через його макроструктуру (Laass et al. 2020). Чи може використання bDBBM бути безпечною та ефективною альтернативою pDBBM у поєднанні з технікою SPAL, потребує подальшої оцінки.
Наш дизайн дослідження може надати попереднє уявлення про ступінь ремоделювання трансплантата після процедур SPAL з різними формами трансплантатів у порівнянні з ремоделюванням кістки після встановлення імплантату. Незважаючи на те, що група SPALblock показала значно більшу BTT як після операції, так і при повторному вході, величина ремоделювання трансплантата була подібною для обох трансплантатів і в порівнянні з природною кісткою. Зміни BTT у групі SPALblock були узгоджені з попередніми дослідженнями, що оцінювали ремоделювання трансплантата після процедури GBR, проведеної з використанням bDBBM у поєднанні з колагеновою мембраною (Benic et al. 2019). У протилежність цьому, те ж дослідження показало, що середнє зменшення товщини для pDBBM плюс колагенова мембрана було вдвічі більшим (2 мм) у порівнянні з нашими даними. Відмінності у змінах BTT, спостережувані в двох дослідженнях, можуть бути пояснені різними динаміками ремоделювання трансплантата, а також ступенем зміщення трансплантата внаслідок специфічної регенеративної процедури. Загалом, ці спостереження свідчать про необхідність надмірної корекції розміру BTT, щоб компенсувати горизонтальне зменшення трансплантата після операції, незалежно від використовуваних процедур збільшення кістки.
У нашому матеріалі контрольна група складалася з пацієнтів, у яких після встановлення імплантату спостерігалася товщина PBBP не менше 2 мм. Цей вибір базувався на попередніх дослідженнях, які показали, що товщина PBBP корелює з випадками вертикальної втрати кістки на щічній пластині після встановлення імплантату (Spray et al. 2000) та наступною необхідністю проведення процедур збільшення кістки (Roccuzzo, Imber, і Jensen 2021). Цікаво, що середнє зменшення BTT на 1 мм також було зафіксовано в контрольній групі, що призвело до того, що двоє пацієнтів (18%) зазнали інциденту PIBD при повторному вході. Ремоделювання кістки перевищило те, що було зафіксовано в попередніх дослідженнях, де зменшення товщини PBBP після встановлення імплантату коливалося від 0,3 (Merheb et al. 2017) до 0,4 мм (Cardaropoli, Lekholm, і Wennström 2006). Різні фактори, включаючи 3D позиціонування імплантату (Nomiyama et al. 2022), методи підготовки місця для імплантату (Baggi et al. 2008; Peker Tekdal et al. 2016), дизайн/поверхня імплантату (Linkevicius et al. 2020; Galindo-Moreno et al. 2016; Camarda et al. 2021), анатомічне розташування (переднє/заднє, нижня щелепа/верхня щелепа) (Ghaly et al. 2023), товщина періімплантної слизової (Maia et al. 2015; Suárez-López Del Amo et al. 2016), і протезний з'єднання (Linkevicius et al. 2015) могли частково пояснити це суперечливе спостереження.
Для полегшення закриття первинного наміру були встановлені імплантати рівня тканини з корональним краєм полірувальної манжети на рівні кісткового гребеня. У цьому відношенні не можна виключити вплив позиціонування імплантату на обсяг корекції PIBD, а також на ступінь пері-імплантного ремоделювання кістки після встановлення імплантату (Saleh et al. 2018). Крім того, групи SPAL та контрольна група були повторно обстежені для відкриття імплантів на різних післяопераційних періодах (6 місяців проти 3 місяців). Ця різниця могла по-різному вплинути на ремоделювання тканин після встановлення імплантату.
Втрата пери-імплантної маргінальної кістки після встановлення імпланту може бути наслідком фізіологічного ремоделювання через механічну та теплову травму під час підготовки місця для імплантації. Цікаво, що в нашому матеріалі обмежена кількість ремоделювання трансплантату/кістки була подібно спостережена серед груп і була узгоджена з попередніми дослідженнями, де імплантати рівня тканини були або розміщені еквікрестально (Saleh et al. 2018), або оброблені SPAL плюс pDBBM (Trombelli et al. 2020).
Деякі обмеження даного дослідження слід враховувати при інтерпретації його результатів. Вибір пілотного дослідження з ретроспективним дизайном був обумовлений відсутністю специфічних клінічних показань (тобто, факторів, пов'язаних з пацієнтом/дефектом) для поєднання техніки SPAL з частинками DBBM або блоком DBBM через обмежені, анекдотичні дані (Trombelli et al. 2022), що підтримують використання блоку DBBM у поєднанні з технікою SPAL. Специфічна формула DBBM була використана відповідно до уподобань оператора. Цей неупереджений вибір використаного графта не призвів до значних відмінностей у характеристиках пацієнтів і дефектів. Однак деякі фактори, такі як анатомічне розташування та довжина імплантатів, були нерівномірно розподілені серед груп, і, хоча контрольовані статистичним аналізом, могли вплинути на спостережувані результати. Оскільки включені пацієнти були послідовно лікувані під час рутинної клінічної діяльності, зонд UNC 15 був регулярним/стандартизованим інструментом, що використовувався для всіх клінічних вимірювань, включаючи розміри PIBD. Інші методи вимірювання, такі як каліпер (Roccuzzo, Imber, і Jensen 2021) або спеціально розроблений пристрій (Merheb et al. 2017), могли б призвести до більш точних записів розміру дегісценції та BBT.
На завершення, наші результати, здається, вказують на те, що SPAL, виконаний у поєднанні з частинковим або блочним графтом DBBM, є однаково ефективним у виправленні PIBD, а також у збільшенні BTT через 6 місяців.
Маттіа Севері, Франціні Кьяра, Анна Сімонеллі, Кьяра Скаполі, Леонардо Тромбеллі
Посилання
- Баджі, Л., І. Каппеллоні, М. Ді Джироламо, Ф. Макері та Г. Вайро. 2008. “Вплив діаметра та довжини імплантату на розподіл напруги оссеоінтегрованих імплантатів, пов'язаних з геометрією кістки: тривимірний аналіз скінченних елементів.” Журнал протезування зубів 100, № 6: 422–431. https://doi.org/10.1016/S0022-3913(08)60259-0.
- Бені, Г. І., Б. М. Ейзнер, Р. Е. Юнг, Т. Баслер, Д. Шнайдер та С. Х. Ф. Хаммерле. 2019. “Зміни в твердих тканинах після керованої регенерації кістки періімплантних дефектів у порівнянні блочних та частинкових кісткових замінників: результати 6-місячного рандомізованого контрольованого клінічного випробування.” Клінічні дослідження імплантатів 30: 1016–1026. https://doi.org/10.1111/clr.13515.
- Бені, Г. І., Д. С. Тома, Ф. Муньйос, І. С. Мартін, Р. Е. Юнг та С. Х. Ф. Хаммерле. 2016. “Керована регенерація кістки періімплантних дефектів з використанням частинкових та блочних ксеногенних кісткових замінників.” Клінічні дослідження імплантатів 27, № 5: 567–576. https://doi.org/10.1111/clr.12625.
- Бені, Г. І., Д. С. Тома, І. Санц-Мартін та ін. 2017. “Керована регенерація кістки на імплантатах із цирконію та титану: пілотне гістологічне дослідження.” Клінічні дослідження імплантатів 28, № 12: 1592–1599. https://doi.org/10.1111/clr.13030.
- Брессан, Е., Н. Феррарезе, М. Прамстраллер, Д. Лопс, Р. Фаріна та С. Томасі. 2017. “Розміри гребеня беззубої щелепи в задньому секстанті: спостережне дослідження на рентгенограмах комп'ютерної томографії конусного променя.” Імплантологія 26, № 1: 66–72. https:// doi.org/10.1097/ID.0000000000000489.
- Камарда, А. Дж., Р. Дюран, М. Бенкарім, П. Х. Ромпре, Г. Гуертін та Х. Чіабурро. 2021. “Перспективне рандомізоване клінічне випробування, що оцінює вплив двох різних дизайнів комірок імплантатів на загоєння періімплантних тканин та функціональну оссеоінтеграцію через 25 років.” Клінічні дослідження імплантатів 32: 285–296. https://doi.org/10.1111/clr.13699.
- Кардарополі, Г., У. Лекгольм та Дж. Л. Веннстром. 2006. “Зміни тканин при одиночних зубних заміщеннях на імплантатах: 1-річне перспективне клінічне дослідження.” Клінічні дослідження імплантатів 17, № 2: 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x.
- Фаріна, Р., А. Сімонеллі, А. Баралді та ін. 2021. “Втрата зубів у пацієнтів з періодонтитом, які дотримуються та не дотримуються рекомендацій під час підтримуючої періодонтальної терапії.” Клінічні усні дослідження 25, № 10: 5897–5906. https://doi.org/10.1007/s00784-021-03895-8.
- Галіндо-Морено, П., А. Леон-Кано, А. Монье, І. Ортега-Оллер, Ф. О'Валле та А. Катена. 2016. “Висота абатмента впливає на ефект перемикання платформи на втрату краєвої кістки навколо імплантатів.” Клінічні дослідження імплантатів 27, № 2: 167–173. https://doi.org/10.1111/clr.12554.
- Галлуччі, Г. О., А. Гамільтон, В. Чжоу, Д. Бусер та С. Чен. 2018. “Протоколи розміщення та навантаження імплантатів у частково беззубих пацієнтів: систематичний огляд.” Клінічні дослідження імплантатів 29, №. Додаток 16: 106–134. https://doi.org/10.1111/clr.13276.
- Галі, М., Д. Тарраззі, В. Ся, С. Таррінгтон та Т. Р. Шонбаум. 2023. “Зміни в рівні краєвої кістки навколо імплантатів за місцем розташування щелепи: систематичний огляд та мета-аналіз 4970 імплантатів.” Журнал імплантології 49, № 4: 444–455. https://doi.org/10.1563/aaid-joi-D-22-00252.
- Еррера, Д., Т. Берглунд, Ф. Шварц та ін. 2023. “Профілактика та лікування періімплантних захворювань — клінічні рекомендації EFP S3 рівня.” Журнал клінічної пародонтології 50, №. Додаток 26: 4–76. https://doi.org/10.1111/jcpe.13823.
- Йенсен, С. С., Т. Агалу, Р. Е. Юнг та ін. 2023. “Звіт консенсусу групи 1 ITI: Роль розмірів кістки та процедур збільшення м'яких тканин на стабільність клінічних, рентгенографічних та пацієнтських результатів лікування імплантатами.” Клінічні дослідження імплантатів 34, №. Додаток 26: 43–49. https://doi.org/10.1111/clr.14154.
- Юнг, Р. Е., М. Герцог, К. Вольлеб, С. Ф. Рамель, Д. С. Тома та С. Х. Ф. Хаммерле. 2017. “Рандомізоване контрольоване клінічне випробування, що порівнює невеликі дефекти букової декомпенсації навколо зубних імплантатів, які лікувалися за допомогою керованої регенерації кістки або залишалися для спонтанного загоєння.” Клінічні дослідження імплантатів 28, № 3: 348–354. https://doi.org/10.1111/clr.12806.
- Лаас, А., Б. М. Ейзнер, С. Х. Ф. Хаммерле, Р. Е. Юнг, Д. С. Тома та Г. І. Бені. 2020. “Гістологічні результати після керованої регенерації кістки періімплантних дефектів у порівнянні з індивідуально сформованими блоками та частинковими кістковими замінниками.” Міжнародний журнал пародонтології та реставраційної стоматології 40, № 4: 519–527. https://doi.org/10.11607/prd.4575.
- Лінкевічус, Т., А. Пуйсіс, Л. Лінкевічене, В. Печіулене та М. Шле. 2015. “Стабільність краєвої кістки навколо імплантатів з горизонтальною відповідністю з'єднання після потовщення м'яких тканин: перспективне клінічне випробування.” Клінічна імплантологія та супутні дослідження 17, № 3: 497–508. https://doi.org/10.1111/cid.12155.
- Лінкевічус, Т., А. Пуйсіс, Р. Лінкевічус, Дж. Алкімавічус, Е. Гіневічюте та Л. Лінкевічене. 2020. “Вплив зануреного абатмента загоєння або підкресленого розміщення імплантату на товщину м'яких тканин та стабільність краєвої кістки. 2-річне рандомізоване клінічне випробування.” Клінічна імплантологія та супутні дослідження 22, № 4: 497–506. https://doi.org/10.1111/cid.12903.
- Майя, Л. П., Д. М. Рейно, В. А. Муглія та ін. 2015. “Вплив товщини пародонтальної тканини на ремоделювання букової пластини на імплантатах з ксенографтом.” Журнал клінічної пародонтології 42: 590–598. https:// doi.org/10.1111/jcpe.12405.
- Мереб, Дж., М. Веркруйсен, В. Коуке, Л. Беккерс, В. Тейгельс та М. Квірінен. 2017. “Доля букової кістки навколо зубних імплантатів. Дослідження спостереження через 12 місяців після навантаження.” Клінічні дослідження імплантатів 28, № 1: 103–108. https://doi.org/10.1111/clr.12767.
- Мір-Марі, Дж., Х. Вуй, Р. Е. Юнг, С. Х. Ф. Хаммерле та Г. І. Бені. 2016. “Вплив закриття рани без зору на стабільність об'єму різних матеріалів GBR: in vitro дослідження комп'ютерної томографії конусного променя.” Клінічні дослідження імплантатів 27, № 2: 258–265. https://doi.org/10.1111/clr.12590.
- Монье, А., В. Шапюїс, Ф. Монье та ін. 2019. “Критична товщина букової кістки навколо імплантатів: експериментальне дослідження на собаках біглів.” Міжнародний журнал оральних та щелепно-лицевих імплантатів 34, № 6: 1328–1336. https://doi.org/10.11607/jomi.7657.
- Монье, А., А. Роккуццо, Д. Бусер та Х. Л. Ванг. 2023. “Вплив товщини букової кістки на зміни розмірів твердих та м'яких тканин навколо імплантатів: систематичний огляд.” Клінічні дослідження імплантатів 34, № 3: 157–176. https://doi.org/10.1111/clr.14029.
- Нобуто, Т., Ф. Сува, Т. Коно та ін. 2005. “Мікросудинна реакція в періосте після хірургії мукоперіостального клаптя у собак: ангіогенез та резорбція та формування кістки.” Журнал пародонтології 76, № 8: 1346–1353. https://doi.org/10.1902/jop.2005.76.8.1346.
- Номіяма, Л. М., Е. К. Матумото, М. Г. Корреа та ін. 2022. “Порівняння між безклапанною керованою та традиційною хірургією для розміщення імплантатів: 12-місячне рандомізоване клінічне випробування.” Клінічні усні дослідження 27: 1665–1679. https://doi.org/10.1007/s00784-022-04793-3.
- Ортіс-Вігон, А., І. Суарез, С. Мартінес-Вілья, І. Санц-Мартін, Дж. Боллайн та М. Санц. 2017. “Безпека та ефективність нового колагенового ксеногенного кісткового блоку для бічного збільшення альвеолярного гребеня для етапного розміщення імплантатів.” Клінічні дослідження імплантатів 29, № 1: 36–45. https://doi.org/10.1111/clr.13036.
- Пекер Текдал, Г., Н. Бостанджі, Г. Н. Белібасакіс та А. Гюркан. 2016. “Вплив п'єзоелектричної хірургії імплантату на радіологічні та молекулярні параметри втрати краєвої кістки навколо імплантатів: рандомізоване контрольоване випробування з розділеним ротом.” Клінічні дослідження імплантатів 27, № 5: 535–544. https://doi.org/10.1111/clr.12620.
- Прамстраллер, М., Г. П. Шінкалья, Р. Векк'ятіні, Р. Фаріна та Л. Тромбеллі. 2018. “Розміри альвеолярного гребеня в задніх ділянках нижньої щелепи: ретроспективне порівняльне дослідження зубних та беззубих ділянок з використанням даних комп'ютерної томографії.” Хірургічна та радіологічна анатомія 40, № 12: 1419–1428. https://doi.org/10.1007/s00276-018-2095-0.
- Роккуццо, А., Дж. С. Імбер та С. С. Йенсен. 2021. “Необхідність бічного збільшення кістки на двох імплантатах з вузьким діаметром: перспективне контрольоване клінічне дослідження.” Клінічні дослідження імплантатів 32, № 4: 511–520. https://doi.org/10.1111/clr.13721.
- Салех, М. Х. А., А. Равіда, Ф. Суарез-Лопес Дель Амо, Г. Х. Лін, Ф. Аса'ад та Х. Л. Ванг. 2018. “Вплив положення з'єднання імплантату-абатмента на втрату краєвої кістки: систематичний огляд та мета-аналіз.” Клінічна імплантологія та супутні дослідження 20, № 4: 617–633. https://doi.org/10.1111/cid.12600.
- Шварц, Ф., Д. Сахін, С. Чивале-Швайгхофер та Дж. Беккер. 2021. “Довгострокові результати після бічного збільшення альвеолярного гребеня з використанням колагенового ксеногенного кісткового блоку: моноцентричне, перспективне одноруке клінічне дослідження.” Міжнародний журнал імплантології 7, № 1: 9. https://doi.org/10.1186/s40729-021-00293-3.
- Шварц, Ф., Н. Сахм та Дж. Беккер. 2012. “Вплив результату керованої регенерації кістки в дефектах типу декомпенсації на довгострокову стабільність здоров'я навколо імплантатів: клінічні спостереження через 4 роки.” Клінічні дослідження імплантатів 23, № 2: 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x.