Умови періімплантних тканин у імплантатів, оброблених технікою субперіостальної періімплантної підсилювальної оболонки: ретроспективне серійне дослідження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Оцінити умови пері-імплантних тканин у короткостроковій перспективі у пацієнтів, які отримали техніку субперіостального пері-імплантного підвищеного шару (SPAL), та у пацієнтів з адекватною товщиною (≥2 мм) букової кісткової пластини (PBBP) під час імплантації.
Методи: Пацієнти, у яких дефект декомпенсації або тонка PBBP під час імплантації були виправлені за допомогою техніки SPAL (групи SPALдекомпенсація та SPALтонка, відповідно), а також пацієнти з залишковою товщиною PBBP ≥2 мм під час імплантації (контрольна група) були ретроспективно відібрані. Основним результатом була кількість пері-імплантних ділянок, позитивних на кровотечу при зондуванні (BoP) через 6 місяців після протезування. Також оцінювалися висота кератинізованої слизової, рівень краю м'яких тканин, індекс нальоту, глибина зондування пері-імплантних тканин, гній при зондуванні та міжпроксимальний радіографічний рівень кістки (RBL).
Результати: Тридцять чотири пацієнти (11 у групі SPALдефект, 11 у групі SPALтонкий та 12 у контрольній групі) були включені. У кожній групі SPAL 10 пацієнтів (90,9%) показали товщину періімплантних тканин ≥2 мм у найбільш корональній частині імплантату під час відкриття. Поширеність (кількість) позитивних ділянок BoP становила 2, 1 та 0 у групах SPALдефект, SPALтонкий та контрольній групі відповідно. RBL склала 0,3 мм у групі SPALдефект, 0,2 мм у групі SPALтонкий та 0 мм у контрольній групі.
Висновок: Після 6 місяців протезування пацієнти, які проходили лікування за технікою SPAL, демонструють обмежене запалення періімплантної слизової у поєднанні з неглибоким PD та адекватним KM. Однак у імплантатів, що отримали техніку SPAL, міжзубний RBL був виявлений апікально від його ідеального положення.
Вступ
Протезно обґрунтоване розміщення імплантатів у зменшеній горизонтальній кістковій площі часто призводить до деhісценції або фенестрації кістки навколо імплантату. Навіть за наявності цілої, але тонкої букової кортикальної кісткової пластини, хірургічна травма та подальше ремоделювання кістки після розміщення імплантату можуть призвести до вертикальної втрати кістки з оголенням корональної частини імплантату під час відкриття (Merheb et al., 2017, Monje, et al., 2019, Spray, Black, Morris, 2000). Хоча кількість ремоделювання кістки після вставки імплантату була показана як подібна як для тонких, так і для товстих букових кісткових пластин (Merheb et al., 2017), таке ремоделювання може мати різний вплив на цілісність букової кісткової пластини навколо імплантату (PBBP). У цьому відношенні було показано, що існує підвищений ризик естетичних і біологічних ускладнень після розміщення імплантату в місцях з деhісценцією або тонкою PBBP у порівнянні з товстою PBBP в доклінічних (Monje, et al., 2019) та клінічних (Schwarz, Sahm, Becker, 2012, Jung et al., 2017) дослідженнях. У сукупності ці знахідки підкреслюють важливість цілісності та товщини PBBP під час розміщення імплантату для сприяння стабільним, здоровим умовам навколо імплантату з часом (Sanz-Sánchez et al., 2018).
Найбільш документована та ефективна процедура хірургічного виправлення дефекту типу дегісценції базується на використанні бар'єрних мембран у поєднанні з кістковими замісними трансплантатами відповідно до принципів керованої регенерації кістки (GBR) (Sanz-Sánchez, Ortiz-Vigón, Sanz-Martín, Figuero, Sanz, 2015). Зменшення або усунення дегісценції кістки навколо імплантату, про яке повідомляється після GBR (Thoma, Bienz, Figuero, Jung, Sanz-Martín, 2019), здається, позитивно впливає на довгострокові умови імплантату, з точки зору виживаності імплантату та стабільності тканин навколо імплантату (Sanz-Sánchez et al., 2018). На жаль, чи може збільшена товщина кістки навколо імплантату, пов'язана з повним покриттям відкритої поверхні імплантату, підтримувати здоров'я навколо імплантату, не було повністю з'ясовано.
Нещодавно була описана спрощена процедура збільшення кістки, а саме техніка субперіостального пері-імплантного збільшеного шару (SPAL), що базується на використанні періосту як бар'єрної мембрани та трансплантату як пристрою для створення простору для збільшення кістки під час встановлення імплантату (Trombelli, Severi, Pramstraller, Farina, 2018). Ефективність цієї техніки для виправлення дегісценції кістки навколо імплантату та/або для збільшення товщини кістки навколо імплантату була раніше повідомлена (Trombelli, Severi, Pramstraller, Farina, 2019), а її застосування також було досліджено при лікуванні дефектів пері-імплантиту (Trombelli et al. 2020). Метою даної ретроспективної серії випадків було оцінити умови тканин навколо імплантату в короткостроковій перспективі у пацієнтів, які отримали техніку SPAL, у порівнянні з пацієнтами з адекватною товщиною (≥2 мм) PBBP під час встановлення імплантату.
Матеріали та методи
2.1 Дизайн дослідження та етичні аспекти
Дане дослідження було спроектовано відповідно до керівництва STROBE, Додаток S1. Протокол був затверджений Етичним комітетом Area Vasta Emilia Centro, Італія (протокол № 637/2018/ Oss/UniFe, дата затвердження 12.12.2018). Кожен пацієнт надав письмову інформовану згоду перед хірургічним лікуванням. Усі клінічні процедури були виконані відповідно до Декларації Гельсінкі та Керівництва з Доброї клінічної практики (GCP).
2.2 Популяція дослідження
Записи пацієнтів, які пройшли імплантологічну протезну реабілітацію в період з грудня 2015 по липень 2018 року в Дослідному центрі вивчення пародонтальних та періімплантних захворювань Університету Феррари та в одній приватній стоматологічній клініці у Феррарі, були переглянуті для визначення відповідності пацієнтів критеріям участі в дослідженні. Включення пацієнтів до дослідження підлягало наступним критеріям:
- Непалючі або курці ≤10 сигарет на день на момент операції;
- Не діабетики або добре контрольовані діабетики (HbA1c ≤ 7%) на момент операції;
- Наявність клінічних параметрів та рентгенографічних обстежень для дослідження (див. “Параметри дослідження” для деталей).
- Не приймають препарати, що впливають на кістковий метаболізм (наприклад, біфосфонати, кортикостероїди);
- Пройшли імплантацію повністю в рідній кістці (з залишковою товщиною PBBP ≥2 мм після встановлення імплантату) або одночасно з технікою SPAL.
Включення імплантату до дослідження підпорядковувалося наступним критеріям:
- Встановлення в загоєному гребені (імплантати типу IV, Hämmerle, Chen, Wilson, 2004);
- Первинна стабільність, оцінювана за моментом вставки.
На основі умов PBBP на момент встановлення імплантату та його клінічного ведення пацієнти були розділені на три групи:
- Пацієнти з імплантатом/імплантатами, у яких залишкова товщина PBBP ≥2 мм після встановлення імплантату (контрольна група);
- Пацієнти з імплантатом/імплантатами, які були лікувані за технікою SPAL для корекції періімплантної кісткової дегісценції ≥3 мм одночасно з встановленням імплантату (група SPALdehiscence);
- Пацієнти з імплантатом/імплантатами, які були лікувані за технікою SPAL для збільшення тонкого (≤1 мм) PBBP одночасно з встановленням імплантату (група SPALthin).
2.3 Клінічні процедури
Перед встановленням імплантату всі пацієнти пройшли активну терапію для лікування каріозних уражень та пародонтальних захворювань і були включені в професійне обслуговування з частотою візитів, запланованих відповідно до інструменту оцінки PerioRisk (Trombelli, Farina, Ferrari, Pasetti, Calura, 2009, Trombelli et al., 2017).
Всі хірургічні процедури виконувалися двома досвідченими пародонтологами (Л.Т. та М.П.). Пацієнтам було введено 2 г амоксициліну + клавуланової кислоти (Аугментин, GlaxoSmithKline) за годину до операції. Місцева анестезія була досягнута за допомогою артикаїну з 1:100,000 епінефрину, введеного шляхом місцевої інфільтрації.
2.3.1 Хірургічні процедури—групи SPAL
У пацієнтів, у яких дефект декомпенсації або тонка PBBP під час імплантації були виправлені за допомогою техніки SPAL (малюнки 1 та 2 відповідно), хірургічний доступ до кісткового гребеня був виконаний, як описано раніше (Тромбеллі, Севері, Прамшталлер та Фаріна, 2018). Коротко, слизова оболонка була піднята на щічній стороні за допомогою дисекції з частковою товщиною з використанням леза 15C, а також тунельних ножів (KPAX, TKN1X та TKN2X, Hu-Friedy) з різними кутовими гострими краями відповідно до анатомічного розташування. Потім періостальна оболонка була піднята з кістки за допомогою періостального підйомника (PTROM, Hu-Friedy), створюючи кишеню, яка могла вмістити трансплантат. Повнотовстий клапоть був піднятий на оральній (язиковій/піднебінній) стороні.
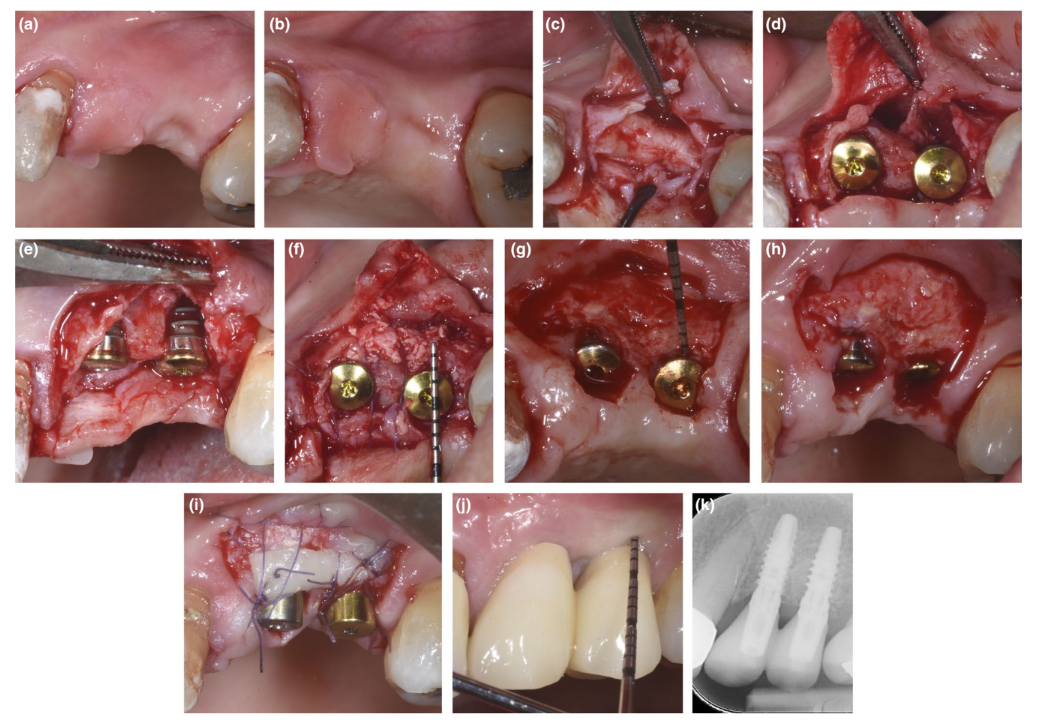
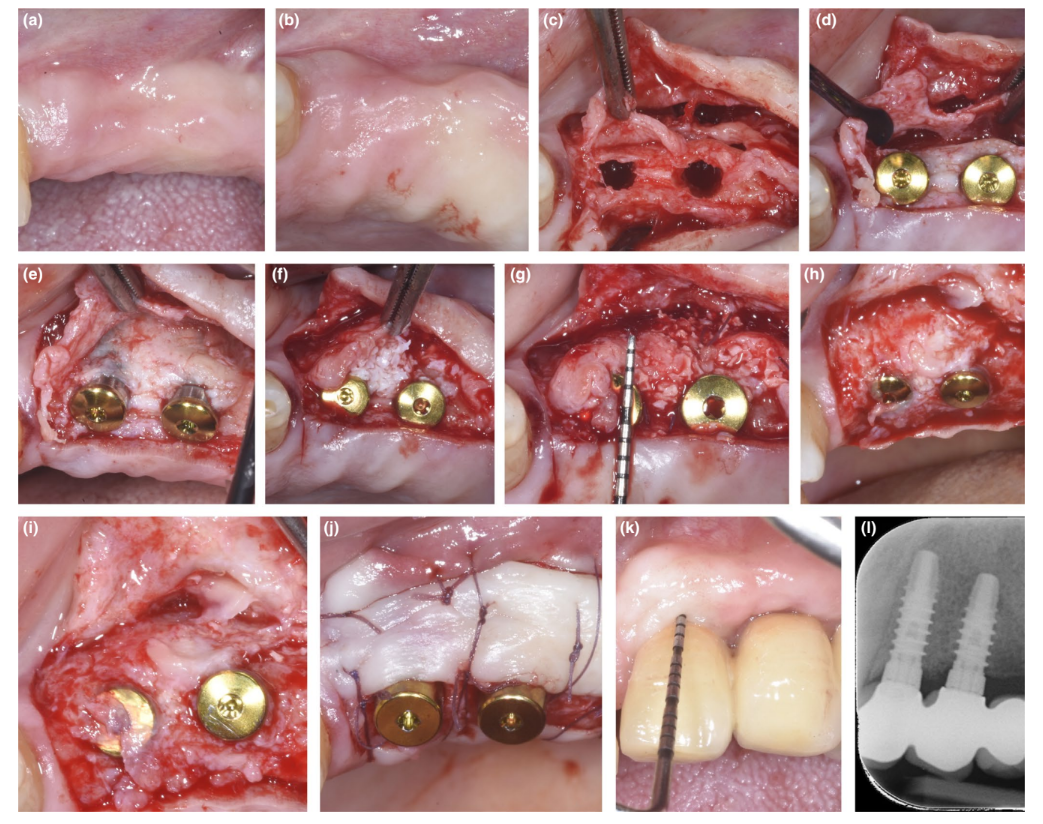
Імплантати на рівні тканин (SPI Element™; Thommen Medical) були встановлені. Використовувався ксено- пересадка на основі великої рогатої худоби (Bio-Oss® спонгіозні гранули, розмір частинок 0.25–1.0 мм; Geistlich Pharma, AG) самостійно або в комбінації з аутогенними кортикальними кістковими частинками для заповнення хірургічно створеного простору між періостальною оболонкою та або тонкою щічною кістковою пластинкою, або відкритою поверхнею імплантату. У разі наявності деhісценції, пересадка була виконана для повного виправлення дефекту навколо імплантату до полірувальної манжети. У всіх випадках підперіостальна пересадка забезпечувала щонайменше 2 мм товщини в найбільш корональній частині імплантату.
Корональна частина періостальної оболонки була стабілізована до орального мукоперіостального клаптя за допомогою резорбованих внутрішніх матрацних швів (Vicryl 6/0, Ethicon). Мукозна оболонка була потім коронально просунута і зашита без натягу за допомогою горизонтальних внутрішніх матрацних та перерваних швів, щоб занурити як пересадку, так і імплантати.
Під час повторного втручання для відкриття імплантату була дисектована щічна клаптева пластинка з частковою товщиною для розміщення загоювального абатмента. Для забезпечення адекватних розмірів кератинізованої періімплантної слизової або була виконана клаптева пластинка, розташована апікально, або вільна гінгівальна пересадка (Тромбеллі, Севері, Прамшталлер та Фаріна, 2019).
2.3.2 Хірургічні процедури — контрольна група
Була піднята щічна та мовна/небна клаптева пластинка повної товщини для оголення кісткового гребеня. Місце для імпланта було підготовлено відповідно до інструкцій виробника, і були вставлені імпланти рівня тканини (SPI Element™; Thommen Medical). Через наявність залишкової товщини PBBP ≥2 мм жодна процедура збільшення кістки не була виконана. У всіх випадках клапоть був підрізаний і розміщений навколо загоювального абатмента за допомогою розсмоктувальних швів (Vicryl 6/0, Ethicon). Дизайн клаптя та маніпуляції, а також техніка накладання швів були виконані для забезпечення адекватних розмірів (висота, товщина) кератинізованої періімплантної слизової.
2.3.3 Післяопераційні процедури
Пацієнтам було рекомендовано не носити жодних знімних протезів, щоб уникнути тиску на хірургічний ділянку принаймні протягом 4 тижнів, а також не жувати і не чистити зуби в обробленій зоні приблизно 2 тижні.
Для домашнього використання була призначена 0,12% розчин хлоргексидину (Curasept ADS Trattamento Rigenerante®; Curaden Healthcare) для хімічного контролю нальоту (ополоснути 1 хвилину двічі на день протягом 3 тижнів). Шви були видалені через 2 тижні після операції.
2.3.4 Час проведення протезування
Протезування розпочали через 3–4 місяці після встановлення імплантатів у контрольній групі, тоді як у групах SPAL - принаймні через 4 тижні після відкриття імплантатів.
2.4 Параметри дослідження
2.4.1 Клінічні параметри
Після 6 місяців протезування, підготовлений експерт (М.С.), який брав участь у попередніх дослідженнях техніки SPAL (Тромбеллі, Севері, Прамстраттлер, Фаріна, 2019), виконав наступні клінічні вимірювання за допомогою пародонтального зонда UNC-15 у наступній хронологічній послідовності:
- Висота кератинізованої слизової оболонки (KM): вимірюється на середньобукальному аспекті імплантату як відстань між букальною периімплантною слизовою межею та мукогінгівальним з'єднанням, і записується до найближчого міліметра;
- Рівень краю м'яких тканин (MSTL) (Цитцманн, Шарер, Марінелло, 2001): вимірюється на середньобукальному аспекті імплантату як відстань між букальною периімплантною слизовою межею та з'єднанням імплантату з абатментом, і записується до найближчого міліметра. MSTL записується як позитивний або негативний, коли край абатмента розташований вище або нижче слизової межі відповідно;
- Індекс нальоту (PlI; О'Лірі, Дрейк, Нейлор, 1972): записується на мезіобукальному, середньобукальному, дистобукальному, середньолінгвальному/піднебінному аспектах імплантату як наявність або відсутність супрагінгівального нальоту після дослідження юкстагінгівальної протезної межі зондом;
- Глибина зондування (PD): вимірюється від слизової межі до найглибшого проникнення зонда на шести ділянках (мезіобукальний, середньобукальний, дистобукальний, дистолінгвальний, середньолінгвальний та мезіолінгвальний) з використанням сили 0.2–0.3 Н, і записується до найближчого міліметра;
- Кровотеча при зондуванні (BoP; Аїнамо і Бей, 1975): записується як наявна або відсутня при оцінці PD;
- Гній при зондуванні (SoP): записується як наявний або відсутній при оцінці PD.
2.4.2 Радіографічний рівень кістки
Нестандартні періапікальні рентгенограми, зроблені за допомогою техніки паралельного зображення з довгим конусом через 6 місяців після протезування, були оцифровані та проаналізовані за допомогою спеціально розробленого програмного забезпечення (NIS elements v4.2; Nikon Instruments, Campi Bisenzio). Радіографічний рівень кістки (RBL) вимірювався як відстань (округлена до найближчих 0.1 мм) між апікальним краєм полірувальної манжети імплантату та кістковим гребенем на медіальному (mRBL) та дистальному (dRBL) аспектах кожного імплантату з використанням збільшення 10x–15x. Для калібрування використовувався контрольний маркер висотою 1 мм, присутній на цифровій рентгенограмі.
Одним експертом (А.С.) були виконані радіографічні вимірювання. Експерт брав участь у сесії калібрування на зразку рентгенограм, отриманих від пацієнтів, які не були обрані для даного дослідження. Сесія калібрування складалася з двох сесій вимірювань RBL, проведених з інтервалом у 7 днів, і дозволила досягти відмінної узгодженості між експертами (k score = 0.89), зі середньою різницею між парними вимірюваннями 0.04 ± 0.15 мм.
2.5 Статистичний аналіз
Пацієнт розглядався як статистична одиниця. Якщо два або більше імплантів у одного пацієнта відповідали критеріям дослідження, лише один імплант випадковим чином був включений для аналізу. Дані описувалися за допомогою середнього значення та стандартного відхилення (SD), медіани та міжквартильного діапазону (IR), мінімальних і максимальних значень для кількісних змінних, а також частоти та відсотка для категоріальних змінних.
Медіанне число ділянок з позитивним BoP, оцінених через 6 місяців після навантаження імпланта, було основною змінною результату дослідження. Медіанні значення PD, KM, MSTL, RBL, кількість ділянок з позитивним PlI та кількість ділянок з позитивним SoP були вторинними змінними результату.
Через обмежений розмір вибірки жодна інферентна статистика не проводилася, і результати були представлені у наративному форматі. Однак розмір ефекту (ES) був обчислений для кожної змінної результату відповідно до непараметричного тесту Крускала–Уолліса. ES класифікувався як малий (d = 0.1–0.3), середній (d = 0.3–0.5) або великий (d ≥ 0.5) (Коен, 1988).
Результати
3.1 Популяція дослідження
Тридцять чотири пацієнти з 34 імплантами (11 у групі SPALдефіцит, 11 у групі SPALтонкий та 12 у контрольній групі) були включені до аналізу. Переважна більшість пацієнтів були некурцями (90.9% у групі SPALдефіцит, 90.9% у групі SPALтонкий та 75% у контрольній групі). Імпланти в групі SPALдефіцит переважно розташовувалися в нижній щелепі, тоді як імпланти в групах SPALтонкий та контрольній групі переважно розміщувалися в верхній щелепі (Таблиця 1). Протягом періоду спостереження не було втрат пацієнтів або імплантів.
У групі SPALдеhisценція 1 пацієнт виявив розходження рани через 2 тижні, з частковим оголенням різьби імпланта. Пацієнта оглядали щомісяця до повторного втручання, а ділянка місцево дезінфікувалася розчином хлоргексидину 0,12% на кожному візиті.
У групах SPALдеhisценція та SPALтонка повторне втручання проводилося через 3–6 місяців після встановлення імпланта (медіана: 4,0 місяці в обох групах; p = 1; Таблиця 1). Товщина періімплантної кістки та висота і ширина періімплантної кісткової деhisценції, зафіксовані для груп SPALдеhisценція та SPALтонка, наведені в Таблицях 2 та 3 відповідно. У кожній групі SPAL 10 пацієнтів (90,9%) не мали періімплантної деhisценції в поєднанні з товщиною періімплантної кістки ≥2 мм (Таблиці 2 та 3). Один пацієнт у групі SPALдеhisценція мав залишкову деhisценцію 2 мм (Таблиця 2), яка була покрита вільним гінгівальним трансплантатом. Один пацієнт у групі SPALтонка мав товщину періімплантної кістки 1 мм без деhisценції (Таблиця 3).
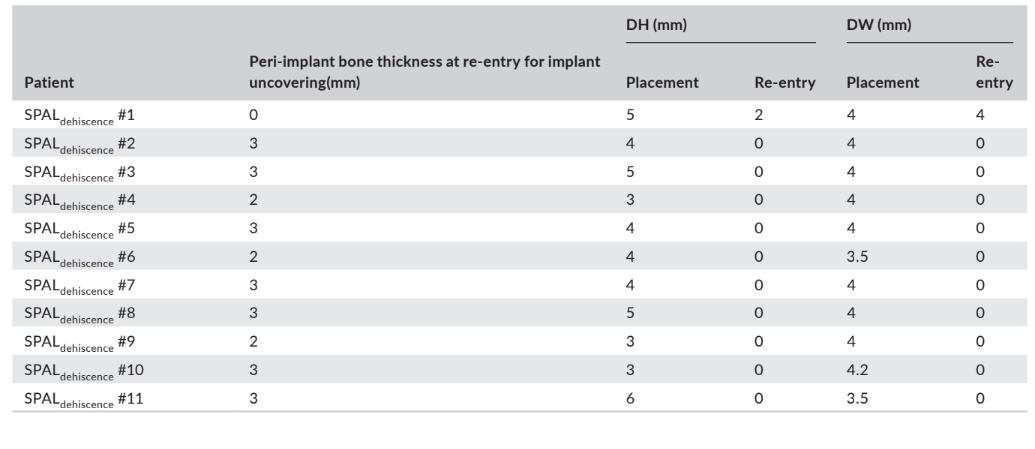
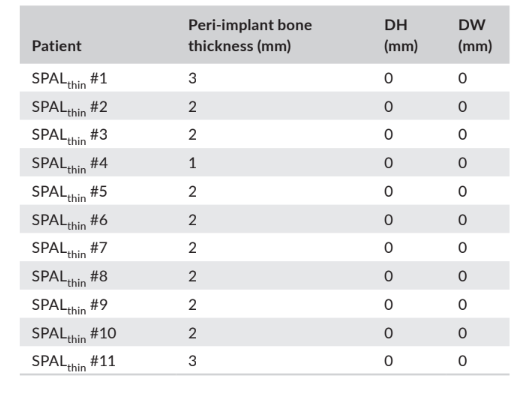
і ширина дегісценції (DH та DW відповідно), оцінені при повторному
вході для відкриття імплантату у кожного пацієнта групи SPALthin
У групі SPALdehiscence 8 імплантатів підтримували фіксовану часткову протезу, 2 імплантати були відновлені одиничною коронкою, а 1 імплантат був частиною надпротезу. У групі SPALthin 9 імплантатів підтримували фіксовану часткову протезу, 2 імплантати були відновлені одиничною коронкою, а 1 був частиною надпротезу. У контрольній групі 4 імплантати були частиною фіксованої часткової протези, а 8 імплантатів були відновлені одиничною коронкою.
3.2 Результати дослідження
Дані, пов'язані з клінічними результатами (тобто, PD, BoP, SoP, PlI, MSTL та KM) та RBL, оцінені через 6 місяців після навантаження імплантату, наведені в Таблиці 4.
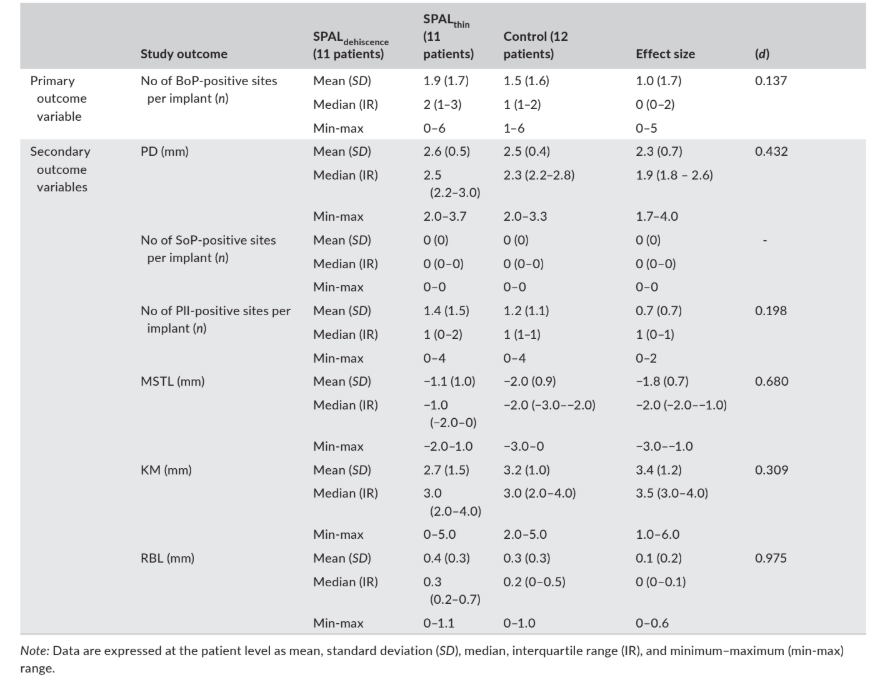
м'яких тканин на краю, MSTL; та ширина кератинізованої слизової, KM) та радіографічний рівень кістки (RBL), оцінені через 6 місяців після навантаження імплантату.
Медіана поширеності (кількість) позитивних ділянок BoP становила 2, 1 і 0 у групах SPALdehiscence, SPALthin та контрольній відповідно.
Медіана кількості позитивних ділянок PlI становила 1 у всіх групах. SoP був негативним на всіх імплантаційних ділянках.
Мукозний край розташовувався на 1 мм (група SPALdehiscence) або 2 мм (групи SPALthin та контрольна) вище з'єднання імплант–абатмент у всіх групах, а дослідницькі групи мали медіану KM не менше 3 мм.
Радіографічний рівень кістки становив 0.3 мм у групі SPALdehiscence, 0.2 мм у групі SPALthin та 0 мм у контрольній групі.
ES був малим для кількості позитивних ділянок BoP (d = 0.137) та PlI (d = 0.198), середнім для KM (d = 0.309), PD (d = 0.432) та MSTL (d = 0.680), і великим для RBL (d = 0.975) (Таблиця 4).
Обговорення
Метою даної ретроспективної серії випадків було оцінити умови періімплантних тканин у короткостроковій перспективі у пацієнтів, які отримали техніку SPAL, та у пацієнтів з адекватною товщиною (≥2 мм) PBBP під час встановлення імплантату. Результати показали, що пацієнти, які проходили лікування за технікою SPAL, мали низьку кількість запалених періімплантних ділянок і незначну глибину зондації (PD <4 мм) через 6 місяців після протезування. Також, рівень міжзубної кістки був виявлений апікально (хоча в обмеженій мірі) до полірованого коміра імплантату лише в групах SPAL.
Кровотеча при зондируванні була обрана як первинний результат, оскільки (a) оцінка BoP в даний час вважається клінічним показником для розрізнення між здоров'ям і захворюванням періімплантних тканин, будучи незмінним діагностичним елементом періімплантного мукозиту та періімплантиту (Renvert, Persson, Pirih, Camargo, 2018, Berglundh et al., 2018), і (b) її відсутність асоціюється зі стабільністю умов періімплантних тканин (Jepsen, Rühling, Jepsen, Ohlenbusch, Albers, 1996, Luterbacher, Mayfield, Brägger, Lang, 2000). Пропорція запалених періімплантних ділянок, зафіксована в дослідницьких групах, порівнюється з попередніми даними, які оцінювали поширеність BoP на 289 імплантатах (Farina, Filippi, Brazzioli, Tomasi, Trombelli, 2017). Також подібні запальні умови періімплантних тканин були зафіксовані через 18 місяців після GBR (Jung et al., 2017).
У нашому дослідженні було виявлено низьку частоту запалених періімплантних слизових ділянок у всіх групах дослідження. Це може бути частково пов'язано з подібними характеристиками факторів, які впливають на кровоточивість ясен навколо імплантів, такими як низька присутність юкстагінгівального нальоту (Pontoriero et al., 1994; Salvi et al., 2012), неглибокий пародонтальний зонд (Farina, Filippi, Brazzioli, Tomasi, & Trombelli, 2017) та адекватна кількість кератинізованої слизової (Chung, Oh, Shotwell, Misch, Wang, 2006, Perussolo et al., 2018). Наші результати узгоджуються з тими, що випливають з нещодавнього систематичного огляду біологічних ускладнень зубних імплантів, встановлених як на чистих, так і на збільшених ділянках. Мета-аналіз показав подібну поширеність періімплантного мукозиту у пацієнтів, які отримували (19.6%; 95% CI: 0%–40%) або не отримували (22.4%; 95% CI: 6%–38%) процедури збереження альвеолярного гребеня та/або вертикального/бічного збільшення гребеня (Salvi, Monje, Tomasi, 2018). Також були повідомлення про подібні запальні стани у імплантів, встановлених у рідній кістці, в порівнянні з імплантами, встановленими одночасно з процедурою GBR (Benic, Jung, Siegenthaler, Hammerle, 2009; Benic, Bernasconi, Jung, Hammerle, 2017).
Варто зазначити, що під час повторного входу велика більшість пацієнтів, які отримали техніку SPAL, показали товщину кістки навколо імплантату ≥2 мм у найбільш корональній частині імплантату. Хоча вимірювання PBBP не було доступне під час повторного входу для контрольної групи (одностадійна процедура), цілісність PBBP після поствставного ремоделювання кістки навколо імплантату може бути припущена на основі доклінічних (Monje та ін., 2019) та клінічних (Spray, Black, Morris, & Ochi, 2000) даних про критичні розміри щічної кісткової пластинки. Загалом, доступні дані, здається, вказують на те, що адекватні вертикальні та горизонтальні розміри тканин навколо імплантату, досягнуті за допомогою процедур збільшення, можуть сприяти умовам, які обмежують запалення тканин навколо імплантату. Однак зв'язок між цілісністю PBBP до найбільш корональної частини імплантату та тяжкістю запалення слизової оболонки навколо імплантату не зовсім зрозумілий (Jung et al., 2017).
На 6 місяці протезування було виявлено різне положення міжпроксимального рівня кістки навколо імплантата серед груп, з більш апікальним RBL у групах SPAL. Варто зазначити, що в групах SPAL імплантати рівня тканини були розташовані трохи субкресально (Рисунки 1 та 2). Хоча це могло полегшити трансплантацію періостального мішка до найбільш корональної частини імплантата, а також закриття первинного наміру, субкресальне розташування також могло сприяти міжпроксимальному ремоделюванню кістки (Saleh et al., 2018). Більше того, оскільки імплантати, що отримали техніку SPAL, підлягали додатковій хірургії для відкриття, включаючи апікально розташований клапоть або вільний гінгівальний трансплантат, міжпроксимальне ремоделювання кістки в групах SPAL також може частково пояснюватися негативним впливом підняття клаптя на місцеве кровопостачання. Послідовно, маргінальна втрата кістки навколо імплантата була зафіксована між повторним входом для відкриття та остаточною доставкою протеза іншими авторами (Cardaropoli, Lekholm, Wennstrom, 2006, Nader et al., 2016). Також слід врахувати, що у деяких пацієнтів групи SPALдефіцит трансплантація була розширена на мезіальні та/або дистальні аспекти імплантата через міжпроксимальне розширення дефекту кістки навколо імплантата. У групі SPALдефіцит тому обсяг ремоделювання трансплантата на міжпроксимальних ділянках міг негативно вплинути на значення RBL. Останні дані показали, що навіть повільно резорбовані біоматеріали для трансплантації, такі як DBBM, асоціюються з суттєвим зменшенням трансплантованої площі при 12-місячній рентгенографічній оцінці після ендосинусних процедур збільшення (Franceschetti et al., 2019). Однак величина RBL, зафіксована в даному дослідженні, обмежена в порівнянні з тією, що була зафіксована для імплантатів, розміщених з одночасним GBR або в природній кістці (Urban et al., 2019) та імплантатів з нелікованим щічним дефіцитом (Jung et al., 2017).
Для групи SPALдеhісценція було спостережено трохи нижчі KM та MSTL. Це сталося незважаючи на те, що маніпуляції з м'якими тканинами навколо імплантів були адекватно виконані для забезпечення належних розмірів кератинізованої пері-імплантної слизової та підясеневого положення протезних країв. Це спостереження може бути частково пов'язане з підвищеним ремоделюванням кістки (RBL), яке спостерігалося в групі SPALдеhісценція, що також могло включати відновлену щічну кісткову пластину. Нещодавній систематичний огляд пов'язав ремоделювання щічної кістки з виникненням рецесії м'яких тканин навколо імплантів (Aizcorbe-Vicente, Peñarrocha-Oltra, Canullo, Soto-Peñaloza, & Peñarrocha-Diago, 2020). У групі SPALдеhісценція 1 пацієнт (9.1%) зазнав розкриття рани через 2 тижні, що призвело до часткового оголення різьби імпланта при повторному вході. Це спостереження порівнюється з випадками розкриття рани та відповідним оголенням мембрани після процедур GBR для корекції кісткової деhісценції навколо імплантів під час встановлення, як повідомляється в нещодавньому мета-аналізі, проведеному на основі як проспективних, так і ретроспективних досліджень (Garcia et al., 2018). Зокрема, оголення мембрани сталося з частотою від 16.7% (Tawil, El-Ghoule, & Mawla, 2001) до 62.8% (Gher, Quintero, Assad, Monaco, & Richardson, 1994) і було пов'язане з істотно нижчим покриттям деhісценції (Garcia et al., 2018). Обмеження цього попереднього звіту включають ретроспективний дизайн, малий розмір вибірки та короткий період спостереження в 6 місяців після відновлення імплантів. Крім того, вплив факторів, пов'язаних з пацієнтом (наприклад, товщина м'яких тканин в беззубій зоні, звичка курити, діабет) та ускладнень, пов'язаних з хірургією (наприклад, перфорації періостальної та/або слизової оболонки), на клінічні результати не було всебічно проаналізовано. Більше того, для лікування SPAL були обрані специфічні клінічні умови (тобто тонка PBBP або кісткова деhісценція навколо імплантів з обмеженими вертикальними розмірами). Потрібні подальші дослідження, щоб оцінити, які клінічні умови/ушкодження можуть бути ефективно лікувані за допомогою техніки SPAL або чи слід віддати перевагу більш традиційному лікуванню (наприклад, GBR).
У висновку, результати даного дослідження показали, що після 6 місяців протезування пацієнти, які проходили лікування за технікою SPAL, демонструють обмежене запалення періімплантної слизової у поєднанні з неглибокою ПД та адекватною КМ. Однак у імплантатів, які отримали техніку SPAL, було виявлено інтерпроксімальну RBL, що знаходиться апікально від її ідеального положення. Потрібно оцінити, чи можуть і в якій мірі сприятливі короткострокові результати, спостережувані після техніки SPAL, бути корисними для довгострокових здорових умов періімплантних тканин та стабільності щічного слизового профілю.
Леонардо Тромбеллі, Маттіа Прамстраллер, Маттіа Севері, Анна Сімонеллі, Роберто Фаріна
Посилання
- Айнамо, Й., & Бей, І. (1975). Проблеми та пропозиції щодо реєстрації гінгівіту та нальоту. Міжнародний стоматологічний журнал, 25, 229–235.
- Айсорбе-Вісенте, Й., Пеньярроха-Ольтра, Д., Канулло, Л., Сото-Пеньялоза, Д., & Пеньярроха-Діаго, М. (2020). Вплив товщини обличчя кістки після імплантації в загоєні гребені на відремонтовану обличчя кістку та з урахуванням рецесії м'яких тканин: Систематичний огляд. Міжнародний журнал оральних та щелепно-лицевих імплантатів, 35, 107–119. https://doi.org/10.11607/jomi.7259
- Беніć, Г. І., Бернасконі, М., Юнг, Р. Е., & Хаммерле, К. Х. Ф. (2017). Клінічне та рентгенографічне внутрішньо-суб'єктне порівняння імплантатів, розміщених з або без керованої регенерації кістки: 15-річні результати. Журнал клінічної пародонтології, 44, 315–325. https://doi.org/10.1111/jcpe.12665
- Беніć, Г. І., Юнг, Р. Е., Зігенталер, Д. В., & Хаммерле, К. Х. Ф. (2009). Клінічне та рентгенографічне порівняння імплантатів у відновленій або природній кістці: 5-річні результати. Клінічні оральні імплантні дослідження, 20, 507–513. https://doi.org/10.1111/j.1600-0501.2008.01583.x
- Берґлунд, Т., Армітаж, Г., Араухо, М. Г., Авіла-Ортіс, Г., Бланко, Й., Камарго, П. М., Зітцманн, Н. (2018). Періімплантні захворювання та стани: Консенсусний звіт робочої групи 4 Всесвітнього семінару 2017 року з класифікації пародонтальних та періімплантних захворювань і станів. Журнал клінічної пародонтології, 45(доповнення 20), S286–S291. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Кардорополі, Г., Лекгольм, У., & Венстром, Й. Л. (2006). Зміни тканин при імплантатах, підтримуваних одиночними зубними заміщеннями: 1-річне проспективне клінічне дослідження. Клінічні оральні імплантні дослідження, 17, 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x
- Чунг, Д. М., О, Т. Й., Шотвелл, Й. Л., Міш, К. Е., & Ванг, Х. Л. (2006). Значення кератинізованої слизової для підтримки зубних імплантатів з різними поверхнями. Журнал пародонтології, 77, 1410–1420. https://doi.org/10.1902/jop.2006.050393
- Коен, Й. (1988). Статистичний аналіз потужності для поведінкових наук, 2-ге вид. Махва, НД: Лоуренс Ерлбаум Ассошіейтед Паблішерс.
- Фаріна, Р., Філіппі, М., Браззіолі, Й., Томасі, К., & Тромбеллі, Л. (2017). Кровотеча при зондуванні навколо зубних імплантатів: Ретроспективне дослідження асоційованих факторів. Журнал клінічної пародонтології, 44, 115–122. https://doi.org/10.1111/jcpe.12647
- Франческетті, Г., Фаріна, Р., Міненна, Л., Ріккарді, О., Стаччі, К., Ді Раймондо, Р., … Тромбеллі, Л. (2019). Вплив ремоделювання трансплантату на підтримку періімплантної кістки при імплантатах, розміщених одночасно з транс-крестальним підняттям синусового дна: Мультицентрове, ретроспективне серійне дослідження. Клінічні оральні імплантні дослідження, 31(2), 1–16. https://doi.org/10.1111/clr.13541
- Гарсія, Й., Додж, А., Лупке, П., Ванг, Х. Л., Капіла, Й., & Лін, Г. Х. (2018). Вплив експозиції мембрани на керовану регенерацію кістки: Систематичний огляд та мета-аналіз. Клінічні оральні імпланти, 29, 328–338. https://doi.org/10.1111/clr.13121
- Гер, М. Е., Кінтеро, Г., Ассад, Д., Монако, Е., & Річардсон, А. С. (1994). Кісткові трансплантати та керована регенерація кістки для негайних зубних імплантатів у людей. Журнал пародонтології, 65, 881–891. https://doi.org/10.1902/jop.1994.65.9.881
- Хаммерле, К. Х., Чен, С. Т., & Вілсон, Т. Г. молодший (2004). Консенсусні заяви та рекомендовані клінічні процедури щодо розміщення імплантатів у екстракційних лунках. Міжнародний журнал оральних та щелепно-лицевих імплантатів, 19(доповнення), 26–28.
- Єпсен, С., Рюлінг, А., Єпсен, К., Оленбуш, Б., & Альберс, Г. К. (1996). Прогресуючий періімплантит. Частота та прогноз втрати прикріплення періімплантного. Клінічні оральні імпланти, 7, 133–142. https://doi.org/10.1034/j.1600-0501.1996.070207.x
- Юнг, Р. Е., Герцог, М., Воллеб, К., Рамель, К. Ф., Тома, Д. С., & Хаммерле, К. Х. Ф. (2017). Рандомізоване контрольоване клінічне дослідження, що порівнює невеликі щічні дефекти декісенції навколо зубних імплантатів, які лікувалися керованою регенерацією кістки або залишалися для спонтанного загоєння. Клінічні оральні імплантні дослідження, 28, 348–354. https://doi.org/10.1111/clr.12806
- Лютербахер, С., Мейфілд, Л., Бреггер, У., & Ланг, Н. П. (2000). Діагностичні характеристики клінічних та мікробіологічних тестів для моніторингу стану пародонтальних та періімплантних слизових тканин під час підтримуючої пародонтальної терапії (SPT). Клінічні оральні імплантні дослідження, 11, 521–529. https://doi.org/10.1034/j.1600-0501.2000.011006521.x
- Мереб, Й., Веркруйссен, М., Коук, В., Беккерс, Л., Тейгельс, В., & Квірінен, М. (2017). Доля щічної кістки навколо зубних імплантатів. 12-місячне спостереження після навантаження. Клінічні оральні імплантні дослідження, 28, 103–108. https://doi.org/10.1111/clr.12767
- Монже, А., Чаппуйс, В., Монже, Ф., Муньйоз, Ф., Ванг, Х. Л., Урбан, І. А., & Бусер, Д. (2019). Критична товщина щічної кісткової стінки навколо імплантатів: експериментальне дослідження на собаках біглів. Int J Oral Maxillofac Implants, 34, 1328–1336. https://doi.org/10.11607/jomi.7657
- Надер, Н., Абулхосн, М., Бербері, А., Манал, С., & Юнес, Р. (2016). Ремоделювання краю кістки навколо загоювального абатмента порівняно з розміщенням остаточного абатмента на другій стадії хірургії: 12-місячне рандомізоване клінічне дослідження. Журнал сучасної стоматологічної практики, 17, 7–15. https://doi.org/10.5005/jp-journals-10024
- О'Лірі, Т. Дж., Дрейк, Р. Б., & Нейлор, Дж. Е. (1972). Запис контролю нальоту. Журнал пародонтології, 43, 38. https://doi.org/10.1902/jop.1972.43.1.38
- Перуссоло, Й., Соуза, А. Б., Матараццо, Ф., Олівейра, Р. П., & Араухо, М. Г. (2018). Вплив кератинізованої слизової на стабільність періімплантних тканин та дискомфорт при чищенні: 4-річне спостереження. Клінічні оральні імплантні дослідження. Журнал клінічної пародонтології, 29, 1177–1185. https://doi.org/10.1111/clr.13381
- Понторіеро, Р., Тонеллі, М. П., Карневаль, Г., Момбеллі, А., Німан, С. Р., & Ланг, Н. П. (1994). Експериментально викликаний періімплантний мукозит. Клінічне дослідження на людях. Клінічні оральні імпланти, 5, 254–259. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Ренверт, С., Перссон, Г. Р., Піріх, Ф. Q., & Камарго, П. М. (2018). Здоров'я періімплантів, періімплантний мукозит та періімплантит: Визначення випадків та діагностичні міркування. Журнал клінічної пародонтології, 45(доповнення 20), S278–S285. https://doi.org/10.1111/jcpe.12956
- Салех, М. Х. А., Равіда, А., Суарез-Лопес Дель Амо, Ф., Лін, Г.-Х., Асаад, Ф., & Ванг, Х.-Л. (2018). Вплив положення з'єднання імплантат-абатмент на втрату кістки: Систематичний огляд та мета-аналіз. Клінічна імплантаційна стоматологія та супутні дослідження, 20, 617–633. https://doi.org/10.1111/cid.12600
- Сальві, Г. Е., Аглієтта, М., Ейк, С., Скулян, А., Ланг, Н. П., & Рамсейєр, К. А. (2012). Зворотність експериментального періімплантного мукозиту в порівнянні з експериментальним гінгівітом у людей. Клінічні оральні імпланти, 23, 182–190. https://doi.org/10.1111/j.1600-0501.2011.02220.x
- Сальві, Г. Е., Монже, А., & Томасі, К. (2018). Довгострокові біологічні ускладнення зубних імплантатів, розміщених як у чистих, так і в розширених місцях: Систематичний огляд та мета-аналіз. Клінічні оральні імпланти, 29(доповнення 16), 294–310. https://doi.org/10.1111/clr.13123
- Санц-Санчез, І., Каррільо де Альборноз, А., Фігеро, Е., Шварц, Ф., Юнг, Р., Санц, М., & Тома, Д. (2018). Впливи процедур бічного збільшення кістки на здоров'я або захворювання періімплантів: Систематичний огляд та мета-аналіз. Клінічні оральні імпланти, 29, 18–31. https://doi.org/10.1111/clr.13126
- Санц-Санчез, І., Ортіс-Вігон, А., Санц-Мартін, І., Фігеро, Е., & Санц, М. (2015). Ефективність бічного збільшення кістки на розмір альвеолярного гребеня: Систематичний огляд та мета-аналіз. Журнал стоматологічних досліджень, 94, 1s–15s. https://doi.org/10.1177/0022034515594780
- Шварц, Ф., Сахм, Н., & Беккер, Й. (2012). Вплив результатів керованої регенерації кістки в дефектах типу декісенції на довгострокову стабільність здоров'я періімплантів: Клінічні спостереження через 4 роки. Клінічні оральні імпланти, 23, 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x
- Спрай, Й. Р., Блек, К. Г., Морріс, Х. Ф., & Очі, С. (2000). Вплив товщини кістки на реакцію щічної краю кістки: Розміщення на стадії 1 через стадію 2. Аннали пародонтології, 5, 119–128. https://doi.org/10.1902/annals.2000.5.1.119
- Тавіл, Г., Ель-Гул, Г., & Мавла, М. (2001). Клінічна оцінка біляшарної колагенової мембрани (біо-гід) з підтримкою аутотрансплантатів у лікуванні кісткових дефектів навколо імплантатів. Міжнародний журнал оральних та щелепно-лицевих імплантатів, 16, 857–863.
- Тома, Д. С., Бьєнц, С. П., Фігеро, Е., Юнг, Р. Е., & Санц-Мартін, І. (2019). Впливи процедур збільшення м'яких тканин на здоров'я або захворювання періімплантів: Систематичний огляд та мета-аналіз. Журнал клінічної пародонтології, 46(доповнення 21), 257–276. https://doi.org/10.1111/jcpe.13050
- Тромбеллі, Л., Фаріна, Р., Феррарі, С., Пасетті, П., & Калура, Г. (2009). Порівняння двох методів оцінки ризику пародонтозу. Мінева стоматологічна, 58, 277–287.
- Тромбеллі, Л., Міненна, Л., Тоселлі, Л., Заєтта, А., Чеккі, Л., Чеккі, В., … Фаріна, Р. (2017). Прогностична цінність спрощеного методу оцінки ризику пародонтозу під час підтримуючої пародонтальної терапії. Журнал клінічної пародонтології, 44, 51–57. https://doi.org/10.1111/jcpe.12645
- Тромбеллі, Л., Севері, М., Фаріна, Р., & Сімонеллі, А. (2020). Техніка підперіостального періімплантного збільшеного шару для лікування періімплантних уражень. Клінічні досягнення в пародонтології. https://doi.org/10.1002/ cap.10107. [Epub ahead of print].
- Тромбеллі, Л., Севері, М., Прамстраллер, М., & Фаріна, Р. (2018). Техніка підперіостального періімплантного збільшеного шару для горизонтального збільшення кістки під час імплантації. Мінева стоматологічна, 67, 217–224. https://doi.org/10.23736/S0026-4970.18.04161-4
- Тромбеллі, Л., Севері, М., Прамстраллер, М., & Фаріна, Р. (2019). Спрощене управління м'якими тканинами для збільшення кістки навколо імплантатів. Міжнародний журнал оральних та щелепно-лицевих імплантатів, 34, 197–204. https://doi.org/10.11607/jomi.6959
- Урбан, І. А., Вессінг, Б., Аландез, Н., Мелоні, С., Гонсалес-Мартін, О., Поліцці, Г., … Зехнер, В. (2019). Мультицентрове рандомізоване контрольоване дослідження з використанням нової колагенової мембрани для керованої регенерації кістки на декісенційних місцях імплантатів: Результат при протезуванні та через 1 рік спостереження. Клінічні оральні імпланти, 30, 487–497. https://doi.org/10.1111/clr.13426
- Зітцманн, Н. У., Шарер, П., & Марінелло, С. П. (2001). Довгострокові результати імплантатів, які лікувалися керованою регенерацією кістки: 5-річне проспективне дослідження. Міжнародний журнал оральних та щелепно-лицевих імплантатів, 16, 355–366.