Підняття гайморової пазухи через кістковий гребінь з імплантатом з внутрішнім L-подібним каналом: результати через 1 рік після навантаження з проспективного когортного дослідження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Мета: Оцінити клінічні та рентгенографічні результати процедури підняття синуса з одного етапу за допомогою системи імплантатів з саморізами (iRaise, Maxillent, Герцлія, Ізраїль), розробленої для збільшення синуса, через 1 рік після навантаження.
Матеріали та методи: Пацієнти, які потребують відновлення в задній частині верхньої щелепи з залишковим альвеолярним гребенем висотою від 3 до 8 мм і шириною 5 мм дистально до іклового зуба, як було виміряно на КТ, були лікувані за допомогою системи підняття синуса iRaise. Критерії оцінки результатів: невдачі імплантатів і протезів, будь-які ускладнення, збільшення висоти кістки (iBH), втрата краєвої кістки (MBL), коефіцієнт стабільності імплантата (ISQ), рентгенографічні патерни ремоделювання тканин за допомогою індексу ремоделювання синусового трансплантату (SGRI), об'ємні вимірювання синусового трансплантату, самозвіт пацієнта про післяопераційне набрякання, споживання знеболювальних засобів та гістологічний аналіз.
Результати: Усього 30 послідовних учасників з середнім віком 54.2 ± 9.4 роки пройшли транс-крестальне підняття синусової мембрани, встановлення кісткового трансплантату та імплантацію. Було встановлено 50 імплантів (30 імплантів системи iRaise та 20 додаткових імплантів iSure, Maxillent). Середній термін спостереження становив 15.8 ± 2.1 місяців після навантаження імплантів. Один пацієнт вибув з дослідження на річному контрольному обстеженні після навантаження. Протягом всього періоду спостереження не було жодного випадку відмови імплантів чи протезів. Один пацієнт зазнав невеликого розриву мембрани. Перед установкою імпланта середня висота залишкової альвеолярної гребінки становила 4.64 ± 0.86 мм (діапазон: 3.4–6.4 мм; 95% ДІ: 4.39–5.01 мм). Через рік після навантаження висота кістки становила 16.86 ± 3.13 мм (95% ДІ 15.83–18.07 мм). На контрольному обстеженні через рік після навантаження середній MBL становив 0.19 ± 1.05 мм (95% ДІ 0.02–0.78 мм). Середній ISQ під час установки імпланта становив 65.2 ± 5.4 (95% ДІ 63.6–67.4) і зростав протягом періоду загоєння, досягаючи середнього значення 73.6 ± 3.7 (95% ДІ 73.1–75.9; діапазон 62–79). Різниця була статистично значущою (8.4 ± 5.3; 95% ДІ 5.9–39.7; P = 0.0000). Через рік після навантаження оцінювалися бали SGRI в 23 імплантах. Загалом середнє значення SGRI становило 2.29 ± 2.41 мм (95% ДІ 1.22–2.98 мм). Об'єм кістки під час установки імпланта становив 2.41 ± 0.25 CC (95% ДІ 2.22–2.48 CC). Протягом 6-місячного періоду зануреного загоєння спостерігалася незначна констрикція кістки на 11.3% (2.13 ± 0.24 CC; 95% ДІ 2.02–2.26; різниця = 0.27 ± 0.25 CC; 95% ДІ 0.10–0.36; P = 0.0011). На першому році після навантаження кістковий трансплантат залишався стабільним (2.11 ± 0.22 CC; 95% ДІ 2.02–2.24). Різниця не була статистично значущою (0.02 ± 0.07 CC; 95% ДІ 0.01–0.04; P = 0.2166). З точки зору пацієнтів середнє значення болю становило 0.52 ± 0.74 (діапазон 0–3); середнє значення набряку становило 0.27 ± 0.52 (діапазон 0–2); а середнє споживання анальгетиків становило 0.87 ± 4.94 таблеток (діапазон 0–4) через 3 дні після операції. Морфологічні та гістоморфометричні аналізи показали, що всі зразки мали нормальну структуру без запального інфільтрату через шість місяців після загоєння. Було виявлено такі фракції (%): кістка (незріла кістка + зріла кістка): 44.07 ± 4.91; залишковий біоматеріал: 23.98 ± 2.64; медулярні простори: 31.95 ± 3.16.
Висновки: Підвищення дна синуса може бути успішно виконано за допомогою транс-крестального підходу з використанням спеціалізованої імплантаційної системи. Під час перших 6 місяців загоєння спостерігалася фізіологічна скорочення об'єму кісткового трансплантату на 11,3% від початкового об'єму; після цього додаткового зменшення об'єму трансплантату не спостерігалося. Необхідні довгострокові клінічні дослідження для підтвердження цих попередніх результатів.
Вступ
Поетапне підвищення дна синуса є звичайним рішенням для встановлення імплантатів у випадках важкої атрофії верхньої щелепи. Однак підвищення дна верхньощелепного синуса за допомогою латерального підходу передбачає виконання великого слизового періостального клаптя, що неминуче впливає на післяопераційне відновлення та додаткові витрати на процедуру підвищення. Перфорації синусової мембрани, носова кровотеча, післяопераційний біль, набряк, гематома та інфекція синуса є можливими ускладненнями.
Підняття піднебінного синуса через альвеолярний гребінь (трансальвеолярне) вперше було описано Татумом наприкінці 1970-х років і вперше опубліковано Бойн у 1980 році. Техніка неодноразово модифікувалася. Основні проблеми цієї техніки - обмежена кількість збільшення кістки, відсутність візуального доступу до ділянки, ризик перфорації мембрани Шнайдера та післяопераційні симптоми.
Закрите транс-крестальне гідравлічне підняття мембрани Шнайдера та одночасне збільшення кісткового трансплантату можуть бути виконані за допомогою спеціалізованого стоматологічного імплантату. Цей підхід головним чином відрізняється від раніше описаних гідравлічних технік тим, що підняття мембрани Шнайдера та кістковий трансплантат виконуються через імплантат.
В загальному, процедури підняття синуса адекватно збільшують вертикальний розмір резорбованого альвеолярного процесу в задній частині верхньої щелепи, що дозволяє розміщення імплантатів достатньої довжини. Обсяг скорочення трансплантату, про який повідомляється в літературі, коливається від 20% до 50% як для аутогенної кістки, так і для кісткових замінників, таких як демінералізований заморожений кістковий аллограт (DFDBA), мінералізований заморожений кістковий аллограт (FDBA) та ксенограти. В останні роки популярність здобули резорбовані біокераміки, виготовлені з суміші гідроксиапатиту та бета-три кальцій фосфату, які демонструють біоактивність та остеокондуктивність у різних гістологічних дослідженнях. Проте використання кісткових замінників викликає сумніви, коли присутня висота кістки більше 3 мм.
Проміжний 6-місячний звіт з цього дослідження щодо перших 18 пацієнтів показав фізіологічну скорочення обсягу первинного кісткового трансплантату на 13,9% за допомогою системи підняття синуса iRaise. У даному дослідженні оцінювали клінічні та радіографічні результати процедури підняття синуса на одному етапі з використанням саморізного ендоосального імплантату (iRaise, Maxillent, Херцлія, Ізраїль), розробленого для збільшення синуса, з використанням конусно-променевої комп'ютерної томографії (КТ) через 1 рік після навантаження. Це дослідження дотримувалося принципів Посилення звітності спостережних досліджень в епідеміології (STROBE) для покращення якості спостережних досліджень (http://www.strobe-statement.org).
Матеріали та методи
Це дослідження було спроектовано як перспективне спостережне дослідження. Пацієнти лікувалися в приватній практиці в Римі, Італія, між вереснем і груднем 2014 року. Всім пацієнтам було повідомлено про природу дослідження, і вони надали письмову згоду на хірургічні та протезні процедури, а також на використання клінічних і радіологічних даних. Хірургічні процедури виконували два клініцисти (MT та SMM), які мають великий досвід у встановленні імплантатів та процедурах збільшення синуса.
Послідовні пацієнти віком 18 років і старше, які можуть підписати інформовану згоду, що потребують відновлення на імплантатах для реабілітації їх атрофічної задньої щелепи, вважалися такими, що підлягають включенню. Вибране місце повинно було мати залишковий альвеолярний гребінь висотою не менше 3-8 мм і шириною 5 мм дистально до canine, виміряний на CBCT-скані.
Критерії виключення були:
- Загальні протипоказання до імплантаційної хірургії;
- Піддані опроміненню в області голови та шиї < 1 року до імплантації;
- Неконтрольований діабет;
- Вагітні або ті, що годують;
- Зловживання речовинами;
- Важкі курці (≥ 11 сигарет/день);
- Психіатрична терапія або нереалістичні очікування;
- Імунодефіцит або імунокомпрометовані;
- Лікувані або під лікуванням оральними або внутрішньовенними амінобісфосфонатами;
- Відсутність протилежної оклюзійної зубної дентції/протезу в зоні, призначеній для встановлення імплантату;
- Сильний бруксизм або стиснення;
- Заживлені місця (принаймні 3 місяці після видалення зубів);
- Нелікована пародонтит;
- Погана гігієна рота та мотивація (кровотеча з усієї ротової порожнини при зондуванні та індекс зубного нальоту > 25%);
- Пацієнти, які беруть участь в інших дослідженнях, якщо це заважає належному дотриманню поточного протоколу.
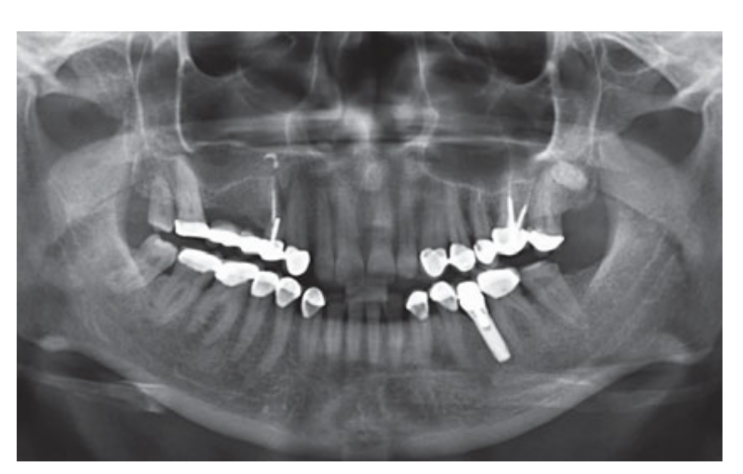
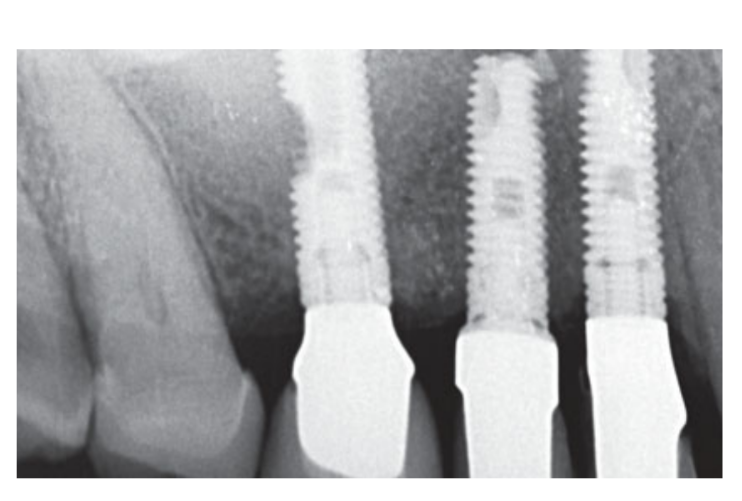
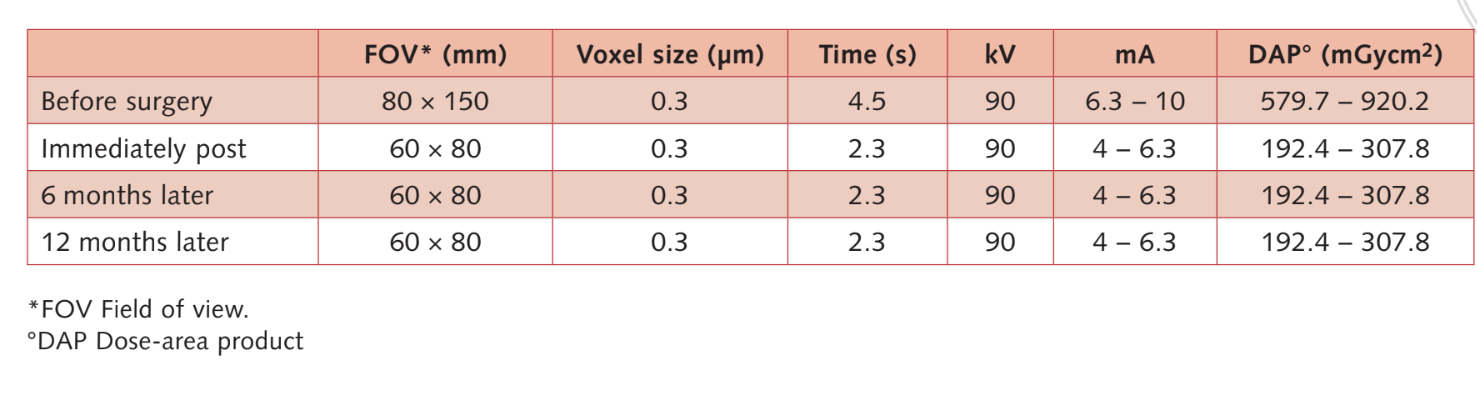
Помірні курці були включені, а пацієнти були класифіковані як некурці або помірні курці (≤ 10 сигарет/день). Передопераційні панорамні або періапікальні рентгенограми та зображення використовувалися для початкового скринінгу (Рис. 1 та 2). КТ з конусним променем проводили для кожного пацієнта протягом 2 тижнів перед операцією (поле зору 80 A~ 150 мм; розмір вокселя 0.3 мкм; 4.5 с; 90 кВ; 6.3–10 мА; 579.7–920.9 мГр см2), відразу після процедури, через 6 місяців після встановлення імплантату та через 1 рік після навантаження (поле зору 60 Å~ 80 мм; розмір вокселя 0.3 мкм; 2.3 с; 90 кВ; 5–8 мА; 192.4–307.8 мГр см2) як частина регулярного лікувального протоколу. Параметри експозиції були встановлені якомога нижче.
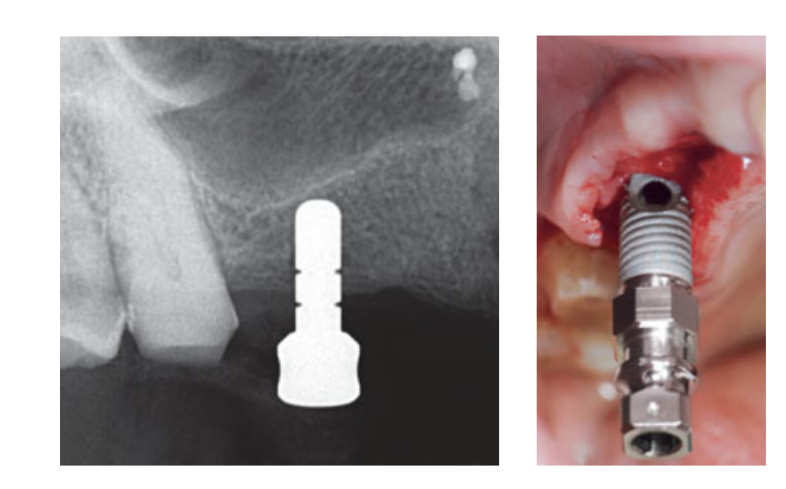
Інтраназальна спрей-терапія (тіамфенікол гліцинат ацетилцистеїнат 810 мг/4 мл) та кортизон (бетаметазон 1 мг) вводилися двічі на день, починаючи з дня перед операцією. У день операції одноразова доза антибіотика (2 г амоксициліну та клавуланової кислоти або 600 мг кліндаміцину, якщо є алергія на пеніцилін) вводилася профілактично за 1 годину до операції. Полоскання рота хлоргексидину 0,2% проводилося протягом 1 хвилини перед операцією. Місцева анестезія з використанням артикаїну з адреналіном 1:100 000 була проведена. Було зроблено середнє розрізання, і піднято повнотовстий мукоперіостальний клапоть. Місця для імплантів були підготовлені відповідно до протоколу свердління, запропонованого виробником (Рис. 3а). Використовувалися зупинки для свердла та глибокі направляючі для досягнення точного та безпечного контролю глибини остеотомії. Довжина імпланта (від 13 до 16 мм) була вибрана заздалегідь на основі залишкової висоти кістки, виміряної за допомогою передопераційних КТ-сканувань, від кісткового гребеня до підлоги синуса вздовж запланованої осі імпланта, і підтверджена за допомогою спеціалізованих рентгенівських інструментів (Maxillent). Імпланти iRaise Sinus Lift (Maxillent) були вставлені в місця остеотомії, вирівнюючи отвір в імпланті по середньо-щічній лінії та залишаючи одну видиму різьблення над отвором (Рис. 3б). Одноразовий трубковий з'єднувач був закручений до порту імпланта. З'єднувач не торкається імпланта, за винятком силіконової кільця (медичний силікон, призначений для імплантації). Потім 2-3 мл фізіологічного розчину було обережно введено в синус через трубковий з'єднувач та внутрішній L-подібний канал імпланта (діаметр 1,5 мм), ізольований від протезного з'єднання, а отже, і від ротової порожнини. Фізіологічний розчин був витягнутий назад у шприц, і в витягнутому фізіологічному розчині було відзначено незначну фізіологічну кровотечу. Після цього шприц, заповнений 1 мл текучого матеріалу для кісткової пересадки (MBCP Gel, Biomatlante, Віньо-де-Бретань, Франція), був змішаний з 0,1 мл 0,9% стерильного фізіологічного розчину, який повільно вводився через той же порт. MBCP Gel є 100% синтетичним ін'єкційним кістковим замінником, що складається з 60% біпарафосфату кальцію та 40% гідроксиапатиту, суспендованого в розчинному полімері, з гранулометрією від 80 до 200 мкм. Після завершення процедури пересадки гідравлічна система була відключена, і вся довжина імпланта була вставлена в місце остеотомії та пересадженої синусової порожнини і залишена для загоєння на 6 місяців відповідно до зануреного протоколу. Додаткові імпланти (iSure, Maxillent) були встановлені в обробленій зоні після завершення хірургічної послідовності iRaise (Maxillent) або через 6 місяців у випадках, коли у пацієнтів була залишкова висота кістки ≤ 3 мм на запланованому місці.
Інтранозальна спрей-терапія (тіамфенікол гліцинат ацетилцистеїнат 810 мг/4 мл) та кортизон (бетаметазон 1 мг) продовжувалися протягом 10 днів після операції. Антибіотики продовжувалися протягом 7 днів (1 г амоксициліну та клавуланової кислоти або 300 мг кліндаміцину двічі на день) після операції. Полоскання рота хлоргексидином 0,2% використовувалося протягом 1 хвилини двічі на день протягом 2 тижнів, а м'яка дієта рекомендувалася на 1 місяць. Ібупрофен 400 мг або парацетамол 1 г призначалися у разі болю. Шви були зняті через 1 тиждень, а інструкції з гігієни рота були посилені.
Шість місяців після встановлення імплантатів та підвищення синуса були підключені загоювальні абатменти. У пацієнтів, яким потрібні етапні імплантати, використовували калібрований трефінний бур з зовнішнім діаметром 3,0 мм для підготовки ділянки, і було взято зразок для гістологічного аналізу.
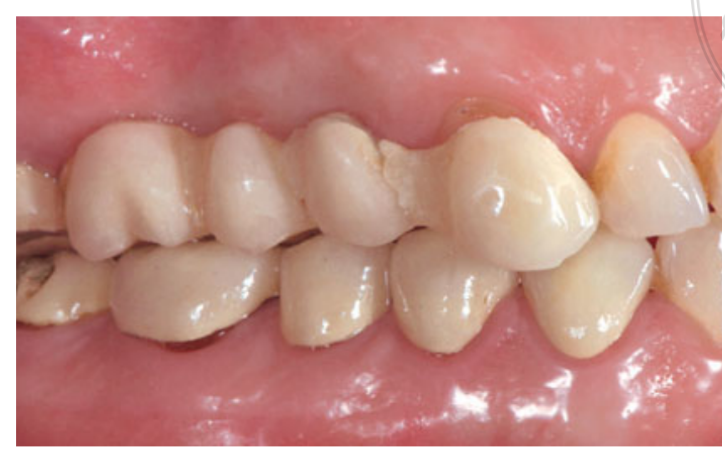
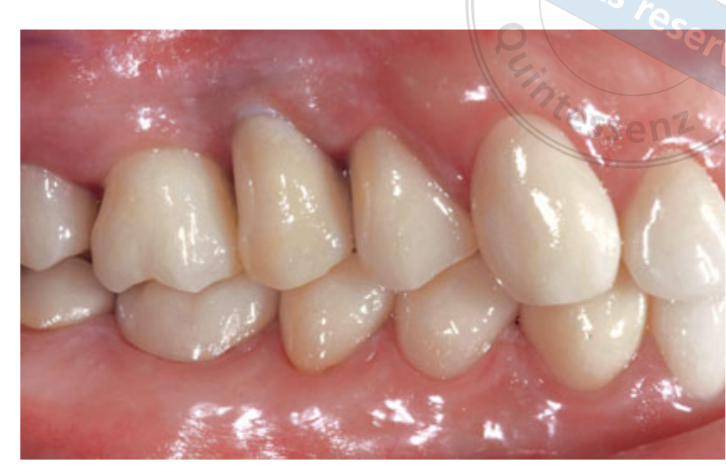
Два тижні після другої операції було зроблено зліпок з відкритою лотком за допомогою поліефірного матеріалу (Impregum, 3M ESPE, Seefeld, Німеччина). Тимчасові реставрації не використовувалися. Остаточні реставрації були виготовлені за допомогою технології комп'ютерного дизайну (CAD)/ комп'ютерного виробництва (CAM) і доставлені через 4 (одиночні коронки) до 6 тижнів (фіксовані протези) пізніше. Потім була ретельно перевірена оклюзія. Повторні прийоми для підтримки гігієни ротової порожнини призначалися кожні 4 місяці після навантаження. Оклюзія також оцінювалася під час кожного візиту (Рис. 4 і 5).
Оцінка результатів
Оцінка результатів цього дослідження була такою:
- Імплант вважався невдалим, якщо він проявляв будь-яку рухливість, оцінену шляхом постукування або хитання головки імпланта металевими ручками двох інструментів, і/або інфекцією, що вимагала видалення імпланта, або будь-якими механічними ускладненнями (наприклад, перелом імпланта), які робили імплант непридатним, хоча він залишався механічно стабільним у кістці. Рентгенівська оцінка проводилася за допомогою інтраоральної рентгенограми, зробленої з паралельною технікою, строго перпендикулярно до інтерфейсу імплант-кістка.
- Протез вважався невдалим, якщо його потрібно було замінити альтернативним протезом.
- Будь-які біологічні (біль, набряк або гній, тощо) та/або механічні (ослаблення гвинта або перелом каркаса та/або облицювального матеріалу, тощо) ускладнення.
- Зміни рівня краю кістки оцінювалися за допомогою інтраоральних цифрових періапікальних рентгенограм (прилад Digora Optime, Soredex, Тусула, Фінляндія; Пластина для зображення, PSP [пластина з фото стимульованим фосфором] розмір 2, розмір пікселя 30 мкм, роздільна здатність 17 lp/mm), зроблених з паралельною технікою, використовуючи комерційно доступні тримачі для плівки (Rinn XCP; Dentsply Rinn, Елджин, Іллінойс, США) під час встановлення імпланта (базовий рівень), навантаження імпланта та через 1 рік після навантаження. У разі нечитаємої рентгенограми, рентгенограма була зроблена знову. Всі рентгенограми відображалися в програмному забезпеченні для аналізу зображень (DfW 2.8 для Windows, Soredex), яке було відкаліброване за допомогою відомої довжини або діаметра зубних імплантів. Відстань від найбільш коронального краю коміра імпланта до верхівки кісткового гребеня вимірювалася до найближчих 0,01 мм і приймалася як рівень краю кістки. Мезіальні та дистальні значення були середніми для кожного імпланта. Від'ємна різниця між моментами часу приймалася як втрата краю кістки (MBL).
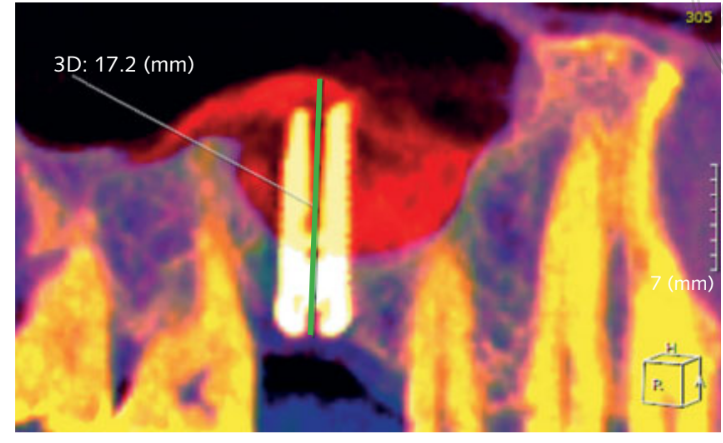
- Збільшена висота кістки (iBH) розраховувалася на КТ з конусним пучком (CBCT) як відстань між кістковим гребенем і найбільшою верхньою рентгенопрозорою ознакою матеріалу пересадки, виміряною вздовж довгої осі імпланта. Приріст кістки визначався як різниця між iBH та попередньою залишковою висотою альвеолярної кістки (aBH), розрахованою як відстань між кістковим гребенем і дном синуса, виміряною вздовж довгої осі в ідеальному положенні імпланта (Рисунок 6).
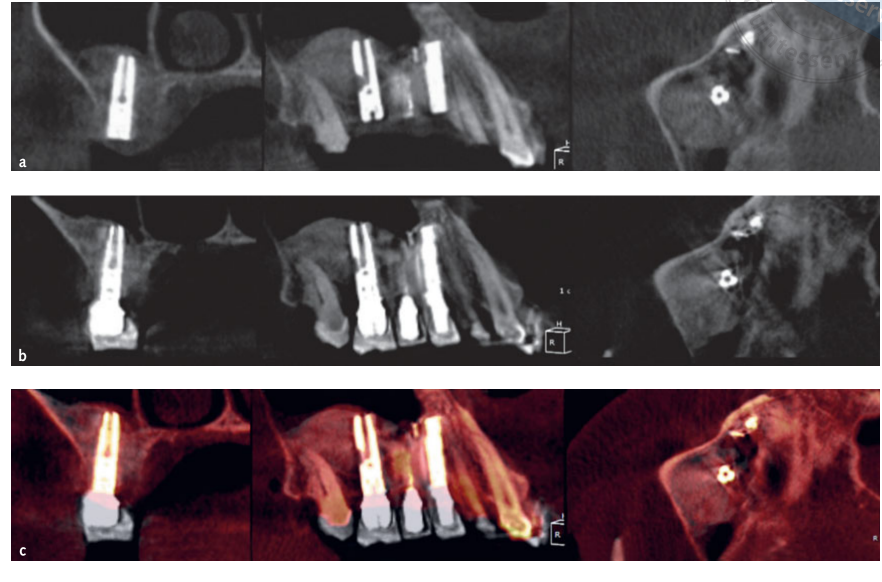
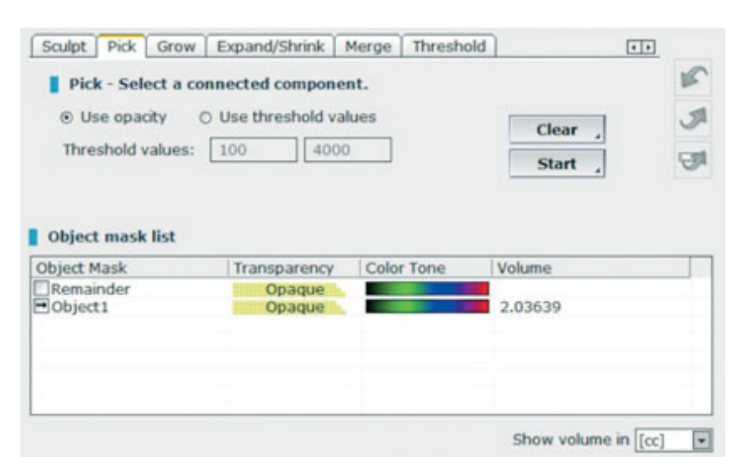
- Об'ємні вимірювання синусових пересадок проводилися на КТ з конусним пучком (CBCT) за допомогою програмного забезпечення OnDemand 3D, додаткового модуля Fusion (Cybermed, Yuseong-gu, Daejeon, Корея) (Рисунок 7). Fusion є інструментом візуалізації, який використовує вдосконалену техніку реєстрації для накладення об'ємних даних, використовуючи інформацію про вокселі. Технологія, що стоїть за Fusion, відома як MI або Взаємна інформація, обчислює статистичну залежність між двома об'ємами, значеннями інтенсивності та кореляції ентропії та порівнює різницю в ентропії суми окремих зображень та спільної ентропії комбінованих зображень для об'єднання даних. Накладення постопераційних та доопераційних даних DICOM пацієнта виконувалося автоматично шляхом малювання обсягу інтересу (VOI) накладення на область, що містить незмінні анатомічні орієнтири (наприклад, зуби, базальний череп, імпланти), і вручну перевірялося на повну відповідність, щоб забезпечити найвищу точність для накладення. Далі обсяги пересадженого матеріалу розраховувалися за сегментом у синусовій порожнині за допомогою інструменту сегментації (OnDemand 3D, Cybermed). Цей інструмент надає об'ємну інформацію на основі непрозорості пересадженого матеріалу (Рисунки 8 та 9). Сегментована область включала імпланти та пересадку. Однак імпланти можна було чітко відрізнити від пересаджених матеріалів за їхньою щільністю та структурою і вони були виключені з вимірювань. КТ з конусним пучком (CBCT) проводилися до встановлення імпланта, відразу після, а також через 6 і 12 місяців після операції відповідно до принципу ALARA (як низько, як це розумно досяжно) (Таблиця 1). Технологія SMAR (Soredex Metal Artifact Reduction) використовувалася для мінімізації розсіювання від металевих артефактів. Той же клініцист, який раніше не брав участі в дослідженні, оцінював всі 2- і 3-вимірні рентгенографічні вимірювання.
- Крутний момент вставки реєструвався під час встановлення імпланта за допомогою хірургійного блоку (iChiro Pro, BienAir, Бієнн, Швейцарія).
- Коефіцієнт стабільності імпланта (ISQ) реєструвався хірургом за допомогою аналізу резонансної частоти (прилад Osstell Mentor, Osstell, Гетеборг, Швеція). Для кожного імпланта проводилися два вимірювання: одне букопалатальне з боку щоки, і одне мезіодистальне з мезіального боку. Обидва вимірювання були середніми, а результат відображався приладом в одиницях ISQ, що коливаються від 1 до 100. Значення реєструвалися під час встановлення імпланта (базовий рівень) і на 6-місячному контролі.
- Пацієнт самостійно повідомляв про післяопераційний біль за порядковою шкалою (0 = без болю; 1 = легкий біль; 2 = помірний біль; 3 = сильний біль): оцінювався через 3 дні після операції на післяопераційному огляді сліпим оцінювачем.
- Пацієнт самостійно повідомляв про післяопераційний набряк за порядковою шкалою (0 = без набряку; 1 = легкий набряк; 2 = помірний набряк; 3 = сильний набряк): оцінювався через 3 дні після операції на післяопераційному огляді сліпим оцінювачем.
- Споживання знеболювальних: кількість використаних таблеток (з 12 таблеток, наданих [Ібупрофен 400 мг або парацетамол 1 г для тих, хто має алергію на НПЗП]): реєструвалося через 3 дні після операції на післяопераційному огляді сліпим оцінювачем.
- Гістоморфометричний аналіз використовувався для обчислення обсягу тканинних фракцій (висловлених у відсотках від загального обсягу), які складали зразок (кістка, біоматеріал, м'яка тканина). Гістологічні зразки були отримані та зафіксовані в 10% формаліні, а потім зневоднені в зростаючих кількостях спирту (70%, 80%, 90%, 96%, 100%), інфільтровані в смолу з алкоголю в зменшуваному співвідношенні (3 алкоголь:1 смола, 1:1, 1:3, чиста смола) і, нарешті, вмонтовані в чисту смолу метилметакрилату (Technovit 7200 VLC, Exact Kulzer, Bio-Optica, Мілан, Італія). Після цього зразки були розрізані посередині діамантовим лезом, щоб отримати два зрізи для кожного зразка. Ці зрізи були приклеєні на пластикові слайди, відшліфовані до товщини 100 мкм і нарешті полірувалися з оксидом алюмінію 0,1%. Зразки були забарвлені дихромним барвником, що складається з толуїдинового синього та піронин жовтого, який підкреслює всі різні тканинні фракції. Слайди спостерігалися та фотографувалися за допомогою світлового та поляризованого мікроскопа (Nikon Eclipse, Nikon Instruments S.p.A, Флоренція, Італія).
Статистичний аналіз
Весь аналіз даних проводився відповідно до попередньо встановленого плану аналізу. Описовий аналіз проводився з використанням середнього значення ± стандартного відхилення (SD), медіани та 95% довірчого інтервалу (CI) (SPSS для Mac OS X версія 22.0, IBM Corporation, Армонк, Нью-Йорк, США). Порівняння між різними кінцевими точками спостереження та базовими вимірюваннями проводилися за допомогою парного t-тесту Ст'юдента для виявлення будь-яких змін. Усі статистичні порівняння проводилися на рівні значущості 0.05. Пацієнти використовувалися як статистична одиниця.
Результати
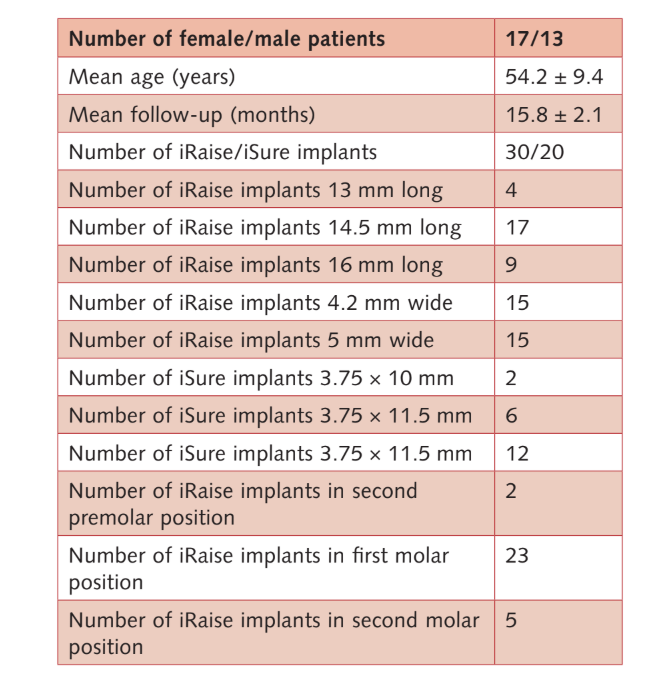
Всього 33 пацієнти були перевірені на відповідність критеріям, але троє з них відмовилися брати участь у дослідницькому протоколі. Тому 30 послідовних учасників (17 жінок, 13 чоловіків) зі середнім віком 54.2 ± 9.4 років (діапазон: 28–75) та важкою атрофією задньої щелепи пройшли транс-крестальне підняття синусової мембрани, вставку кісткового трансплантату та установку імплантату на запланованому місці, без відхилення від початкового протоколу. Середній термін спостереження становив 15.8 ± 2.1 місяців після навантаження імплантату (діапазон: 12–18). Основні характеристики пацієнтів та імплантатів наведені в таблиці 2.
Всього було встановлено 50 імплантів (30 систем імплантів iRaise та 20 додаткових імплантів iSure. Один пацієнт вибув через рік після навантаження (пацієнт не захотів повертатися для оцінок). Протягом періоду спостереження не було жодних невдач імплантів та протезів. Один пацієнт зазнав невеликого розриву мембрани, який був закритий колагеновою губкою (Parasorb Cone, RESORBA Medical GmbH, Нюрнберг, Німеччина). Процедуру було припинено і успішно повторено через 2 місяці. Інших внутрішньоопераційних або післяопераційних небажаних явищ не спостерігалося.
Перед встановленням імплантату середня висота залишкової альвеолярної гребені становила 4.64 ± 0.86 мм (діапазон: 3.4–6.4 мм; 95% ДІ: 4.39 до 5.01 мм). Негайно після встановлення імплантату висота кістки становила 17.92 ± 2.63 мм (95% ДІ 17.02 до 18.90). Через рік після навантаження висота кістки залишалася стабільною, зі середнім значенням 16.86 ± 3.13 мм (95% ДІ 15.83 до 18.07). Різниця становила 1.09 ± 1.60 мм (95% ДІ 0.00 до 1.16; P = 0.0010). Середнє збільшення кістки (iBH - aBH) у порівнянні з базовим рівнем становило 12.15 ± 2.96 мм (95% ДІ 11.22 до 13.38; P = 0.0000).
Середній рівень краєвої кістки під час встановлення імплантату становив -0.16 ± 0.86 мм (95% ДІ -0.41 до -0.21).
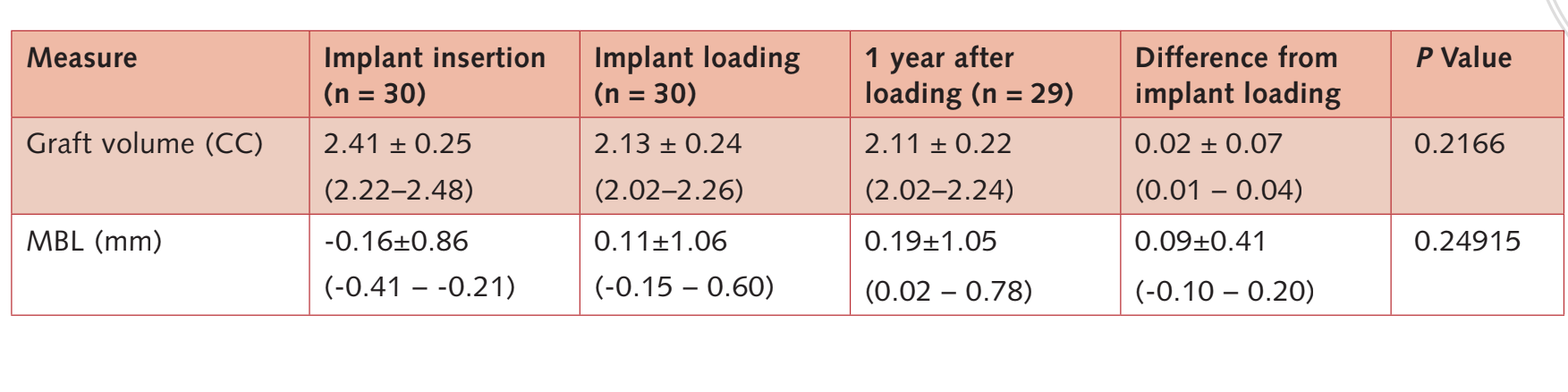
Під час навантаження імплантату середній рівень краєвої кістки становив 0.11 ± 1.06 мм (95% ДІ -0.15 до 0.60). На контрольному обстеженні через 1 рік після навантаження середній MBL становив 0.19 ± 1.05 мм (95% ДІ 0.02 до 0.78). Різниця від базового рівня становила 0.36 ± 0.53 мм; 95% ДІ 0.08 до 0.47; P = 0.00095). Дані наведені в Таблиці 3.
Середнє крутний момент при встановленні імплантату становив 31.6 ± 8.1 Ncm (95% CI 29.9 до 35.7) (iChiro Pro, BienAir). Середнє значення ISQ при встановленні імплантату становило 65.2 ± 5.4 (95% CI 63.6 до 67.4) і збільшувалося протягом періоду загоєння, досягаючи середнього значення 73.6 ± 3.7 (95% CI 73.1 до 75.9; діапазон 62–79) при з'єднанні з абатментом для загоєння (6 місяців після встановлення імплантату). Різниця була статистично значущою (8.4 ± 5.3; 95% CI 5.9 до 39.7; P = 0.0000).
При встановленні імплантату 24 з 30 імплантатів мали кісткову пересадку над верхівкою імплантату. В цілому (n = 30), середнє значення становило 2.95 ± 2.56 мм (95% CI 2.18 до 4.0). Через рік після навантаження середня кісткова пересадка над верхівкою спостерігалася у 23 імплантатів. В цілому (n = 29), середнє значення становило 2.29 ± 2.41 мм (95% CI 1.22 до 2.98).
Об'єм кістки при встановленні імплантату становив 2.41 ± 0.25 CC (95% CI 2.22 до 2.48). Протягом 6-місячного періоду зануреного загоєння спостерігалася незначна кісткова констрикція на 11.3%. (2.13 ± 0.24 CC; 95% CI 2.02 до 2.26; різниця = 0.27 ± 0.25 CC; 95% CI 0.10 до 0.36; P = 0.0011). Протягом першого року після навантаження кісткова пересадка залишалася стабільною (2. 11 ± 0.22 CC; 95% CI 2.02 до 2.24).
Різниця не була статистично значущою (0.02 ± 0.07 CC; 95% CI 0.01 до 0.04; P = 0.2166).
Дані наведені в таблиці 3.
Пацієнти повідомили про свої відчуття після операції. Середнє значення болю становило 0.52 ± 0.74 (діапазон 0–3); середнє значення набряку становило 0.27 ± 0.52 (діапазон 0–2); а середнє споживання анальгетиків становило 0.87 ± 4.94 таблеток (діапазон 0–4).
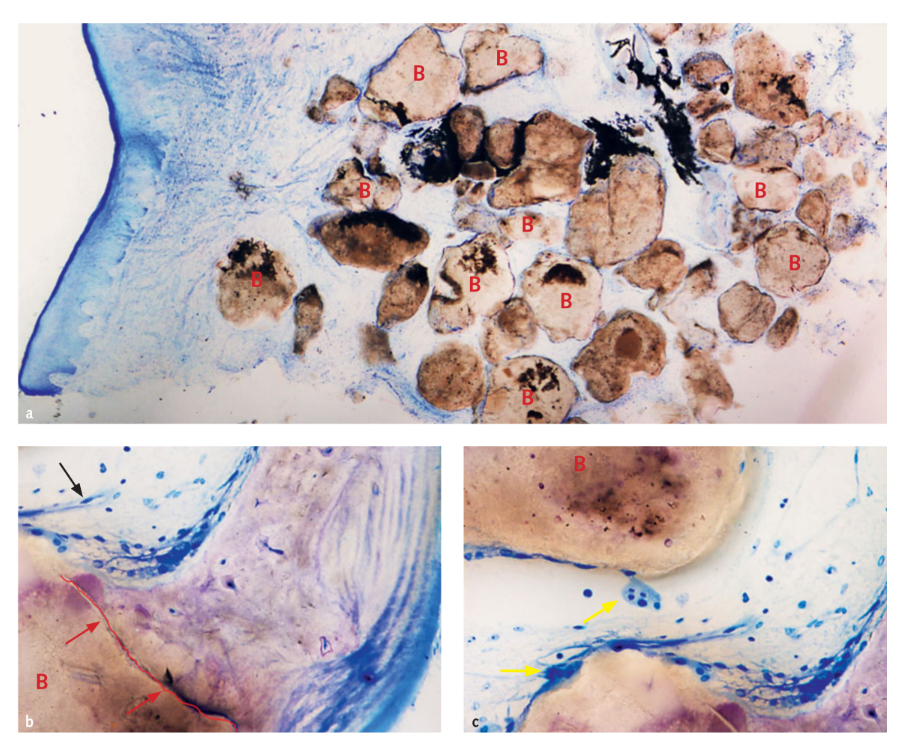
У трьох випадках, коли було встановлено поетапний, додатковий імплантат, був взятий зразок трансплантату для гістологічного аналізу. Морфологічні та гістоморфометричні аналізи показали, що після 6 місяців загоєння всі зразки мали нормальну структуру без наявності запального інфільтрату (Рис 10). Біоматеріал виявився оточеним мінералізованою матрицею, що свідчить про великі площі мінералізації як при низькому (Рис 10a), так і при високому збільшенні. На малюнку 10b мікрофотографія показує тісний контакт між трансплантатом і новою кістковою матрицею. Кровоносні судини були очевидні в просторах кісткового мозку, ймовірно, для підтримки тканини під час фаз формування та організації (Рис 10b та 10c). Було виявлено багато кісткових клітин, зокрема остеобластоподібних клітин на межах нової трабекулярної кістки в тісному контакті з остеокластами під час активної фази формування та ремоделювання нової кістки (Рис 10c). Гістоморфометричний аналіз показав наступні фракції тканини (%): кістка (незріла кістка + зріла кістка): 44.07% ± 4.91; залишковий біоматеріал: 23.98% ± 2.64; медулярні простори: 31.95% ± 3.16.
Обговорення
Метою цього проспективного дослідження було повідомити дані через 1 рік після навантаження про нову імплантаційну систему, яка дозволяє одночасно виконувати синусну пересадку та установку імплантату за допомогою транс-крестального підходу. Оскільки дослідження було сплановане як проспективне когортне, основним обмеженням є відсутність контрольної групи. Тим не менш, це дослідження є одним з перших, що оцінює клінічні та рентгенографічні дані з процедури підняття синуса за допомогою спеціалізованого імплантату з внутрішнім L-подібним каналом через рік після навантаження. Іншим обмеженням цього дослідження може бути технологія, що використовується для вимірювання скорочення обсягу кістки. Хоча ця технологія дозволяє накладати та сегментувати різні обсяги кістки, наукових доказів не існує. Тому дані слід інтерпретувати з обережністю.
Протягом усього періоду спостереження жоден імплантат не зазнав невдачі, і було зафіксовано лише один розрив мембрани, без інших небажаних подій. Тому основним клінічним аспектом цього проспективного дослідження було те, що підняття мембрани синуса може бути безпечно виконане за допомогою гідравлічного тиску безпосередньо через канал імплантату, що дозволяє виконувати пересадку кістки (також через канал) та установку імплантату одночасно. Представлений підхід може бути виконаний при мінімальному залишковому обсязі кістки 3 мм між кістковим гребенем та підлогою синуса.
Згідно з нещодавнім оглядом Cochrane, проведеним Еспозіто та ін., щодо процедур підняття синуса, використання кісткового замінника є сумнівним, коли висота кістки перевищує 3 мм. Проте, різноманітні матеріали для пересадки, як окремо, так і в комбінації, були підтверджені для ефективного використання в процедурах збільшення синуса, включаючи аутогенну кістку, алогенну кістку, ксеногенну кістку та алопластичні матеріали (наприклад, гідроксиапатит [HA], бета-трикальційфосфат [β-TCP]). У даному дослідженні використовувалася суміш 60% HA та 40% β-TCP. Проміжний манускрипт, що повідомляє дані через 6 місяців після імплантації на 18 пацієнтах, дійшов висновку, що під час періоду загоєння спостерігалася фізіологічна конtractionція об'єму пересадки на 13.9% від початкового об'єму. У даному дослідженні було проаналізовано загальний розмір вибірки з 30 пацієнтів, які повідомили про незначну конtractionцію кістки на 11.3% протягом 6-місячного періоду зануреного загоєння. Після цього кістковий графт залишався стабільним, з конtractionцією 0.95%. Нещодавній систематичний огляд Шанбхага та ін. щодо процедур збільшення синуса, виконаних за допомогою традиційного латерального підходу, повідомив про зменшення обсягів збільшення під час раннього загоєння в межах від 18% до 22% при використанні кісткових замінників, без значних відмінностей між матеріалами для пересадки. Зокрема, у рандомізованому контрольованому дослідженні Кюля та ін., протягом перших 6 місяців збільшення верхньощелепного синуса об'єм зменшився на 15% для біпазного кальційфосфату (BCP, 60% HA та 40% β-TCP) і на 18%, коли дослідники додали частикульовану аутогенну кістку на тестовій ділянці, без статистично значущих відмінностей між двома групами. Кілька інших досліджень також підтвердили зменшення об'єму матеріалу для пересадки. Хатано та ін. припустили, що аутогенна кістка або кістковий замінник має розмірну конtractionцію у висоті на 20% протягом до 2 років. Хоча аутогенна кістка вважається золотим стандартом відповідно до Вілтфанга, багато занепокоєнь пов'язані з спостережуваною непередбачуваною резорбцією. Це твердження було підтверджено Шанбхагом та ін. у систематичному огляді, коли використовувалися аутогенні кісткові блоки, які зменшилися в об'ємі на 45% з часом після 6 до 24 місяців. Ті ж автори підтвердили, що анорганічна бичача кістка, використана або окремо, або в комбінації з аутогенною кісткою, показала зміну об'єму від 15% до 21%, що свідчить про кращу стабільність об'єму в порівнянні з аутогенною кісткою окремо. Результати цих досліджень підтримують висновки цього дослідження.
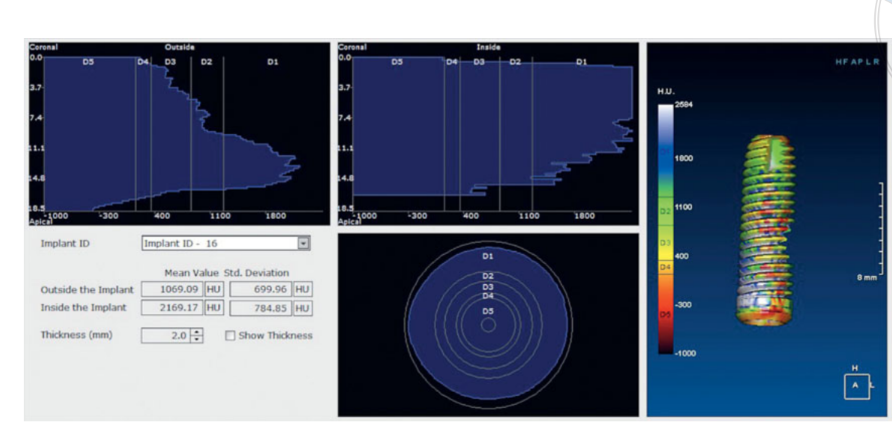
Гістологічні дослідження показали, що через 6 місяців зразки характеризувалися 44.07% ± 4.91 кістки на різних стадіях мінералізації, 23.98% ± 2.64 залишкових частинок трансплантату та 31.95% ± 3.16 медулярних просторів. Хоча приблизно половина початкового трансплантованого матеріалу все ще була присутня через 6 місяців після зануреного загоєння, радіологічні дані з попереднього попереднього дослідження23 вказували на те, що щільність трансплантату значно покращилася з 322.0 ± 100.42 одиниць Хаунсфілда (HU) (діапазон: 177–449 HU; 95% CI: 246.4 до 377.6) до 1,062.0 ± 293.7 HU (діапазон: 573–1,489 HU; 95% CI: 876.12 до 1,259.88). Ця різниця була статистично значущою (740.0 ± 295.35 HU; діапазон: 324–1,231; 95% CI: 426.04 до 811.96; P = 0.0001).
Одиниці Хаунсфілда відносяться до шкали D1-D5, яка базується на значеннях медичної комп'ютерної томографії і не є повністю надійною, коли йдеться про CBCT-сканування. Однак, згідно з Кассетто та ін., HU дорівнював значенням сірого щільності, помноженим на коефіцієнт перетворення 0.7. Отже, попередні попередні дослідження даного дослідження вказували на середню щільність трансплантату (Рисунок 11), що порівнянна з значенням D2 відповідно до класифікації Лекгольма і Зарба. Крім того, клінічні дані показали, що середній ISQ при установці імплантату становив 65.2 ± 5.4 (95% CI 63.6 до 67.4) і зростав протягом періоду загоєння, досягаючи середнього значення 73.6 ± 3.7 (95% CI 73.1 до 75.9; діапазон 62–79). Різниця була статистично значущою (8.4 ± 5.3; 95% CI 5.9 до 39.7; P = 0.0000). Усі ці дані узгоджуються з високими показниками виживаності імплантатів, без жодних невдач протягом усього періоду спостереження.
Короткі імплантати були запропоновані як альтернатива процедурам підняття синуса. Переваги коротких імплантатів включають менш технічно складну операцію, отже, потенційно менше ускладнень і нижчі витрати (без кісткової пересадки). Дані з кількох рандомізованих контрольованих досліджень показали, що короткі імплантати довжиною від 4 до 8 мм можуть бути відповідною, простішою, дешевшою та швидшою альтернативою довшим імплантатам, встановленим в збільшену кістку. Також було продемонстровано, що процедури підняття синуса за допомогою гідравлічного тиску забезпечують високу передбачуваність клінічних результатів, разом з надзвичайно низькою захворюваністю та скороченими хірургічними втручаннями. Тому як короткі, так і довгі імплантати, встановлені в поєднанні з гідравлічним підняттям синуса, представляють життєздатні варіанти лікування. Проте, необхідні рандомізовані контрольовані дослідження, а періоди спостереження все ще занадто короткі, щоб зробити остаточні висновки щодо найкращого лікування для конкретних показань.
Висновки
Аугментація дна синуса може бути успішно виконана за допомогою транс-крестального підходу з використанням спеціалізованої імплантаційної системи, яка дозволяє гідравлічно піднімати мембрану Шнайдера, вводити текучий матеріал для кісткової пересадки та одночасно встановлювати зубний імплантат з мінімальним дискомфортом для пацієнта. Під час загоєння спостерігалася фізіологічна скорочення об'єму кісткової пересадки на 11,3% від початкового об'єму. Після цього не було зафіксовано додаткового зменшення об'єму пересадки. Необхідні довгострокові клінічні дослідження для підтвердження цих результатів.
Марко Талларіко, Девід Л. Кохран, Ерта Ханарі, Клаудія Деллавія, Елена Канчані, Ейтан Міджиріцький, Сільвіо Маріо Мелоні
Посилання
- Ніккеніг Х.Й., Віхманн М., Цоллер Є., Ейтнер С. 3-D базована мінімально інвазивна одноетапна латеральна аугментація синуса – проспективне рандомізоване клінічне пілотне дослідження з сліпою оцінкою післяопераційних видимих змін об'єму м'яких тканин обличчя. J Craniomaxillofac Surg 2014;42:890–895.
- Бечара С., Кубіліус Р., Веронезі Г., Пірес Дж.Т., Шиблі Дж.А., Мангано Ф.Г. Короткі (6-мм) зубні імплантати проти аугментації дна синуса та встановлення довших (≥10-мм) зубних імплантатів: рандомізоване контрольоване дослідження з 3-річним спостереженням. Clin Oral Implants Res 2016 Jul 12. doi: 10.1111/clr.12923. [Epub ahead of print].
- Катранджі А., Фотек П., Ванг Х.Л. Ускладнення аугментації синуса: етіологія та лікування. Implant Dent 2008;17: 339–349.
- Татум Х. Молодший. Реконструкції імплантатів верхньої щелепи та синуса. Dent Clin North Am 1986;30:207–229.
- Бойн П. Дж., Джеймс Р.А. Пересадка дна верхньощелепного синуса з автогенним кістковим мозком. J Oral Surg 1980;38:613–616.
- Міш Ч.Е. Аугментація верхньощелепного синуса для ендостеальних імплантатів. Організовані альтернативні плани лікування. Int J Oral Implantol 1987;4:49–58.
- Смілер Д.Г., Холмс Р.Е. Процедура підйому синуса з використанням пористого гідроксиапатиту: попередній звіт. J Oral Implantol 1987;13:239–253.
- Вуд Р., Мур П. Пересадка верхньощелепного синуса з внутрішньо ротово зібраної автогенної кістки перед встановленням імплантатів. Int J Oral Maxillofac Implants 1988;3:209–214.
- Кент Дж.Н., Блок М.С. Одночасна пересадка кістки дна верхньощелепного синуса та встановлення імплантатів, покритих гідроксиапатитом. J Oral Maxillofac Surg 1989;47:238–242.
- Міш Ч.Е., Дітш Ф. Матеріали для пересадки кістки в імплантології. Implant Dent 1993;2:158–167.
- Беттер Х., Славеску Д., Барбу Х., Кохран Д.Л., Чаушу Г. Мінімально інвазивний пристрій для підйому синуса: попередні результати багатопрофільного дослідження безпеки та ефективності. Clin Implant Dent Relat Res 2014;16:520–526.
- Йоханссон Б., Грепе А., Ваннфорс К., Хірш Дж.М. Клінічне дослідження змін об'єму кісткових пересадок в атрофічній верхній щелепі. Dentomaxillofac Radiol 2001;30:157–161.
- Халман М., Сеннербі Л., Зеттерквіст Л., Лундгрен С. 3-річне проспективне дослідження імплантованих фіксованих протезів у пацієнтів, які піддавалися аугментації дна верхньощелепного синуса з 80:20 сумішшю депротенізованої бичачої кістки та автогенної кістки. Клінічний, рентгенографічний та аналіз резонансної частоти. Int J Oral Maxillofac Surg 2005;34:273–280.
- Ваншиц Ф., Фігл М., Вагнер А., Рольф Е. Вимірювання змін об'єму після аугментації дна синуса з психогенним гідроксиапатитом. Int J Oral Maxillofac Implants 2006;21:433–438.
- Кірмейер Р., Пайер М., Вершуец М., Яксе Н., Платцер С., Лоренцоні М. Оцінка тривимірних змін після аугментації дна синуса з різними матеріалами для пересадки. Clin Oral Implants Res 2008;19:366–372.
- Клайн Р.Й., ван ден Бюккен Дж.Й., Бронкгорст Е.М., Берге С.Й., Мейєр Г.Й., Янсен Я.А. Прогностична цінність розмірів гребеня на резорбцію автологічної кісткової пересадки в етапній аугментації верхньощелепного синуса з використанням конусно-променевої комп'ютерної томографії. Clin Oral Implants Res 2012;23:409–415.
- Уманєц-Корац С., Ву Г., Хассан Б., Лю Й., Вісмейєр Д. Ретроспективний аналіз швидкості резорбції депротенізованої бичачої кістки як матеріалу для пересадки верхньощелепного синуса на конусно-променевій комп'ютерній томографії. Clin Oral Implants Res 2014;25:781–785.
- Мелоні С.М., Йованович С.А., Лолі Ф.М., Кассіса Ч., Де Ріу Г., Пізано М., Лумбау А., Лугліє П.Ф., Тулліо А. Пересадка після підйому синуса з використанням лише неорганічної бичачої кістки в порівнянні з 50:50 неорганічною бичачою кісткою та автогенною кісткою: результати пілотного рандомізованого дослідження через рік. Br J Oral Maxillofac Surg 2015;53:436–441.
- Фреїссіне П., Труйє Ж.Л., Рукет Н., Азімус Е., Ауфетаж А. Оссеоінтеграція макропористих керамік кальційфосфату з різним хімічним складом. Biomaterials 1993;14:423–429.
- Дакульсі Г., Лабу О., Малард О., Вейс П. Сучасний стан біофазних керамік кальційфосфату. J Mater Sci Mater Med 2003;14:195–200.
- Ле Ніуен Д., Сафарзаде А., Агуадо Е., Гойенвалле Е., Гот'є О., Моро Ф., Піле П., Спет Р., Дакульсі Г., Лайроль П. Остеогенні властивості керамік кальційфосфату та композитів на основі фібринового клею. J Mater Sci Mater Med 2007;18:225–235.
- Еспозіто М., Феліче П., Уортінгтон Х.В. Втручання для заміни втрачених зубів: процедури аугментації верхньощелепного синуса. Cochrane Database Syst Rev 2014;13:CD008397.
- Талларіко М., Мелоні С.М., Ханарі Е., Пізано М., Кохран Д.Л. Мінімально інвазивна процедура аугментації синуса з використанням спеціалізованого гідравлічного імпланта для підйому синуса: проспективне дослідження серії випадків щодо клінічних, рентгенологічних та орієнтованих на пацієнта результатів. Int J Periodontics Restorative Dent 2017;37: 125–135.
- Талларіко М., Беттер Х., Де Ріу Г., Мелоні С.М. Новий імплантаційний система, призначена для гідравлічного підйому мембрани Шнайдера та одночасної аугментації кісткової пересадки: ретроспективне клінічне дослідження на термін до 45 місяців. J Craniomaxillofac Surg. 2016;44:1089–1094.
- Шанбхаг С., Шанбхаг В., Ставропулос А. Зміни об'єму аугментацій верхньощелепного синуса з часом: систематичний огляд. Int J Oral Maxillofac Implants 2014;29:881–892.
- Кюль С., Пайер М., Кірмейер Р., Вільдбургер А., Ачам С., Яксе Н. Вплив частикованої автогенної кістки на ранню стабільність об'єму пересадок верхньощелепного синуса з біфазним кальційфосфатом: рандомізоване клінічне дослідження. Clin Implant Dent Relat Res 2015;17:173–178.
- Хатано Н., Шимідзу Й., Ооя К. Клінічна довгострокова рентгенографічна оцінка змін висоти пересадки після аугментації дна верхньощелепного синуса з 2:1 сумішшю автогенної кістки/ксенографту та одночасним встановленням зубних імплантатів. Clin Oral Implants Res 2004;15:339–345.
- Вільтфанг Дж., Шультце-Мосгау С., Нкенке Е., Торварт М., Нейкам Ф.В., Шлегель К.А. Аугментація онлай проти процедури підйому синуса в лікуванні сильно резорбованої верхньої щелепи: 5-річне порівняльне лонгитюдне дослідження. Int J Oral Maxillofac Surg 2005;34:885–889.
- Лекгольм У., Зарб Г.А. Вибір пацієнтів та підготовка. У: Бранемарк П.І., Зарб Г.А., Альбректссон Т., редактори. Протези, інтегровані в тканини: оссеоінтеграція в клінічній стоматології. Чикаго: Quintessence Publishing Co. 1985;1–356.
- Кассета М., Стефанеллі Л.В., Пачифіці А., Пачифіці Л., Барбато Е. Наскільки точний CBCT у вимірюванні щільності кістки? Порівняльне дослідження CBCT-CT in vitro. Clin Implant Dent Relat Res 2014;16:471–478.
- Еспозіто М., Пеллегріно Г., Пістіллі Р., Феліче П. Реабілітація задніх атрофічних беззубих щелеп: протези, підтримувані короткими 5-мм імплантатами або довшими імплантатами в аугментованій кістці? Річні результати пілотного рандомізованого клінічного дослідження. Eur J Oral Implantol 2011;4:21–30.
- Пістіллі Р., Феліче П., Канніццаро Г., Піателлі М., Корвіно В., Барауссе Ч., Буті Дж., Соарді Е., Еспозіто М. Задні атрофічні щелепи, реабілітовані протезами, підтримуваними 6-мм довгими 4-мм широкими імплантатами або довшими імплантатами в аугментованій кістці. Річні результати після навантаження з пілотного рандомізованого контрольованого дослідження. Eur J Oral Implantol 2013;6:359–372.
- Пістіллі Р., Феліче П., Піателлі М., Джессаролі М., Соарді Е., Барауссе Ч., Буті Дж., Корвіно В. Задні атрофічні щелепи, реабілітовані протезами, підтримуваними імплантатами 5 x 5 мм з новою нано-структурованою поверхнею титану, що містить кальцій, або довшими імплантатами в аугментованій кістці. Річні результати з рандомізованого контрольованого дослідження. Eur J Oral Implantol 2013;6:343–357.
- Гульє Ф.Л., Раггоебар Г.М., Віссінк А., Мейєр Г.Й. Одиничні коронки в резорбованій задній верхній щелепі, підтримувані або 6-мм імплантатами, або 11-мм імплантатами в поєднанні з хірургією підйому дна синуса: 1-річне рандомізоване контрольоване дослідження. Eur J Oral Implantol 2014;7:247–255.
- Еспозіто М., Барауссе Ч., Пістіллі Р., Саммартіно Дж., Гранді Г., Феліче П. Короткі імплантати проти аугментації кістки для встановлення довших імплантатів в атрофічних верхніх щелепах: результати через рік після навантаження з пілотного рандомізованого контрольованого дослідження. Eur J Oral Implantol 2015;8:257–268.
- Еспозіто М., Пістіллі Р., Барауссе Ч., Феліче П. Трирічні результати з рандомізованого контрольованого дослідження, що порівнює протези, підтримувані 5-мм довгими імплантатами або довшими імплантатами в аугментованій кістці в задніх атрофічних беззубих щелепах. Eur J Oral Implantol 2014;7:383–395.