Використання вакуумної плазмової обробки поверхні для покращення загоєння та регенерації кістки при збереженні лунки та GBR: серія випадків з гістологічним аналізом
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Оцінити клінічні та гістологічні результати пацієнтів, які отримують коронки на імплантатах після обробки поверхні вакуумним плазмовим методом (VPST) біоматеріалів, що використовуються для збереження альвеолярного відростка (SP) та спрямованої регенерації кістки (GBR).
Матеріали та методи: Це дослідження було спроектовано як серія випадків. Пацієнти, які потребували видалення зуба та збереження альвеолярного відростка або спрямованої регенерації кістки, були залучені до дослідження. Техніка збереження альвеолярного відростка виконувалася після видалення зуба з використанням гетерологічного колагенового кісткового трансплантату та колагенової ксеноматричної тканини, обидва активовані вакуумною плазмою. Тим часом проводилася двоступенева горизонтальна аугментація гребеня з використанням індивідуальної титанової сітки та суміші ауто- (необроблених) і гетерологічних (оброблених) кісткових трансплантатів, разом з обробленою колагеновою мембраною. ACTILINK Reborn з універсальним тримачем Vortex (Plasmapp Co., Ltd., Дежеон, Республіка Корея) використовувався для обробки всіх біоматеріалів. Кінцевими показниками були невдачі імплантатів і протезів, ускладнення та гістологічне дослідження. Зразки м'яких і твердих тканин були зібрані під час встановлення імплантату лише у пацієнтів, які проходили лікування за методом SP.
Результати: Усього було проліковано шість пацієнтів — троє з збереженням лунки та відстроченим встановленням імплантату, і троє з поетапною GBR. Жоден імплантат або протез не зазнав невдачі. Одна індивідуальна титансова сітка зламалася після плазмового лікування, що вимагало заміни на перикардіальну мембрану. Інших ускладнень не виникло. Гістологічний аналіз через три місяці після операції виявив добре васкуляризовану новоутворену кістку на різних стадіях зрілості з інтегрованими частинками кісткового трансплантату, тоді як м'яка тканина виглядала фізіологічно структурованою.
Висновок: VPST може покращити гідрофільність біоматеріалів, підтримуючи сприятливі результати загоєння в SP та GBR. Потрібні подальші рандомізовані контрольовані дослідження з відповідними розрахунками розміру вибірки, щоб підтвердити ці попередні результати.
Вступ
Оральна імплантологія визнана безпечною та ефективною клінічною методологією, здатною забезпечити довгостроковий успіх в оральній реабілітації. Походження цієї медичної галузі сягає початку 1950-х років, коли доктор Пер-Інгвар Бранемарк, шведський ортопед-хірург, зробив революційні відкриття під час проведення ортопедичних експериментів на ногах кроликів. Відтоді ця галузь швидко розвивалася, завдяки досягненням у біоматеріалах та хірургічних техніках, що призвело до покращення результатів та підвищення задоволеності пацієнтів.
В даний час імплант вважається остеоінтегрованим, коли немає прогресуючого відносного руху між імплантом і навколишньою кісткою, що вказує на прямий контакт і стабільність. Первинна стабільність значною мірою залежить від механічного зчеплення між поверхнею імпланта і кісткою господаря, що залежить від таких факторів, як щільність кістки, дизайн імпланта та хірургічна техніка.
Досягнення та підтримка довгострокової остеоінтеграції є складним процесом і можуть бути під впливом різних біологічних і механічних факторів. До них відносяться системне здоров'я пацієнта, локальна якість кістки, умови навантаження імпланта та характеристики поверхні імпланта. Останні дослідження свідчать про те, що модифікація поверхонь імплантів для покращення їх біологічної сумісності може значно поліпшити результати остеоінтеграції. Було досліджено та впроваджено численні методи обробки поверхні для покращення біологічних характеристик поверхні імплантів, що підтримують процес остеоінтеграції як для короткострокового, так і для довгострокового успіху. Серед них, шорсткість поверхні та гідрофільність є особливо значущими для досягнення високого контакту кістки з імплантом (BIC). Ці характеристики поверхні розроблені для забезпечення кращої стабільності під час процесу загоєння та дозволяють швидше навантажувати імплант, прискорюючи механізм остеоінтеграції та сприяючи більш сильному та швидшому формуванню кістки.
Для покращення остеокондуктивності та остеоіндуктивності біоматеріалів для регенерації кісток було продемонстровано, що модифікація їх поверхні сприяє адгезії клітин, проліферації та формуванню нової кістки. Ці обробки включають адитивні модифікації, такі як покриття, або субтрактивні модифікації, включаючи травлення, піскоструминну обробку та інші. Серед різних обробок біоматеріалів, спрямованих на покращення остеоінтеграції, обробка плазмою продемонструвала значні покращення в адгезії клітин шляхом модифікації шорсткості поверхні та змочуваності. Активація плазмою модифікує поверхню, впроваджуючи функціональні групи, збільшуючи поверхневу енергію та покращуючи гідрофільність. Це призводить до зменшення кута контакту між біологічними рідинами та поверхнею імплантату, полегшуючи дифузію остеобластних клітин без залишків після обробки. Крім того, обробка плазмою викликає зміни у фізико-хімічних властивостях, включаючи вільну поверхневу енергію, вміст вуглеводнів та наявність функціональних гідроксильних груп. Останні досягнення в технології плазми дозволили розробити системи низького тиску, здатні рівномірно обробляти складні геометрії імплантатів. Ці системи забезпечують точний контроль над параметрами обробки, такими як потужність, склад газу та час експозиції, що дозволяє здійснювати індивідуальні модифікації поверхні для покращення біосумісності. Однак, незважаючи на обнадійливі результати in vitro, клінічні дані щодо біоматеріалів, оброблених плазмою, залишаються обмеженими, що потребує подальшого дослідження. Незважаючи на обнадійливі результати з досліджень in vitro, клінічні дані про ефективність біоматеріалів, оброблених плазмою, залишаються обмеженими, що вимагає подальшого дослідження.
Метою цього клінічного аудиту є оцінка клінічних та гістологічних результатів пацієнтів, які отримують коронки на імплантатах після VPST біоматеріалів, що використовуються для збереження альвеолярного відростка (SP) та спрямованої регенерації кістки (GBR). Результати цього дослідження мають на меті інформувати та потенційно вдосконалити існуючі клінічні протоколи, сприяючи більш точному та передбачуваному підходу в оральній реабілітації. Таким чином, цей клінічний аудит може слугувати дослідженням концепції.
Матеріали та методи
Це дослідження було спроектовано як дослідження серії випадків фази IV, з використанням матеріалів та пристроїв, схвалених CE, які використовуються в рамках звичайної професійної практики та без додаткових ризиків. Усі випадки були виконані в приватній клініці в Римі, Італія, а дані були оцінені в Медичному, Хірургічному та Фармацевтичному відділі Університету Сассарі, Італія. Дослідження дотримувалося принципів Гельсінської декларації 2013 року та принципів Доброї медичної практики. Медичні дані були анонімізовані, щоб пацієнтів не можна було ідентифікувати, і було отримано звільнення етичного комітету від згоди на серію випадків (номер звіту 41/1.6; видано 21 травня 2025 року).
Пацієнти, які потребують атравматичного видалення безнадійного зуба та процедури збереження лунки, а також пацієнти, яким потрібна процедура керованої регенерації кістки перед встановленням імплантату, були залучені до цього дослідження.
Критерії включення:
- Пацієнти з принаймні одним безнадійним зубом у нижній або верхній щелепі, з неушкодженою постекстракційною альвеолою, здатні зрозуміти та надати інформовану згоду, вважалися такими, що підлягають включенню для збереження лунки; або будь-які пацієнти, яким потрібна відновлення на одиночному імплантаті та поетапна горизонтальна керована регенерація кістки (дефект класу IV відповідно до Каведа та Гоуела) як у нижній, так і у верхній щелепі. Безнадійний зуб визначався як зуб з серйозними структурними, пародонтальними або ендодонтичними ушкодженнями, які не можна було передбачувано лікувати або підтримувати, і який рекомендували видалити. Загальні критерії для класифікації зуба як безнадійного включають: важка пародонтальна хвороба з втратою кістки ≥75%, рухливість (клас III) або залучення класу III в розгалуженні; значний карієс або переломи, які роблять зуб неремонтопридатним; невдале ендодонтичне лікування з постійною інфекцією; та травма, що призвела до нежиттєздатних коренів або серйозного зміщення.
- Вік 18 років або старше та здатність надати інформовану згоду.
- Курці були класифіковані як: (1) некурці; (2) помірні курці (курять до 10 сигарет на день); та (3) важкі курці (курять більше 11 сигарет на день). Важкі курці були виключені, лише категорії 1 та 2 були включені в це дослідження.
- Біотип був класифікований як: тонкий (≤1 мм), середній (>1–<2 мм) або товстий (≥2 мм). Критерії виключення:
- Загальні протипоказання до імплантаційної хірургії
- Пацієнти, які піддавалися опроміненню в області голови та шиї.
- Імунодефіцитні або імунокомпрометовані пацієнти.
- Пацієнти, які отримували або перебувають на лікуванні внутрішньовенними амінобісфосфонатами.
- Пацієнти з нелікованим пародонтитом.
- Пацієнти з поганою гігієною рота та мотивацією.
- Неконтрольований діабет.
- Важкі курці (більше 11 сигарет на день).
- Вагітність або годування груддю.
- Зловживачі речовинами.
- Психіатричні проблеми або нереалістичні очікування.
- Відсутність антагоністичного оклюзійного зубного ряду в зоні, призначеній для встановлення імплантату.
- Пацієнти з інфекцією та/або запаленням в зоні, призначеній для встановлення імплантату.
- Пацієнти, які беруть участь в інших дослідженнях, якщо поточний протокол не може бути належним чином дотриманий.
- Пацієнти, направлені лише для встановлення імплантату і які не можуть бути спостережені в лікувальному центрі.
- Пацієнти, які не можуть бути спостережені протягом 5 років.
2.1. Процедура збереження лунки
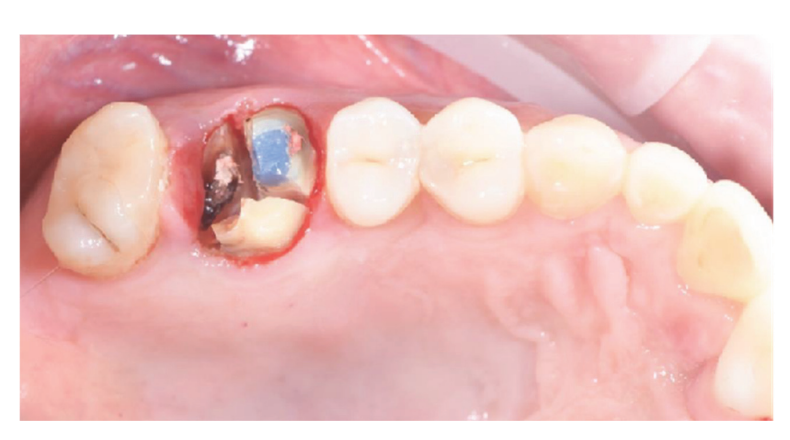
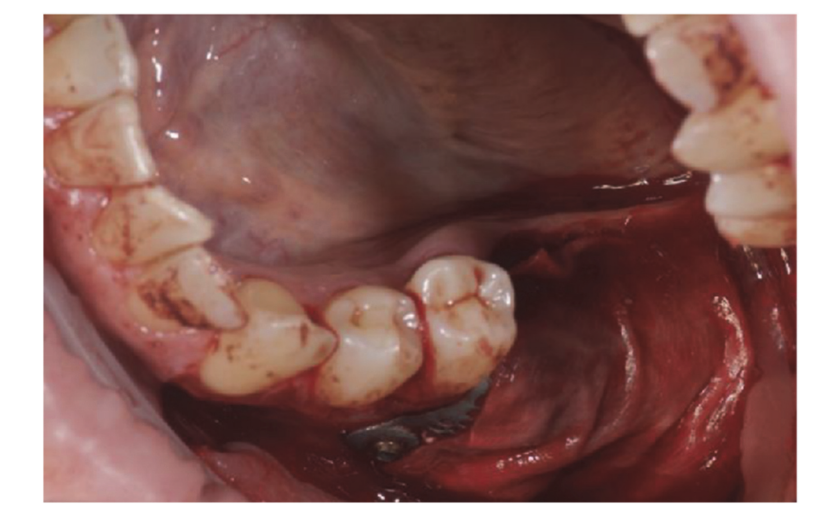
Пацієнти, які відповідали критеріям включення/виключення (Рисунок 1) були ретельно клінічно обстежені для оцінки стоматологічного карієсу та здоров'я пародонту. Перед процедурою збереження лунки пацієнти пройшли передопераційне КТ-сканування для кількісної оцінки об'єму кістки. Після підтвердження відповідності критеріям та отримання інформованої згоди було проведено комплексне стоматологічне обстеження для оцінки загального стану ротової порожнини та виявлення будь-яких патологій, які потребували лікування перед збереженням лунки та імплантацією. Приблизно за 10 днів до збереження лунки та встановлення імплантату всі пацієнти отримали професійне чищення ротової порожнини, включаючи деконтамінацію, за необхідності. Профілактичне введення антибіотиків включало 2 г амоксициліну за годину до операції або 600 мг кліндаміцину у випадках алергії на пеніцилін. Пацієнти також полоскали ротову порожнину 0,2% розчином хлоргексидину протягом однієї хвилини перед будь-якою хірургічною процедурою. Усі хірургічні втручання проводилися під місцевою анестезією з використанням артикаїну та адреналіну (1:100,000). Внутрішньовенна седація була за бажанням. Безтравматичне видалення зуба без підняття клаптя було виконано, після чого проводилися кюретаж альвеоли, оцінка цілісності альвеоли та збереження лунки (Рисунок 2). Лунки після видалення заповнювалися гетерологічною кістковою заміною з використанням натуральних кінських кісткових гранул (Bioactiva, Arcugnano, Італія) та покривалися XC Collagen Xenomatrix (Bioteck S.p.A, Віченца, Італія). Обробка поверхні вакуумним плазмовим методом проводилася за допомогою машини ACTILINK reborn (Activelink reborn, Plasmapp Co., Ltd., Дейджон, Республіка Корея) з індивідуальним тримачем (Рисунок 3), відповідно до опублікованого протоколу. Час циклу обробки поверхні вакуумним плазмовим методом, названим режимом Vortex Plasma, становив 30 с.
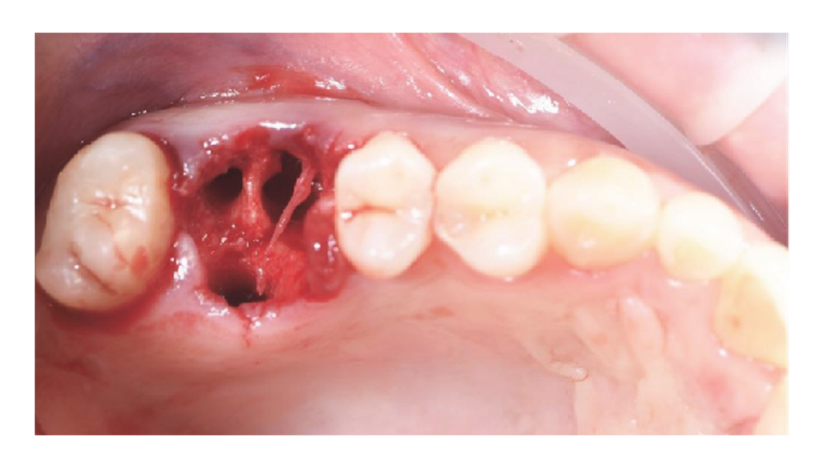

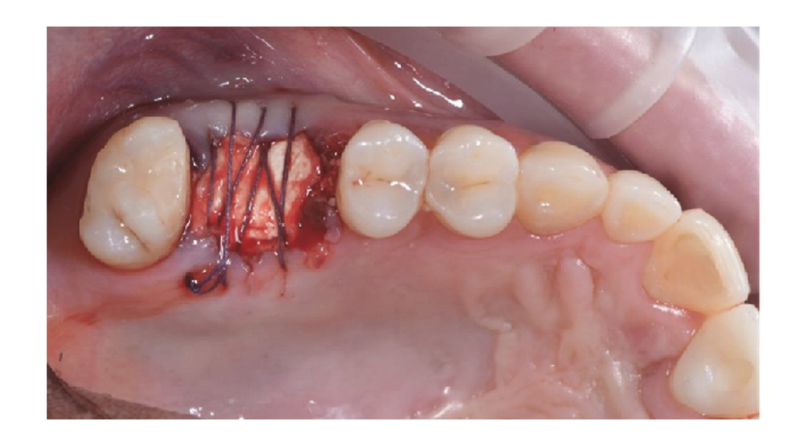
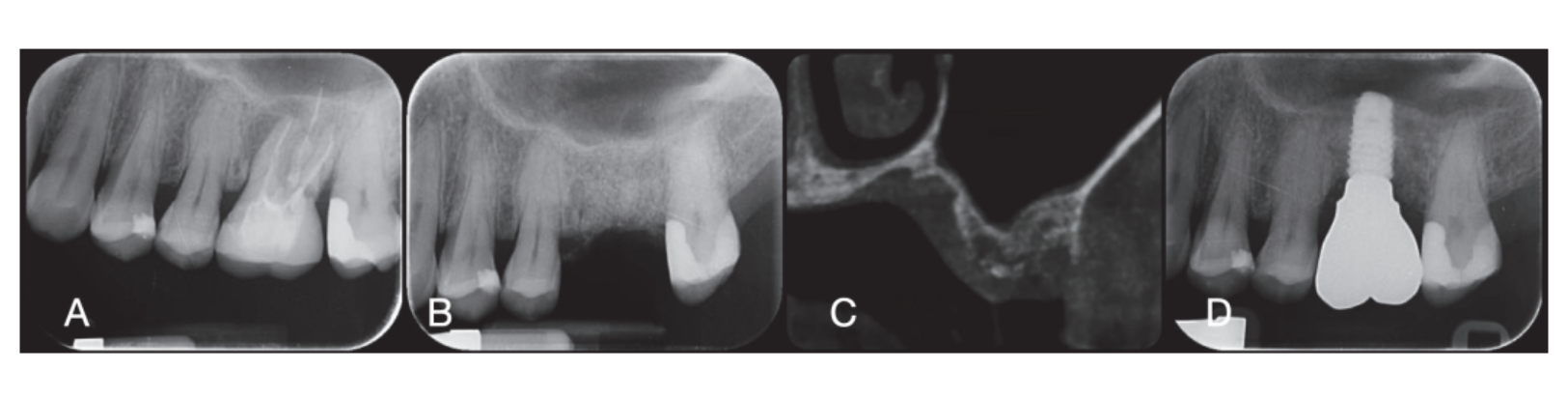
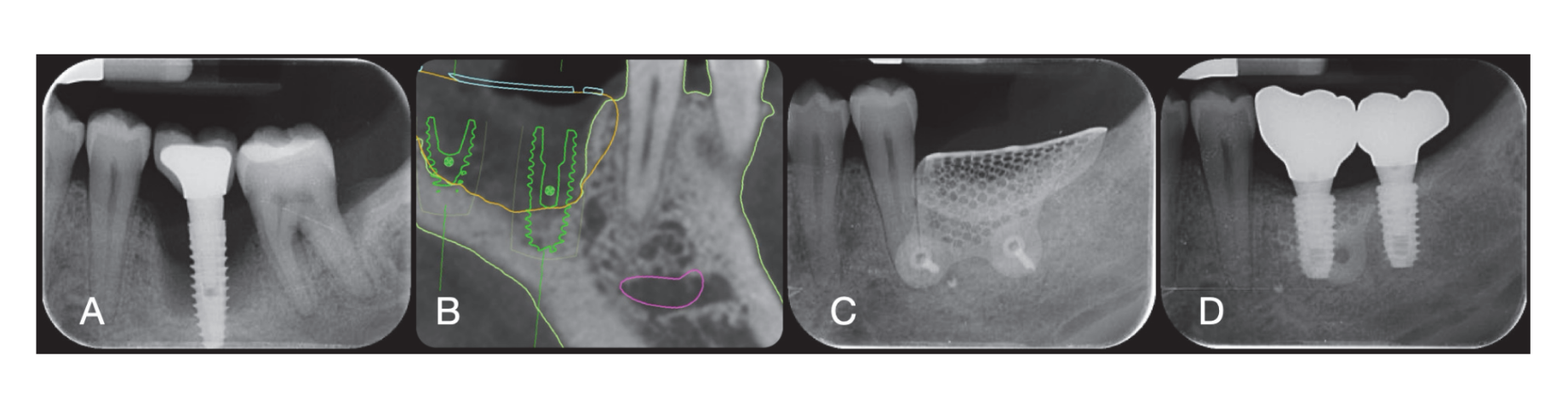
Хірургічні ділянки були закриті простими швами Vicryl 4.0 (Revello S.p.A, Верона, Італія) (Рисунок 4). Після періоду загоєння тривалістю три місяці було проведено установку імплантату (Osstem Implant, Сеул, Республіка Корея) відповідно до інструкцій виробника. Гістологічні зразки тканин були зібрані безпосередньо перед підготовкою місця для імплантату (див. Розділи 2.3 та 2.4). Місця для імплантатів були підготовлені вручну, без хірургічного шаблону, за допомогою свердел з поступово збільшуваним діаметром. Якість кістки суб'єктивно класифікувалася як тверда, середня або м'яка. Момент обертання був встановлений на 35 Нсм під час вставки імплантату. Імплантати були розміщені на 1,5 мм нижче неушкодженої щічної кістки, і був прийнятий протокол негайного навантаження з мінімальним моментом вставки 35 Нсм. Післяопераційне знеболювальне лікування ібупрофеном 600 мг призначалося за потреби. Всіх пацієнтів ретельно спостерігали для оцінки повного загоєння. Через три-чотири місяці після негайного навантаження були зняті остаточні відбитки, і протягом місяця була встановлена коронка без металу на імплантатах з гвинтовим кріпленням. Періапікальні рентгенограми були отримані під час установки імплантату (Рисунок 5).
2.2. Післяопераційні інструкції та протезування після збереження альвеолярного відростка
М'яка дієта була рекомендована на 30 днів у випадку негайного навантаження. Ібупрофен (400 мг) був призначений для прийому 2–4 рази на день під час їжі, але пацієнтам було наказано не приймати його за відсутності болю (в разі алергії або проблем зі шлунком замість цього призначався 1 г парацетамолу). Додатково була рекомендована 0,2% розчин хлоргексидину для полоскання рота на 1 хвилину двічі на день протягом 14 днів. Пацієнтам не дозволялося носити жодний знімний протез, який міг би навантажити досліджувані імплантати. Шви були видалені через 7–10 днів, і були надані інструкції з гігієни рота.
На момент вставлення імплантату були надані тимчасові реставрації з негайним навантаженням. Після остеоінтеграції (8 тижнів) тимчасові реставрації були модифіковані відповідно до управління м'якими тканинами. Через 3–4 місяці була зроблена остаточна, цифрова або аналогова відбитка. Остаточні реставрації були надані протягом місяця після перевірки стабільності окремих імплантатів. Жувальна поверхня була в легкому контакті з протилежною зубною дугою. Було зроблено періапікальні рентгенограми та клінічні знімки досліджуваних імплантатів (Рисунок 5). Якщо рівні периімплантної маргінальної кістки не були читабельними, було зроблено нову рентгенограму, і були надані інструкції з гігієни рота.
2.3. Витяг біопсії
Через три місяці було проведено установку імплантату (Osstem Implant, Сеул, Республіка Корея) відповідно до інструкцій виробника. Під час підготовки місця для імпланта були отримані біопсії м'яких і твердих тканин за допомогою 5 мм мукотома (зовнішній діаметр) для м'яких тканин та 3,0 мм (зовнішній діаметр) трефінного свердла для зразків кістки. Зразки твердих тканин фіксували в 10% нейтральному буферному формаліні, а м'які тканини - в 4% нейтральному буферному формаліні для гістологічного дослідження.
2.4. Обробка зразків та гістологічний аналіз
Зразки твердих тканин були дегідратовані за допомогою висхідної серії етанолу. Після дегідратації зразки були інфільтровані метакриловою смолою і потім вмонтовані. Блоки були розрізані за допомогою алмазного леза і подальше зменшені до товщини приблизно 100 мкм. Секції були закріплені на пластикових слайдах, приклеєні та пофарбовані Толуїдиновим синім і жовтим піроніном.
Зразки м'яких тканин, зафіксовані формаліном, були вмонтовані в парафін. Гістологічні слайди були отримані та пофарбовані гематоксиліном та еозином, трихромом Маллорі та червоним Сіріусом. Слайди були досліджені якісно під яскравим оптичним мікроскопом (Nikon Eclipse 80i, Nikon, Токіо, Японія) та високоякісним сканером при різних збільшеннях (Hamamatzu NanoZoomer Series S60, Hamamatзу Фотоніка, Хамамацу, Японія). Крім того, зразки, пофарбовані червоним Сіріусом, були досліджені під поляризованим світлом для оцінки організації колагенових волокон (Nikon Eclipse 80i, Nikon, Токіо, Японія).
2.5. Процедура GBR
Пацієнти були оцінені на відповідність критеріям участі в дослідженні. Для кожного пацієнта був отриманий передопераційний КТ-сканування для кількісної оцінки обсягу кістки. Пацієнти, у яких не було достатнього обсягу кістки для встановлення імплантату, були проінформовані про деталі дослідження та підписали форму інформованої згоди на участь у дослідженні. Після підтвердження відповідності та отримання інформованої згоди було проведено ретельне стоматологічне обстеження для оцінки загального стану здоров'я та виявлення будь-яких оральних патологій, які потребували лікування перед направленою регенерацією кістки (GBR) та реабілітацією імплантату. За десять днів до GBR та встановлення імплантату всі пацієнти пройшли професійні процедури гігієни рота, включаючи дебридмент, за необхідності. Невдалі зуби в оперативних ділянках були видалені за вісім тижнів до GBR та встановлення імплантату. Пацієнти отримали 2 г амоксициліну (Zimox, Pfizer, Рим, Італія) за годину до операції, після чого 1 г двічі на день протягом двох тижнів. У випадках алергії на пеніцилін 600 мг кліндаміцину було введено з таким же післяопераційним режимом. Безпосередньо перед операцією пацієнти полоскали рот 0,2% розчином хлоргексидину (Curasept, Curaden Healthcare, Саронно, Італія) протягом однієї хвилини. Хірургічна процедура проводилася під свідомою седативною анестезією (Діазепам, Хоффманн-Ла Рош, Базель, Швейцарія) та місцевою анестезією (Септанест з адреналіном 1/100,000, Септодонт, Сен-Мор-де-Фосе, Франція). Був зроблений середньокрестовий розріз (трохи букально просунутий) у залишковій кератинізованій тканині за допомогою хірургічного леза № 15, після чого були зроблені два двосторонні вертикальні розрізи на відстані одного або двох зубів. Повнотовстий клапоть був піднятий за межі мукогінгівального з'єднання, принаймні на 5 мм за межі кісткового дефекту, і місце отримувача було ретельно очищено від залишків м'яких тканин. Автогенна кістка була отримана з запланованого місця імплантації або з ретромолярної області нижньої щелепи за допомогою малотравматичного кортикального кісткового збирача (Micross, Meta, Реджо-Емілія, Італія). Кістковий дефект був заповнений 50:50 сумішшю автогенної кістки та гетерологічного кісткового замінника (природні гранули кінської кістки, Bioactiva, Аркуняно, Італія), попередньо обробленими плазмою Vortex за допомогою утримувача матеріалу. Плазмооброблена, спроектована за допомогою CAD/CAM, титанову сітку (Exocad DentalCAD, Exocad, Дармштадт, Німеччина), налаштовану відповідно до контуру та форми контралатеральної області (New Ancorvis Srl, Баргельїно, Кальдерара ді Рено, Італія), було розміщено для покриття та захисту пересадженого місця. Налаштована титансова сітка була закріплена двома-трьома попередньо запланованими кістковими гвинтами та покрита плазмообробленою перикардіальною мембраною (Bioactiva, Аркуняно, Італія) (Рисунки 6 та 7). Закриття клаптя без напруги було досягнуто за допомогою швів Vicryl 4.0. Післяопераційно пацієнти отримали 80 мг кетопрофену (Окі, Домпè, Мілан, Італія) та 4 мг/день бетаметазону (Бентелан, Глаксо, Верона, Італія) протягом двох днів. Їм було рекомендовано полоскати рот 0,2% хлоргексидином (Curasept) тричі на день протягом двох тижнів та вживати лише м'яку їжу протягом 30 днів. Шви були видалені через 14-21 день. Базові періапікальні рентгенограми були зроблені в кінці процедури, під час повторного відкриття, при доставці протеза та щорічно після цього. Для обробки всіх біоматеріалів використовувався ACTILINK Reborn з універсальним утримувачем Vortex (Plasmapp Co., Ltd., Республіка Корея), як було раніше повідомлено.

Шість місяців після GBR імпланти були встановлені відповідно до стандартного протоколу виробника. Після підняття клаптя місця для імплантів були підготовлені за допомогою свердел з поступово зростаючим діаметром, а якість кістки суб'єктивно класифікувалася як тверда, середня або м'яка. Момент обертання був встановлений на 25 Нсм під час вставки імплантів. Імпланти (Osstem TSIII SOI, Osstem Implant CO., LTD., Сеул, Республіка Корея) були встановлені в заплановані протезні позиції. Оскільки імпланти мали активовану поверхню, додаткове лікування Vortex Plasma не проводилося. Імпланти були встановлені на рівні гребеня або трохи нижче, або вручну, або за допомогою хірургічного шаблону CAD/CAM. Чотири місяці після встановлення імплантів, імпланти були оголені, а м'яка тканина була оброблена за потребою. Потім були зроблені цифрові або аналогові відбитки, і тимчасові реставрації були доставлені відповідно до вимог управління м'якою тканиною. Через два-чотири місяці після цього були доставлені остаточні монолітні цирконієві коронки, приклеєні на Ti-link, після підтвердження стабільності окремих імплантів. Жувальні поверхні були спроектовані так, щоб мати легкий контакт з протилежною зубною дугою. Періапікальні рентгенограми та клінічні зображення були зроблені під час процедури GBR, встановлення імплантів, етапів тимчасової та остаточної реставрації (Рисунок 8). Інструкції з гігієни ротової порожнини були надані під час кожного візиту на контроль. Професійне обслуговування гігієни було заплановано кожні шість місяців після остаточного навантаження та за потребою під час протезних фаз. Стоматологічний оклюзія оцінювалася під час кожного контрольного прийому.
2.6. Результати
Основними результатами були:
- Невдача імплантату, визначена як рухливість, інфекція, перелом та/або будь-яка інша механічна або біологічна проблема, що призвела до його видалення.
- Невдача протеза вважалася такою, що сталася в будь-який момент, коли його потрібно було замінити.
- Будь-які біологічні (наприклад, стійкий до ліків біль, набряк, надмірна MBL, гній, тощо) та/або технічні (наприклад, перелом облицювального матеріалу та/або каркасу, розхитування гвинта, тощо) ускладнення були зафіксовані під час спостереження.
Вторинним результатом було оцінити регенерацію кістки через якісний гістологічний аналіз, оцінюючи ступінь мінералізації кістки.
Результати
3.1. Клінічні результати
Було проліковано шість пацієнтів. Три пацієнти з безнадійними зубами та цілими лунками після видалення зуба отримали процедуру збереження лунки та відстрочене (на три місяці) встановлення імплантату, тоді як інші три пацієнти з горизонтальними дефектами класу IV отримали встановлення імплантату в поєднанні з направленою регенерацією кістки. Шість гістологічних зразків у трьох пацієнтів були зібрані під час встановлення імплантату в групі збереження лунки. Від кожного пацієнта м'які та тверді тканини були зібрані через три місяці після процедури збереження лунки, в той же час, коли проводилася операція з встановлення імплантату, як було описано. Було зібрано шість зразків і надіслано на гістологічний аналіз (три зразки м'якої тканини та три зразки кістки).
Було проліковано шість пацієнтів. Усі пацієнти були жінками середнього віку 50 років (вік від 37 до 63). Жоден з пацієнтів не курив, і всі пацієнти були у доброму здоров'ї (ASA 1). Усі пацієнти перебували під наглядом не менше 1 року після доставки протезів, без випадків відмови.
Жоден імплантат або протез не зазнав невдачі протягом року після встановлення імплантату. У одного пацієнта, який пройшов процедуру направленої регенерації кістки, титанову сітку зламали після плазмової обробки. У цього пацієнта була використана перикардіальна мембрана, яка була зафіксована за допомогою тегів. Інші біологічні або технічні ускладнення не виникали.
У одного пацієнта в групі збереження лунки, під час встановлення імплантату, первинна стабільність становила близько 15–20 Ncm. Проте імплантат оссеоінтегрувався, і остаточна коронка була встановлена.
3.2. Гістологічна оцінка
Три місяці після операції збереження лунки жодні гістологічні зразки не показали ознак запалення або некрозу.
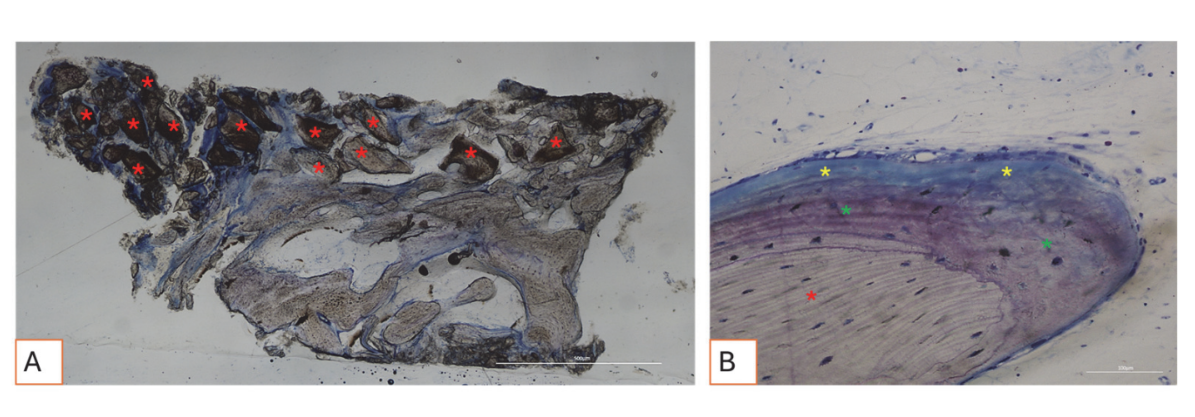
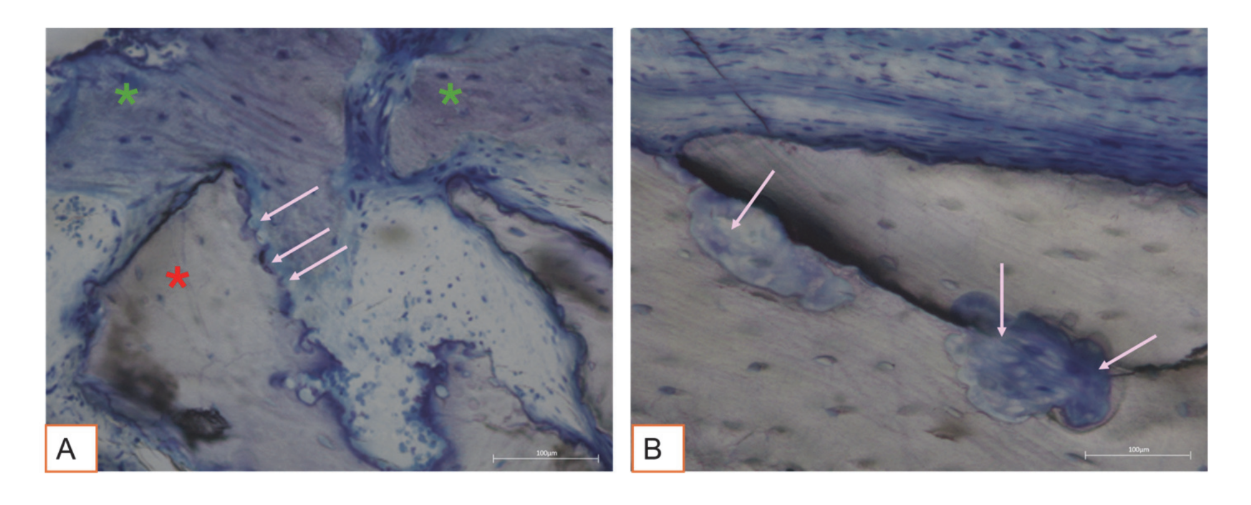
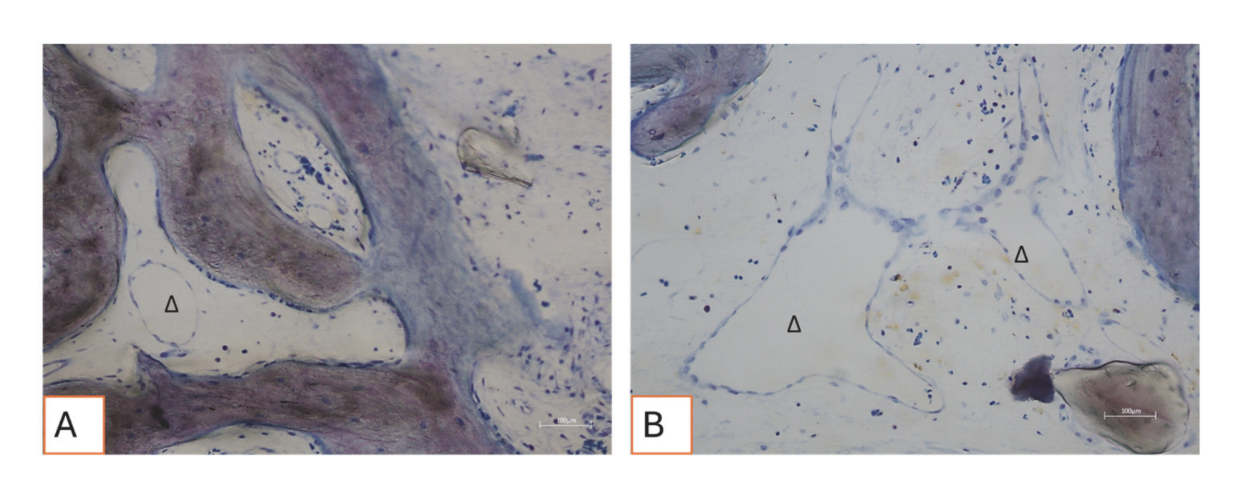
Усі зразки твердої тканини свідчили про новоутворену кістку, яка проходила мінералізацію на різних стадіях (Рисунок 9), що оточувала кілька частинок кісткового трансплантату, які характеризувалися численними поверхневими лакунами, що відповідають лакунам резорбції остеокластів (Рисунок 10). Нещодавно утворена кістка, здавалося, була багатою на активні кісткові клітини, а саме остеобластоподібні клітини, вирівняні в лініях депозиції та секретуючі остеоїдну матрицю, а також незрілі остеоцитоподібні клітини, що населяли лакуни плетеного кісткового матеріалу (Рисунок 9). Вільна сполучна тканина спостерігалася навколо областей твердої тканини і, здавалося, була багатою на клітини та кровоносні судини (Рисунок 11).
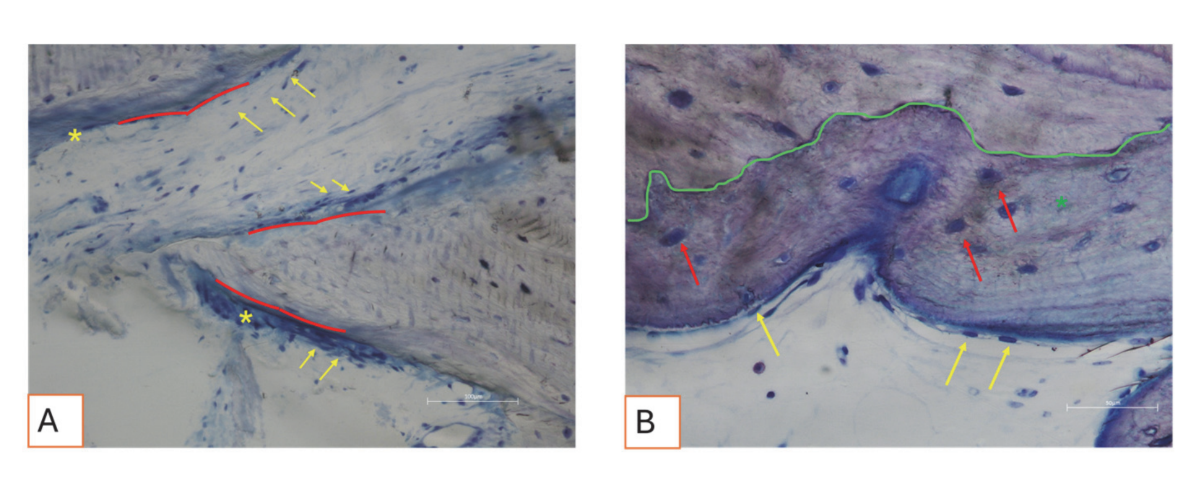
М'які тканини мали фізіологічну морфологію. Сполучна компонента була трохи фіброзною, що відповідає післяопераційному загоєнню (Рисунки 12 та 13).

Обговорення
Це дослідження вивчало вплив VPST на біоматеріали, що використовуються в процедурах SP та GBR, оцінюючи його вплив на гідрофільність поверхні та результати загоєння. Результати вказують на те, що обробка плазмою покращує біологічну сумісність біоматеріалів, сприяючи ефективній остеоінтеграції та сприятливим реакціям загоєння.
Гістологічний аналіз через три місяці не виявив ознак некрозу, запалення або рубцювання. Як м'які, так і тверді тканини показали фізіологічну архітектуру з хорошою васкуляризацією. Післяопераційно відновлені тверді тканини виявили наявність активних клітин кістки, що секретують остеоїдну матрицю та новоутворену кісткову тканину, що відповідає очікуваному часу загоєння. Ці результати узгоджуються з попередніми дослідженнями, які повідомляють, що раннє формування кістки характеризується відкладенням остеоїдної матриці, яка поступово мінералізується з часом. Частинки кісткового трансплантату були добре інтегровані в новоутворену кістку. Цікаво, що багато з цих частинок виявили поверхневі лакуни, сумісні з остеокластичною резорбцією. Людські остеокласти, вирощені протягом 21 дня на поверхні депротенізованих конячих кісткових гранул (DEBGs) та депротенізованих бичачих кісткових гранул (DBBGs), резорбували біоматеріали, демонструючи типові остеокластичні маркери та морфологічні ознаки більш активно на DEBGs, ніж на DBBGs. Ці результати вказують на те, що DEBGs підтримують диференціацію остеокластів та резорбційну активність. Крім того, Ді Стефано та ін., у клінічному та гістоморфометричному дослідженні, проведеному через шість місяців після трансплантації, повідомили, що DEBGs були пов'язані з значно більшою кількістю новоутвореної кістки та нижчим відсотком залишкового біоматеріалу в порівнянні з DBBGs. У світлі наших висновків, наявність лакун резорбції, спостережуваних на поверхні DEBGs, може бути пов'язана з внутрішніми властивостями самого матеріалу, які, здається, ще більше посилюються обробкою VPST. Крім того, VPST покращує шорсткість поверхні та вологість, сприяючи кращій диференціації клітин та формуванню апатиту, що є критично важливим для успішної регенерації кістки. Аналіз твердої тканини, дійсно, виявив численні лінії відкладення кістки, що характеризуються наявністю остеобластоподібних клітин, які активно секретують остеоїдну матрицю. Секреторна активність остеобластів відіграє критичну роль у формуванні нової кістки та в успішній інтеграції біоматеріалу в тканини господаря. Ці результати підтвердили, що обробка VPST не порушила остеокондуктивні властивості трансплантату DEBG, тим самим підтримуючи його сумісність з фізіологічними процесами регенерації кістки. Крім того, одночасна дія відкладення матриці, опосередкованої остеобластами, та резорбції, опосередкованої остеокластами, формує основу фізіологічного ремоделювання кістки.
Цей динамічний процес ретельно регулюється через складну клітинну взаємодію між цими двома типами клітин.
Що стосується м'яких тканин, гістологічний аналіз виявив фізіологічну архітектуру з незначним фіброзним сполучним компонентом, що відповідає післяопераційному загоєнню. Ці результати узгоджуються з даними Пеллегріні та ін., які описали прогрес загоєння м'яких тканин після процедур пересадки кістки в техніках збереження лунки. Наявність незначного фіброзу в сполучній тканині можна інтерпретувати як частину нормальної фази ремоделювання, де фібробласти сприяють депозиції позаклітинного матриксу та зрілості тканин.
Клінічно, не було зафіксовано жодних невдач імплантів або протезів до одного року після встановлення імпланта, що підкреслює клінічну надійність біоматеріалів, оброблених плазмою. Це узгоджується з попередніми дослідженнями, які повідомляли про покращену стабільність імплантів та показники виживання, пов'язані з поверхнями, активованими плазмою. Відсутність біологічних або технічних ускладнень, за винятком ізольованого зламу титанової сітки, додатково підтверджує клінічну безпеку та ефективність запропонованого протоколу лікування. Взаємодія вакуумної плазми з біологічними об'єктами також може мати негативні наслідки, які потрібно враховувати. Можливим поясненням зламу титанової сітки було те, що титанову сітку обробили відразу після тестування на кістковому дефекті. Наявність біологічних рідин могла викликати гіперактивацію поверхні.
Наскільки відомо авторам, це перше дослідження, яке оцінює VPST на біоматеріалах. Незважаючи на ці обнадійливі результати, це дослідження має деякі обмеження. Малий розмір вибірки та природа клінічного аудиту обмежують узагальненість висновків. Крім того, відсутність контрольної групи заважає прямому порівнянню між плазмово-обробленими та необробленими біоматеріалами. Майбутні дослідження повинні включати більші, рандомізовані контрольовані випробування з тривалим спостереженням, щоб підтвердити ці попередні результати та встановити надійні клінічні рекомендації.
Висновки
Враховуючи обмежений розмір вибірки, ця попередня серія випадків демонструє, що VPST може покращити біологічну сумісність біоматеріалів, що використовуються в процедурах SP та GBR. Ці попередні результати можуть свідчити про те, що плазмова обробка може бути безпечно інтегрована в клінічні протоколи для потенційного покращення результатів оральної реабілітації. Потрібні подальші рандомізовані контрольовані випробування з розрахунком розміру вибірки, щоб підтвердити ці попередні результати та дослідити довгостроковий вплив на виживання імплантів та задоволеність пацієнтів.
Марко Талларіко, Мікеле Троя, Мілена Пізано, Сільвіо Маріо Мелоні, Даріо Мелодія, Клаудія Делла Вія, Доладжі Хенін, Франческо Маттіа Черузо, Карлотта Каччо та Ауреа Іммаколата Лумбау
Посилання
- Бузенлехнер, Д.; Фюрхаузер, Р.; Гаас, Р.; Ватзек, Г.; Мейлат, Г.; Поммер, Б. Довгостроковий успіх імплантатів в Академії оральної імплантології: 8-річне спостереження та аналіз факторів ризику. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Кім, Т.І. Дань пам'яті доктору Пер-Інгвару Бранемарку. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Мавродженіс, А.Ф.; Дімітріу, Р.; Парвізі, Дж.; Бабіс, Г.Ц. Біологія остеоінтеграції імплантатів. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71.
- Галуччі, Г.О.; Гамільтон, А.; Чжоу, В.; Бусер, Д.; Чен, С. Протоколи встановлення та навантаження імплантатів у частково беззубих пацієнтів: систематичний огляд. Clin. Oral Implant. Res. 2018, 29 (Suppl. S16), 106–134. [CrossRef]
- Вонг, М.; Еуленбергер, Дж.; Шенк, Р.; Хунцікер, Е. Вплив топології поверхні на остеоінтеграцію матеріалів імплантатів у трабекулярній кістці. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Веннерберг, А.; Альбректссон, Т. Про поверхні імплантатів: огляд сучасних знань та думок. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74.
- Веннерберг, А.; Альбректссон, Т. Вплив топографії поверхні титану на інтеграцію кістки: систематичний огляд. Clin. Oral Implant. Res. 2009, 20 (Suppl. S4), 172–184. [CrossRef]
- Казімієрчак, П.; Прзекора, А. Остеокондуктивні та остеоіндуктивні модифікації поверхні біоматеріалів для регенерації кістки: короткий огляд. Coatings 2020, 10, 971. [CrossRef]
- Канулло, Л.; Дженова, Т.; Чініго, Г.; Іаконо, Р.; Песче, П.; Меніні, М.; Муссано, Ф. Пристрій для вакуумної плазмової обробки для покращення активності фібробластів на оброблених та шорстких титанових поверхнях. Dent. J. 2024, 12, 71. [CrossRef] [PubMed]
- Шібата, Й.; Хосака, М.; Каваї, Х.; Міязакі, Т. Обробка титанових пластин плазмою з розрядом світла покращує адгезію остеобластоподібних клітин до пластин через механізм, опосередкований інтегринами. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777.
- Норо, А.; Канеко, М.; Мурата, І.; Йошинарі, М. Вплив топології поверхні та фізико-хімії поверхні на змочуваність цирконію (тетрагональний цирконій полі-кристал). J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 355–363. [CrossRef] [PubMed]
- Талларіко, М.; Мелоні, С.М.; Троя, М.; Каччо, К.; Лумбау, А.І.; Гендвілієнє, І.; Черузо, Ф.М.; Пізано, М. Використання вакуумної плазмової обробки поверхні для покращення гідрофільності та змочуваності біоматеріалів: in vitro дослідження. Dent. J. 2025, 13, 141. [CrossRef] [PubMed]
- Канулло, Л.; Пеллегріні, Г.; Канчані, Е.; Хайнеманн, Ф.; Галлієра, Е.; Деллавія, Ч. Техніка збереження альвеолярних лунок: вплив біоматеріалу на патерн регенерації кістки. Ann. Anat. Anat. Anz. 2016, 206, 73–79. [CrossRef] [PubMed]
- Лоруссо, Ф.; Алла, І.; Герхке, С.А.; Карміне, М.Д.; Тарі, С.Р.; Скарану, А. Вплив різних протезних з'єднань зубних імплантатів на втрату краєвої кістки: нові дані з байєсівського мережевого мета-аналізу (NMA) та систематичного огляду. Prosthesis 2024, 6, 186–205. [CrossRef]
- Удеабор, С.Е.; Хеселіх, А.; Аль-Маваї, С.; Алькатані, А.Ф.; Садер, Р.; Ганаті, С. Сучасні знання про загоєння лунки після видалення: наративний огляд. Bioengineering 2023, 10, 1145. [CrossRef]
- Перротті, В.; Нікколс, Б.М.; Піателлі, А. Формування та активність остеокластів людини на заміннику губчастої кістки коня. Clin. Oral Implant. Res. 2009, 20, 17–23. [CrossRef]
- Ді Стефано, Д.А.; Заніол, Т.; Чінчі, Л.; П'єрі, Л. Хімічне, клінічне та гістоморфометричне порівняння між кісткою коня, виготовленою шляхом ензимного усунення антигенів, та бикою кісткою, зробленою неантигенною за допомогою високотемпературного процесу в постекстракційній лунці. Порівняльне ретроспективне клінічне дослідження. Dent. J. 2019, 7, 70. [CrossRef]
- Ле, П.Т.М.; Шінтані, С.А.; Такадама, Х.; Іто, М.; Какутані, Т.; Кітагаки, Х.; Тераучі, С.; Уено, Т.; Накано, Х.; Накаджима, Й.; та ін. Обробка біоактивації з використанням змішаних кислот і тепла на титанових імплантатах, виготовлених методом селективного лазерного плавлення, покращує диференціацію преостеобластних клітин. Nanomaterials 2021, 11, 987. [CrossRef]
- Пеллегріні, Г.; Расперіні, Г.; Обот, Г.; Фарронато, Д.; Деллавія, Ч. Загоєння м'яких тканин у техніці збереження альвеолярної лунки: гістологічні оцінки. Int. J. Periodontics Restor. Dent. 2014, 34, 531–539. [CrossRef]
- Кахм, С.Х.; Лі, С.Х.; Лім, Й.; Чон, Х.Д.; Юн, К.І. Остеоінтеграція зубних імплантатів після вакуумної плазмової обробки in vivo. J. Funct. Biomater. 2024, 15, 278. [CrossRef]
- Песче, П.; Меніні, М.; Сантори, Г.; Джованні, Е.; Баганаско, Ф.; Канулло, Л. Фото- та плазмова активація титанових поверхонь зубних імплантатів. Систематичний огляд з мета-аналізом доклінічних досліджень. J. Clin. Med. 2020, 9, 2817. [CrossRef] [PubMed]
- Скрибанте, А.; Джіццоні, М.; Пеллегріні, М.; Пулікарі, Ф.; Манфредіні, М.; Полі, П.П.; Майорана, Ч.; Спадарі, Ф. Повноцінні цифрові кастомізовані сітки в процедурах керованої регенерації кістки: огляд. Prosthesis 2023, 5, 480–495. [CrossRef]
- Бергер, М.Б.; Бош, К.Б.; Коен, Д.Д.; Боян, Б.Д.; Шварц, З. Обробка титанових поверхонь на стенді плазмою покращує реакцію клітин. Dent. Mater. 2021, 37, 690–700. [CrossRef] [PubMed]
