Гістологічний аналіз біологічної ширини та орієнтації колагенових волокон навколо абатментів без гвинтів, з конусом Морса, напівсферичною основою через 8 і 16 тижнів після відкриття імплантів: спостережне клінічне дослідження
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Це дослідження мало на меті гістологічно оцінити, у людей, орієнтацію колагенових волокон навколо абатментів без гвинтів, з конусним з'єднанням, напівсферичною основою.
Методи: Це дослідження було спроектовано як спостережне, контрольоване клінічне випробування для оцінки гістологічної орієнтації колагенових волокон навколо імплантатів. Біопсії периімплантної тканини були проведені через 8 (група A, контроль) або 16 (група B, тест) тижнів після відкриття імплантату, і гістологічно проаналізовані під оптичним мікроскопом з використанням гістохімічного фарбування гематооксиліном і еозином, Масоном та Пікро Сіріусом, а також за допомогою скануючого електронного мікроскопа.
Результати: В це дослідження було включено вісім пацієнтів, і було проведено 16 біопсій. Усі біопсії були правильно проаналізовані. Гістологічне дослідження перерізів тканини, взятої через 8 тижнів після відкриття імплантату, показало майже повну відсутність епітеліального покриття, тоді як пучки сполучної тканини в поверхневій частині показали нижчий круговий малюнок. Гістохімічне дослідження перерізу тканини, взятої через 16 тижнів після відкриття імплантату, показало часткову присутність не-кератинізованого епітеліального покриття на місці імплантату, а пучки колагену показали більшу організацію, з окружним курсом навколо абатменту. Через 8 тижнів остаточний гістологічний аналіз показав середню висоту 1.01 мм для кератинізованого епітелію, 0.83 мм для не-кератинізованого епітелію та 1.39 мм для сполучної тканини. Тоді як через 16 тижнів значення становили 1.20 мм, 0.48 мм та 1.11 мм відповідно. Статистично значущих відмінностей між групами не було виявлено (p > 0.05).
Висновки: Гістологічно не було виявлено жодних відмінностей у висоті та профілі ясен між 8 та 16 тижнями загоєння після встановлення протеза. У тестовій групі (16 тижнів) було виявлено більшу організацію колагенових волокон з окружним курсом навколо абатмента в порівнянні з контрольною групою (8 тижнів).
Вступ
Успіх імплантаційного лікування в першу чергу визначається остеоінтеграцією, але насамперед залежить від підтримання стабільності як маргінальної кістки, так і м'яких тканин навколо імплантату з часом. Стабільну фізіологічну ремоделювання маргінальної кістки можна очікувати при середньо–довгостроковому спостереженні при використанні сучасних імплантаційних поверхонь та з'єднань. За останнє десятиліття концепція біологічної ширини була широко обговорена в стоматологічній імплантації. Характеристики пері-імплантаційної слизової визначаються під час встановлення біологічної ширини, яка відбувається після кількох тижнів загоєння після з'єднання загоювальних абатментів або протезних компонентів. Біологічна ширина навколо імплантату є складною системою розміром 3–4 мм. Вона простягається від верхівки пері-імплантаційної слизової до першого контакту кістки з імплантатом, складаючись з сулкової епітелії, з'єднувальної епітелії та волокнистої сполучної тканини. Однак було продемонстровано, що різне розташування волокон сполучної тканини навколо імплантатів відрізняється від природних зубів, з круговими або кільцеподібними розташуваннями, паралельними довгій осі та вставленому імплантату. Роль біологічної ширини полягає в створенні біологічного бар'єру проти токсичних продуктів від бактерій, захищаючи підлягаючу кістку. В останні роки ця концепція стала дуже популярною в сучасній стоматологічній імплантології, яка більше орієнтована на потреби управління м'якими тканинами. Управління м'якими тканинами може здійснюватися різними хірургічними техніками та в різний час під час імплантаційного лікування, залежно від початкового дефекту, анатомічної області та естетичних міркувань. Коротко кажучи, можна виконати збільшення кератинізованої тканини, щоб отримати смугу кератинізованої тканини навколо імплантатів, що покращує їх естетичні результати та зменшує ризик накопичення нальоту. Навпаки, можна виконати збільшення товщини м'яких тканин, щоб збільшити товщину пері-імплантаційних супракрестальних м'яких тканин, які є вирішальними для отримання природного профілю виходу для протезної реставрації та забезпечення задовільного естетичного результату. Більше того, тонкий біотип або фенотип часто йде всупереч резорбції для відновлення правильної біологічної ширини. Мікрогапи та мікро-рухи на інтерфейсі імплантат–абатмент також відіграють важливу роль у стабільності пері-імплантаційних жорстких і м'яких тканин. Мікропроникність на інтерфейсі імплантат–абатмент може визначати проходження бактерій і вивільнення малих титанових частинок, які викликають запалення в пері-імплантаційних тканинах. З цих причин сьогодні імплантати з конічним з'єднанням Морса та без з'єднувального гвинта можуть бути хорошим вибором.
Супрагінгівальний волокнистий апарат складається з щільної мережі пучків колагенових волокон
, які прикріплюють ясна до зубів і кістки, одночасно з'єднуючи вестибулярні та оральні міжзубні сосочки [9]. Ця волоконна мережа забезпечує механічний опір, дозволяючи яснам витримувати тертя під час жування. Юкціональний епітелій формує корональну частину дентогінгівального з'єднання, тоді як апікальна частина складається з дентогінгівальних сполучнотканинних волокон, що простягаються в кореневий цемент, забезпечуючи прикріплення сполучної тканини. Пері-імплантаційна слизова оболонка навколо успішних ендоосальних імплантів має багато спільного з тканинами, що оточують природні зуби. Ламінарна проприа простягається коронально від альвеолярної кістки і покрита кератинізованим оральним епітелієм. У здорових умовах формується неглибокий сулкус, вистелений сулкулярним епітелієм. Серед тканин, що контактують з імплантом, юкціональний епітелій найбільше нагадує епітелій природного зуба, формуючи біологічне прикріплення через базальну ламіну та гемідесмосоми. Однак існують відмінності в тому, як сполучні тканини взаємодіють з імплантами через відсутність кореневого цементу. У той час як дентогінгівальні волокна в природних зубах прикріплюються перпендикулярно або косо до мінералізованого цементу, їхнє пряме прикріплення до імплантів залишається предметом дискусій. Більшість сполучнотканинних волокон проходять паралельно до поверхні імпланта, або в коронально-апікальному напрямку, або по колу. Деякі дослідження вказують на наявність волокон, орієнтованих перпендикулярно або косо до поверхні імпланта, особливо на мікротекстурованих, а не гладких трансмукозних поверхнях.
Метою цього клінічного випробування було попереднє оцінювання, у людей, вимірювання біологічної ширини та орієнтації колагенових волокон навколо імплантатів без гвинтів, конічних, напівсферичних основ через 8 та 16 тижнів після відкриття імплантатів. Наступний рукопис був написаний відповідно до рекомендацій STROBE для звітування про спостережні клінічні випробування.
Матеріали та методи
Це дослідження було спроектовано як спостережне, контрольоване клінічне випробування, і його метою було оцінити висоту та профіль біологічної ширини, а також орієнтацію колагенових волокон навколо імплантатів без гвинтів, конічних з'єднань імплантатів та абатментів серед учасників через 8 та 16 тижнів після відкриття імплантатів. Це дослідження проводилося відповідно до принципів, викладених у Декларації Гельсінкі щодо біомедичних досліджень за участю людей, з поправками 2018 року. Дослідницький протокол отримав етичне схвалення від Університету Бухареста в Румунії (номер протоколу 15/2024, 16 грудня 2024 року) і був зареєстрований в онлайн-базі даних клінічних досліджень (номер реєстрації: NCT06862505; 5 березня 2025 року). Будь-який пацієнт віком 18 років або старше, який страждає на часткову адентію задніх (премолярів та молярів) елементів, потребуючи щонайменше двох одиничних реабілітацій імплантатів без необхідності в м'якій та/або тканинній аугментації, і здатний зрозуміти та підписати форму інформованої згоди, вважався таким, що відповідає критеріям цього дослідження. Пацієнти були виключені, якщо були присутні будь-які з наступних критеріїв виключення: системні або місцеві протипоказання для встановлення імплантатів; нелікована пародонтальна хвороба; куріння; остеопороз; неконтрольований діабет; відмова від реабілітації імплантатів; відмова від збору біопсії; та системні патології, які могли б загрожувати загоєнню періімплантаційних тканин. Всім обраним пацієнтам було повідомлено про всі хірургічні та протезні процедури, включаючи переваги та потенційні ризики та ускладнення цього дослідження, і письмова інформована згода була отримана перед остаточним зарахуванням.
2.1. Передопераційний та хірургічний протокол
Пацієнти спочатку підлягали клінічним та інструментальним дослідженням для визначення їх загального стану здоров'я та відповідності. Інструментальні тести, які вимагав відділ в рамках нормального протоколу, були наступними: аналізи крові, ЕКГ та кардіологічне обстеження, а також комп'ютерна томографія конусного пучка щелепи. Приблизно за 10 днів до встановлення імплантатів всі пацієнти пройшли сеанси професійної гігієни порожнини рота. Усі пацієнти отримали профілактичну антибіотикотерапію: 2 г амоксициліну за 1 годину до втручання або кліндаміцин 600 мг за 1 годину до встановлення імплантату у разі алергії на пеніцилін. Усі пацієнти полоскали рот розчином хлоргексидину 0,2% протягом 1 хвилини перед будь-якою хірургічною процедурою. Місцева анестезія (Септанест з адреналіном, 1/100,000, Септодонт, Матаро, Іспанія) вводилася інфільтраційною технікою. Розріз та підняття трапецієподібного мукоперіостального клаптя виконувалися на обраному місці для імплантації. Після оголення кістки проводилася остеотомія з використанням пілотного направляючого діаметром 2,0 мм, на 1100 об/хв, з зовнішнім холодним зрошенням. Початкова остеотомія була розширена відповідно до інструкцій виробника. Короткі зубні імплантати (система Bicon, Бостон, Массачусетс, США) для заміни одного або кількох зубів були вставлені на 2-3 мм нижче рівня краю маргінальної кістки, і використовувалися загоювальні капсули. Клапоть був повторно розташований і пасивно зашитий для забезпечення загоєння первинним натяганням. Використовувався двоетапний хірургічний протокол. Через три місяці після встановлення імплантатів місцева анестезія (Септанест з адреналіном, 1/100,000, Септодонт, Матаро, Іспанія) проводилася інфільтраційною технікою з вазоконстриктором. Усі імплантати були оголені шляхом виконання мінімально інвазивних лінійних розрізів на гребені та видалення всіх тканин росту зверху. Після видалення загоювальної капсули було зроблено зліпок з фіксацією.
Після цього був вставлений полімерний загоювальний абатмент діаметром 4 (премоляри) або 5 (моляри) мм, який був закріплений на імплантатах. Пацієнти були рандомізовані на групи, які отримали свої остаточні реставрації через 8 (контрольна) або 16 (тестова) тижнів після з'єднання загоювального абатмента, щоб оцінити загоєння м'яких тканин навколо імплантатів за різні часові інтервали. Для всіх пацієнтів було проведено інтраоральне рентгенографічне обстеження місця імплантації, щоб оцінити правильність фіксації загоювального абатмента спочатку та їх остаточної реставрації пізніше. Використовувалася система вирівнювання Рінна.
2.2. Техніка збору біопсії
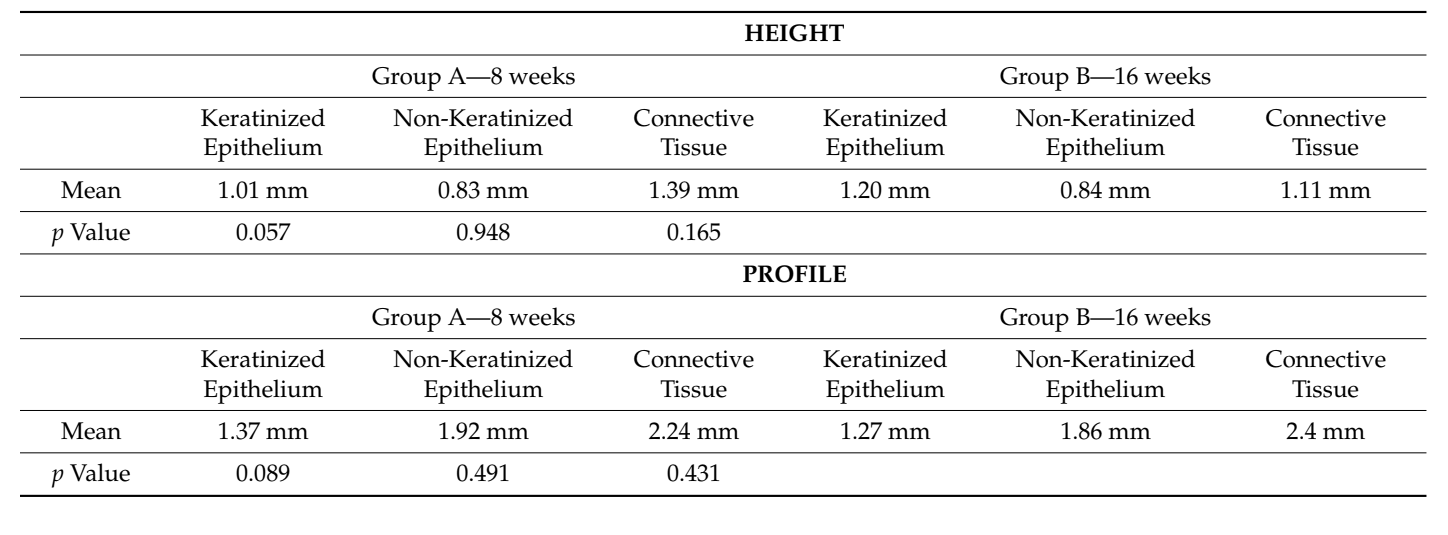
В обох групах, на різних часових інтервалах, біопсія м'яких тканин навколо імпланта була отримана безпосередньо перед доставкою остаточної протези. Анестезія проводилася інфільтраційною технікою на відстані 10 мм від місця взяття зразка. Мукотома діаметром 5 (премоляри) або 6.5 (моляри) мм використовувалася навколо напівсферичних базових абатментів. Кожен зразок включав м'які тканини, що утворилися навколо абатментів під час періоду загоєння 8 або 16 тижнів (Рисунок 1). Зразки були розділені на дві ідентичні частини. Перші зібрані частини тканини були зафіксовані в 10% нейтральному буферному формаліні для оптичного дослідження. Другі частини були зафіксовані в глутар альдегіді 2.5% у PBS 0.1 M pH 7.4 протягом щонайменше 4 днів для спостереження за допомогою скануючого електронного мікроскопа. Післяопераційне знеболювальне лікування ібупрофеном 600 мг призначалося за потребою. Усі пацієнти були ретельно спостережені протягом наступних шести місяців для оцінки повного загоєння зібраної м'якої тканини.
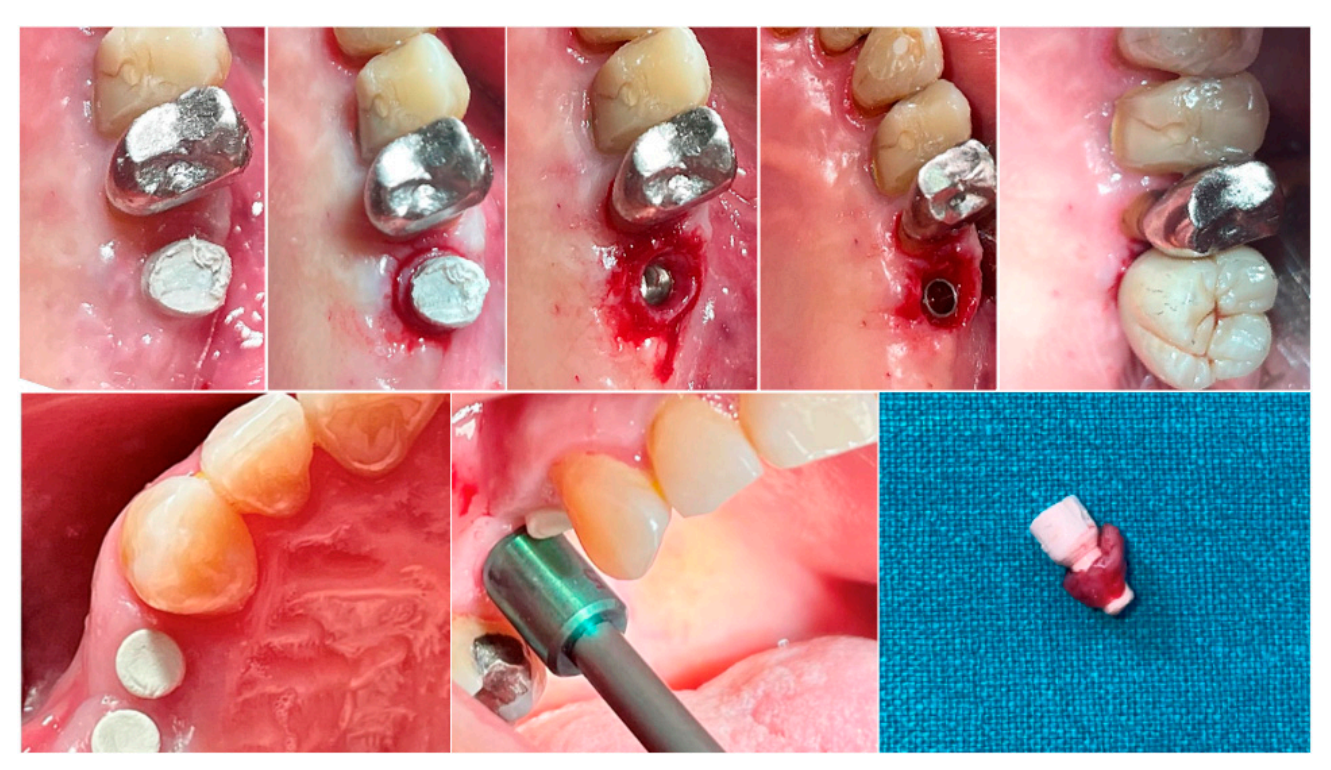
2.3. Результати вимірювань
Основним результатом було невдача імплантату, визначена як рухливість, інфекція, перелом та/або будь-яка інша механічна або біологічна проблема, яка вимагала його видалення. Крім того, будь-які біологічні (наприклад, стійкий до ліків біль, набряк, надмірна MBL, гній, тощо) та/або технічні (наприклад, перелом облицювального матеріалу та/або каркасу, розхитування гвинтів, тощо) ускладнення були зафіксовані під час спостереження.
Вторинними результатами були гістологічний аналіз з гістоморфометрією та аналізом за допомогою скануючого електронного мікроскопа (SEM).
Усі гістологічні зразки були проаналізовані в кафедрі радіологічних, онкологічних та патологічних наук університету "La Sapienza", Рим, Італія. Для гістологічної діагностики були визначені дві групи: ті, хто пройшов 8 або 16 тижнів загоєння після відкриття імплантату. Для гістологічного аналізу зібрані зразки були додатково поділені на дві частини для поперечних і поздовжніх досліджень. Усі зразки були вмонтовані в парафін і нарізані за допомогою мікротома для отримання поперечних і поздовжніх зрізів, які використовувалися для морфологічних аналізів. Для кожного зразка, зафіксованого формаліном, дві частини були вмонтовані в парафіновий віск, перша нарізана вздовж поздовжньої осі, щоб побачити всі довгі осі зразка, а друга - вздовж напівциркулярної осі, щоб побачити коротку вісь зразка. Гістологічні зрізи були пофарбовані гематооксиліном і еозином, трихромом Масона та Пікро Сіріусом, і спостерігалися за допомогою оптичного мікроскопа Leica (Leitz Camera, Ветцлар, Німеччина).
Організація колагенових волокон була оцінена шляхом гістологічного дослідження перерізів, забарвлених гематоксиліном та еозином, трихромом Масона та Пікро Сіріусом (з поляризованим світлом та без нього) та спостерігалася за допомогою оптичного мікроскопа Leica. Біологічна ширина вимірювалася як висота та профіль поздовжніх гістологічних зрізів, проаналізованих за допомогою світлової мікроскопії та гістохімічно забарвлених гематоксиліном та еозином, і спостерігалася за допомогою оптичного мікроскопа Leica. Організація колагенових волокон також була оцінена за допомогою скануючого електронного мікроскопа (ZEISS EVO 40, ZEISS, Оберкохен, Німеччина).
Кількісні гістоморфометричні вимірювання були оцінені на поздовжніх зрізах за допомогою програмного забезпечення ImageJ 1.54 (Національний інститут здоров'я, Бетесда, Меріленд, США) при збільшенні 1.6× . Стандартизація мікроскопа була забезпечена використанням одного й того ж оптичного мікроскопа Leica для морфологічних аналізів, а двоє експертів-дослідників (R.C., C.D.G.), які не знали типу зразка, виконали оцінки та гістоморфологічні вимірювання.
Для аналізу за допомогою скануючого електронного мікроскопа зразки піддавали постфіксації в розчині осмію тетроксиду 2% у H2O протягом 2 годин. Потім зразки були промиті в H2O двічі по 20 хвилин, щоб видалити розчин постфіксації. Далі була проведена дегідратація в зростаючій серії спиртових розчинів (30–50–70–95–100%). Щоб зберегти їх ультраструктурні поверхневі деталі, зразки були висушені в апараті Emitech K850, “сушіння в критичній точці” (Emitech Ltd., Ashford, Kent, England). Висушені зразки були закріплені за допомогою срібного клею на алюмінієвих стержнях, а потім покриті платиновим шаром (2 хв, 15 мА) за допомогою покривного апарата Emitech K 550 (Emitech Ltd., Ashford, Kent, England). Зразки спостерігалися в умовах високого вакууму при 12 кВ за допомогою скануючого електронного мікроскопа Hitachi SU3500 (Hitachi Ltd., Hitachi, Japan).
2.4. Розмір зразка та рандомізація
Розрахунок розміру зразка не проводився через те, що дане дослідження вважалося пілотним, спостережним клінічним випробуванням. Було створено комп'ютерно згенерований список рандомізації. Тільки один з дослідників, який не брав участі у відборі та лікуванні пацієнтів, знав про послідовність рандомізації. Рандомізовані коди були поміщені в послідовно пронумеровані, ідентичні, непрозорі, запечатані конверти. Конверти відкривалися послідовно відразу після зняття відбитків; таким чином, розподіл лікування залишався прихованим для дослідників під час набору та лікування пацієнтів.
2.5. Статистичний аналіз
Всі аналізи були проведені відповідно до попередньо встановленого плану аналізу з використанням програмного забезпечення SPSS для Mac OS X (версія 22.0; SPSS, Чикаго, Іллінойс, США). Дані аналізував стоматолог (М.Т.). Описовий аналіз був проведений для числових параметрів з використанням середніх значень ± SD. Відмінності в середніх складах тканин (висота та профіль) на 8 та 16 тижнях порівнювалися за допомогою парних t-тестів. Пацієнт був статистичною одиницею аналізу. Всі статистичні порівняння проводилися з рівнем значущості 0.05.
Результати
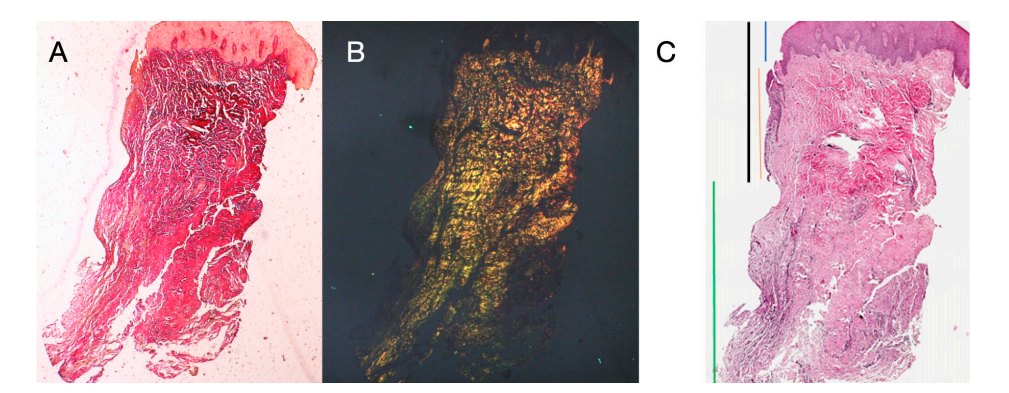
Були обрані вісім пацієнтів віком від 38 до 63 років, чотири жінки та чотири чоловіки (середній вік 51.5 ± 9 років). Кожен пацієнт отримав дві біопсії в двох різних місцях відповідно до рандомізації. Як на 8, так і на 16 тижнях після відкриття імплантату клінічне обстеження показало здорові періімплантні тканини. Жоден пацієнт не відмовився від участі. Жоден імплантат не зазнав невдачі під час остеоінтеграції, і не було зафіксовано біологічних або технічних ускладнень до шести місяців після доставки протеза. У світловій мікроскопії тканини показали повну відсутність запалення та підвищену організацію колагенових волокон, розташованих по колу навколо абатмента. Кількість тканини, включеної в зразки, дозволила підготувати кілька зрізів з різними фарбуваннями для світлової та скануючої електронної мікроскопії. Гістологічне дослідження перетинів, взятих через 8 тижнів після відкриття імплантату, показало майже повну відсутність епітеліального покриття в місці імплантату, яке складалося з пухкої сполучної тканини з невеликими, новоутвореними судинами на фоні вогнищевих геморагічних екстравазацій та лімфоцитарного запального інфільтрату. Сусідня сполучна тканина виглядала щільнішою, з рясним запальним інфільтратом, що складається з лімфоцитів і плазматичних клітин, переважно розташованих навколо малих судинних структур. Крім того, пучки сполучної тканини в поверхневій частині показали круговий малюнок. Під час дослідження трихромного забарвлення Масона та Пікро Сіріуса останнє, спостережуване під оптичним мікроскопом з поляризованим світлом, продемонструвало майже виключну присутність колагену типу I (Рисунок 2).
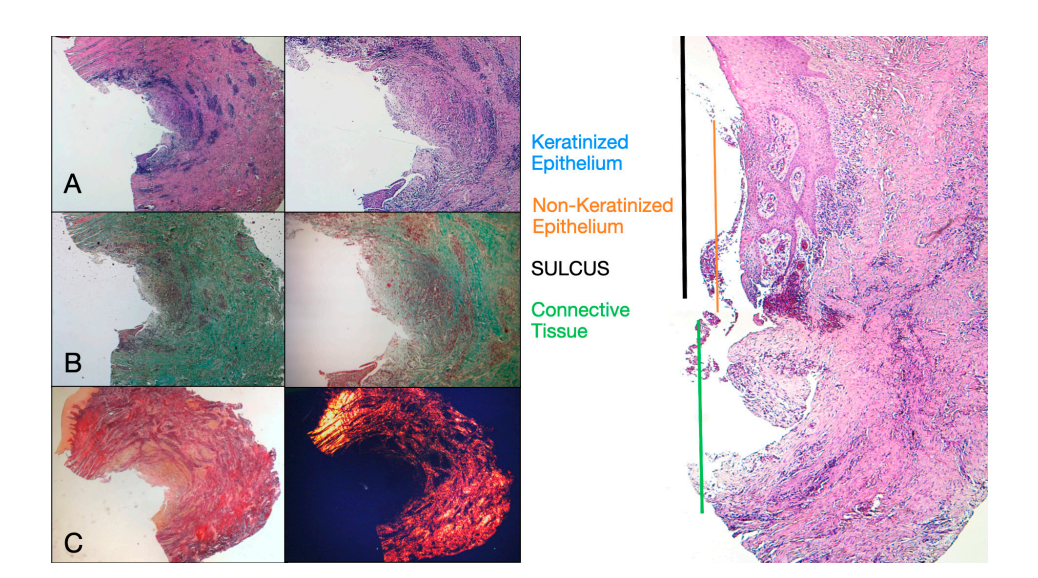
Тканина, проаналізована в поздовжніх зрізах, показала, як область сулькуса поділяється на дві частини, які характеризуються областю, що починається від ясеневого краю, вистеленою кератинізуючим епітелієм Малпігія, та областю, вистеленою епітелієм з менш вираженою кератинізацією. Остання безперервна з деепітелізованою областю, що складається виключно з пухкої сполучної тканини з новоутвореними судинами. У контексті сполучної тканини є лімфоцитарний та плазматичний клітинний запальний інфільтрат у підепітеліальних та периваскулярних областях (Рисунок 1). Пікра-Сіріус забарвлення поздовжнього зрізу, взятого через 8 тижнів після відкриття імплантату, показує наявність деяких пучків колагену, що походять з частини сполучної тканини, прилеглої до кістки, які йдуть вертикально до вільного краю ясен, разом із суттєвою дезорганізацією інших колагенових волокон (Рисунок 3).
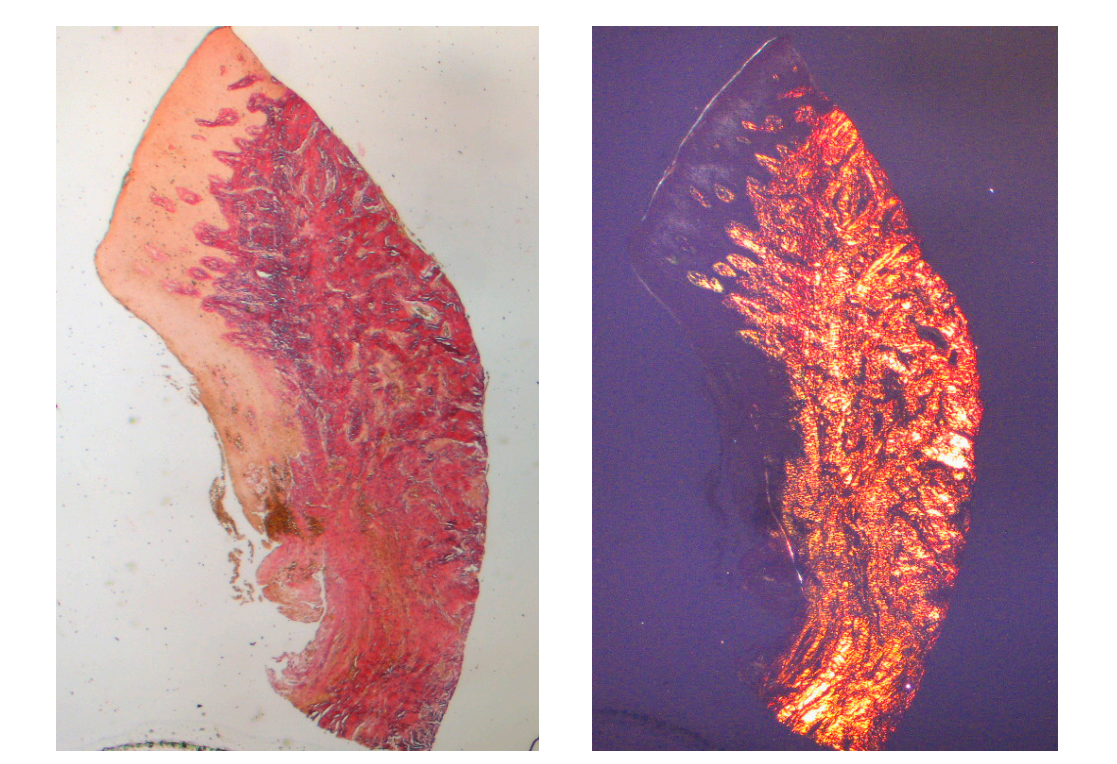
Гістохімічне дослідження зрізу тканини, взятої через 16 тижнів після відкриття імплантату, показує часткову присутність некератинізованого епітеліального покриття на місці імпланта, яке складається з зрілої пухкої сполучної тканини, вільної від запального інфільтрату. Найзовнішня сполучна тканина більш організована, ніж у попередньому зразку. Колагенові пучки показали більшу організацію з циркулярним курсом навколо абатмента. Забарвлення за методом трихромного Масона та Пікро Сіріуса, останній також спостерігався з поляризованим світлом, продемонструвало майже виключну присутність колагену типу I. Зображення, отримані з цими барвниками, більш чітко показують організацію та орієнтацію кругових волокон. Забарвлення поздовжнього зрізу за методом Пікро Сіріуса показує, незважаючи на артефакти, вертикальну організацію колагенових волокон у нижній частині зразка (Рисунок 4).
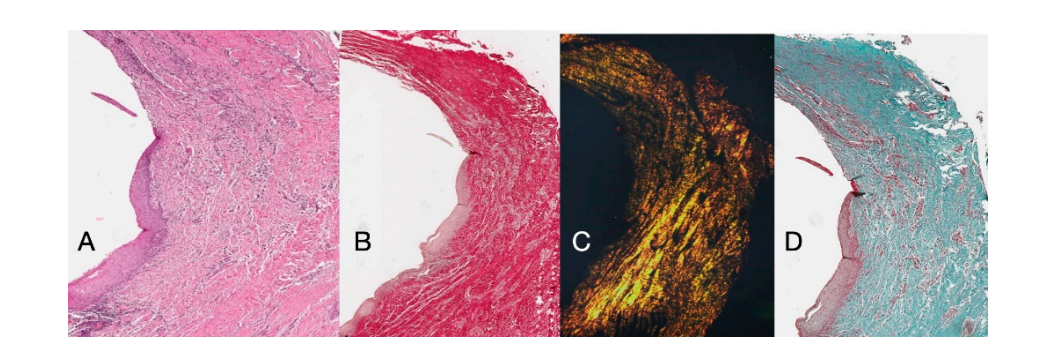
Гістохімічні поздовжні зрізи, взяті через 16 тижнів після відкриття імплантату, показали області соска, розділені на область, що починається від ясеневого краю, вистелену кератинізованим епітелієм Малпігія, та область, вистелену некератинізованим епітелієм. Остання безперервна з деепітелізованою областю, що складається виключно з сполучної тканини. Було показано, що сполучна тканина складається з колагену типу I і не містить запального інфільтрату (Рисунок 5).
Нарешті, гістологічний аналіз не показав статистично значущих відмінностей між складом м'яких тканин на обох часових інтервалах як за висотою, так і за профілем. Середні біологічні ширини, виміряні на 8 і 16 тижнях, становили 3.2 і 3.1 мм за висотою, і 5.5 за профілем на обох контрольних точках (Таблиця 1).
Спостереження за зразками за допомогою електронного мікроскопа з низьким збільшенням (Рисунок 6A) показує, що періімплантна слизова оболонка вільна від запалення, набряку або екстравазації крові. Навколо загоювального абатмента спостерігається наявність зрілого сполучної тканини, багатої на впорядковані колагенові волокна. При більш високих збільшеннях (Рисунок 6B,C) видно хвилясті колагенові волокна, організовані впорядковано та паралельно; вони мають переважно кругову організацію навколо абатмента.
Щоб детальніше проаналізувати цю щільну матрицю, були отримані зображення при збільшеннях 300× та 500× за допомогою скануючого електронного мікроскопа. При цих збільшеннях легко можна спостерігати тонкі колагенові волокна, які виходять з базальної мембрани (Рисунок 6D,E) і які виступають як окремі волокна, не організовані в пучки.

Обговорення
Сьогодні зубні імплантати є поширеною та надзвичайно ефективною процедурою для відновлення втрачених зубів. Дослідження факторів, які підтримують періімплантні тканини в стабільному та тривалому здоровому стані, стало основною метою досліджень імплантатів. Для зменшення втрати краєвого кісткового обсягу та підтримання рівнів періімплантних м'яких тканин були встановлені різні підходи, включаючи мікро- та макро-дизайни імплантатів, хірургічні та протезні процедури, зміни платформи та з'єднання імплант–абатмент.
Основна функція пародонтальних тканин, крім прикріплення зуба до щелепи, полягає в захисті ясен; тобто їхня функція полягає в забезпеченні герметичності проти забрудненого середовища ротової порожнини, витримуванні тертя під час жування та захисті інтерфейсу між зубами та м'якими тканинами від чужорідних вторгнень. Біологічна ширина навколо імплантату відрізняється від такої навколо натуральних зубів багатьма способами, включаючи концепцію, формування, ремоделювання, розмір та структуру, і відіграє важливу роль у ремоделюванні періімплантних м'яких та твердих тканин. У даному дослідженні збори періімплантних м'яких тканин проводилися через 8 та 16 тижнів після відкриття імплантату та встановлення полімерного напівсферичного загоювального абатменту. Вісім тижнів загоєння було обрано як контрольний стан. Наявність природного бар'єру з сполучної тканини та епітелію через 8 тижнів узгоджується з кількома дослідженнями, які проводили експерименти на тваринах. Однак збори, проведені через 8 тижнів, показали скромне ремоделювання, з периваскулярним лімфоцитарним та плазматичним клітинним інфільтратом, а періімплантні тканини мали морфоструктурні характеристики, накладені на здорові тканини. Зразки через 16 тижнів показали повну відсутність запалення та підвищену організацію колагенових волокон, розташованих по колу навколо абатменту. Крім того, у поздовжніх гістологічних зрізах спостерігався морфоструктурний малюнок, де область соска була поділена на дві частини, одна з яких починалася від ясеневого краю, вистелена кератинізуючим епітелієм Малпігія, а інша частина вистелена епітелієм з менш очевидною кератинізацією (JE). Основне розташування волокон було паралельним у поздовжніх зрізах (Рисунок 4), відносно осі імплантату, і круговим у поперечних зрізах (Рисунок 3). При більшому збільшенні, 300× та 500× (Рисунок 6B,C) можна було спостерігати хвилясті колагенові волокна, розташовані впорядковано та паралельно. Ці волокна в основному демонстрували кругову організацію навколо абатменту. Тонкі колагенові волокна, що виходять з базальної мембрани та проекціюються як окремі волокна, не організовані в пучки, можна було легко спостерігати на зображеннях SEM при збільшенні 3000× та 5000× (Рисунок 6D,E).
Дослідження показало, що дизайн напівсферичного абатмента сприяє формуванню структурованого з'єднувального тканинного манжета з високо вирівняними волокнами, у порівнянні з випадковим розподілом, що спостерігається в абатментах з паралельними стінками. Це свідчить про те, що організація ECM може бути під впливом макромасштабної геометрії тканини, що направляє розташування волокон і морфогенез. Подібні дослідження описували цей ефект у імплантатах з перемиканням платформи, де орієнтація колагену забезпечує механічне утримання для періодонтальних волокон. Моделі тварин також повідомляли про супракрестальні кругові мережі колагенових волокон, порівнянні з ясенними зв'язками.
Недавнє доклінічне дослідження продемонструвало, що увігнутий трансмукозний дизайн може сприяти більшій депозиції та росту з'єднувальної тканини в порівнянні з прямим дизайном. Результати вказували на збільшення товщини з'єднувальної тканини, щільнішої періімплантної мережі та вирівнювання колагенових волокон у напрямку до коміра абатмента, формуючи широку кругову структуру колагену навколо платформи імплантату. Дане дослідження підтримує ці спостереження, оскільки введення напівсферичного профілю сприяло розташуванню колагенових волокон у добре організовані паралельні пучки.
Орієнтація колагенових волокон є ключовим біомеханічним фактором, що відображає сили, які діють на сполучну тканину, особливо через колагенові пучки. Дослідження показали, що надмірне накопичення випадково орієнтованого колагену може призвести до формування дисфункціональної фіброзної тканини. Направлена організація колагенових волокон є вирішальною для стабільності м'яких тканин навколо імплантів, як зазначено Карьялайненом та ін.
У даному дослідженні середні біологічні ширини становили 3.2 і 3.1 мм на 8 і 16 тижнях відповідно. Порівнюючи отримані результати з іншими подібними дослідженнями, у дослідженні Томасі та ін., на 8 тижні після відкриття середнє значення становило 2.7 мм, включаючи 1.5 мм епітелію та 1.2 мм сполучної тканини, тоді як профільний розмір становив 3.6 мм. У даному дослідженні середні біологічні ширини були трохи вищими як в епітелії, так і в сполучній тканині. Однак було виявлено значне збільшення загального профілю. Основна різниця полягає в тому, що в дослідженні Томасі другий контроль був на 12 тижні замість 16 тижня. Можливе пояснення цієї різниці полягає в тому, що тканини продовжують рости принаймні 4 місяці після повторного відкриття.
За допомогою СЕМ також можливо виявити хвилясті колагенові волокна, організовані впорядковано та паралельно, з переважно круговою організацією навколо абатмента.
У зв'язку з цим можна припустити, що переважаючі організації круглих колагенових смуг і вертикальних колагенових смуг були організовані стосовно дизайну абатмента. З цієї точки зору можливість використання імплантатів або систем імплантат-коронка, які сприяють стабільності слизового герметика, представляє важливу область досліджень. Це рішення зміщує сполучний герметик апікально стосовно протезних компонентів, мікро-рухи яких — часто заважаючи стабільному формуванню сполучної тканини — не компрометують остаточну стабілізацію герметика. Основним обмеженням даного дослідження був малий розмір вибірки, оскільки розрахунок розміру вибірки не був проведений. Потрібні подальші клінічні випробування з більшими вибірками, щоб підтвердити ці попередні результати.
Висновки
Гістологічно не було виявлено жодних відмінностей у висоті та профілі ясен між 8 та 16 тижнями загоєння після відкриття імплантів. На 16 тижні в обох групах було виявлено більше тканини. У тестовій групі (16 тижнів) було виявлено більшу організацію колагенових волокон у циркумференційних курсах навколо абатментів у порівнянні з контрольною групою (8 тижнів).
Фабріціо Заккео, Джулія Петроні, Марко Талларіко, Черена Джіога, Раффаелла Карлетті, Чіра Розарія Тіціана Ді Джоя, Вінченцо Петроза, Сільвіо Маріо Мелоні, Даріо Мелодія, Мілена Пізано та Андреа Чікконетті
Посилання:
- Талларіко, М.; Лумбау, А.М.І.; Мелоні, С.М.; Іерія, І.; Парк, К.-Дж.; Задрозьний, Л.; Ханарі, Е.; Пізано, М. П'ятирічне проспективне дослідження невдач імплантів та ремоделювання краєвого кістки, очікуване при використанні імплантів з рівнем кістки з піскоструйною/кислотно-етчною поверхнею та конічним з'єднанням. Eur. J. Dent. 2022, 16, 787–795. [CrossRef]
- Чжен, З.; Ао, Х.; Сі, П.; Цзян, Ф.; Чен, В. Біологічна ширина навколо імпланта. J. Prosthodont. Res. 2021, 65, 11–18. [CrossRef]
- Берґлунд, Т.; Ліндхе, Й. Розміри періімплантної слизової. Біологічна ширина знову розглянута. J. Clin. Periodontol. 1996, 23, 971–973. [CrossRef]
- Шеріано, Г.; Рамієрі, Г.; Кортезе, М.; Аіметті, М.; Преті, Г. Організація сполучнотканинного бар'єра навколо довгостроково навантажених імплантних абатментів у людини. Clin. Oral Implant. Res. 2002, 13, 460–464. [CrossRef]
- Родрігес, Х.; Навас, А.; Вела, Х.; Фортуно, А.; Хіменес, Х.; Невінс, М. Розташування волокон періімплантної сполучної тканини навколо імплантів з платформним перемиканням з конічними абатментами та його зв'язок з підлягаючою кісткою: Гістологічне дослідження на людях. Int. J. Periodontics Restor. Dent. 2016, 36, 533–540. [CrossRef]
- ван Екерен, П.; ван Ельсас, П.; Тахмассеб, А.; Вісмейєр, Д. Вплив початкової товщини слизової на зміни кістки в аналогічних макрогеометричних імплантах: Проспективне рандомізоване клінічне дослідження. Clin. Oral Implant. Res. 2017, 28, 214–218. [CrossRef]
- Мішра, С.К.; Чоудхарі, Р.; Кумарі, С. Мікротріщини на різних інтерфейсах імплант-абатмент: Систематичний огляд. J. Clin. Diagn. Res. 2017, 11, ZE10–ZE15. [CrossRef]
- Талларіко, М.; Канулло, Л.; Каневa, М.; Озкан, М. Мікробна колонізація на інтерфейсі імплант-абатмент та її можливий вплив на періімплантит: Систематичний огляд та мета-аналіз. J. Prosthodont. Res. 2017, 61, 233–241. [CrossRef]
- Шрьодер, Х.Е.; Лістгартен, М.А. Ясеневі тканини: Архітектура пародонтального захисту. Пародонтологія 2000 1997, 13, 91–120. [CrossRef]
- Шупбах, П.; Глаузер, Р. Архітектура захисту людської періімплантної слизової: гістологічне дослідження. J. Prosthet. Dent. 2007, 97 (Suppl. S6), S15–S25, Erratum in J. Prosthet. Dent. 2008, 99, 167. [CrossRef]
- Джеймс, Р.А.; Шульц, Р.Л. Гемідесмосоми та адгезія юкстапозиційних епітеліальних клітин до металевих імплантів—попередній звіт. J. Oral Implantol. 1974, 4, 294–302.
- Ацута, І.; Аюкава, Й.; Кондо, Р.; Оширо, В.; Мацуура, Й.; Фурухаші, А.; Цукіяма, Й.; Кояно, К. Запечатування м'яких тканин навколо зубних імплантів на основі гістологічної інтерпретації. J. Prosthodont. Res. 2016, 60, 3–11. [CrossRef]
- Берґлунд, Т.; Абрахамссон, І.; Велендер, М.; Ланг, Н.П.; Ліндхе, Й. Морфогенез періімплантної слизової: експериментальне дослідження на собаках. Clin. Oral Implant. Res. 2007, 18, 1–8. [CrossRef] [PubMed]
- Морашіні, В.; Пубель, Л.д.К.; Феррейра, В.; Барбоза, Е.д.С. Оцінка виживаності та успішності зубних імплантів, про які повідомляється в довгострокових дослідженнях з періодом спостереження не менше 10 років: систематичний огляд. Int. J. Oral Maxillofac. Surg. 2015, 44, 377–388. [CrossRef]
- Атієх, М.А.; Ібрагім, Х.М.; Атієх, Х.А. Платформне перемикання для збереження краєвої кістки навколо зубних імплантів: систематичний огляд та мета-аналіз. J. Periodontol. 2010, 81, 1350–1366.
- Бателі, М.; Атт, В.; Струб, Дж.Р. Конфігурації шийки імпланта для збереження рівня краєвої кістки: систематичний огляд. Int. J. Oral Maxillofac. Implant. 2011, 26, 290–303.
- Шварц, Ф.; Хегевальд, А.; Беккер, Дж. Вплив з'єднання імплант-абатмент та позиціонування обробленого коміра/мікрозазору на зміни рівня краєвої кістки: систематичний огляд. Clin. Oral Implant. Res. 2014, 25, 417–425. [CrossRef]
- Тетè, С.; Мастрангело, Ф.; Б'янкі, А.; Ціззарі, В.; Скаранo, А. Орієнтація колагенових волокон навколо оброблених титанових та цирконієвих шийок зубних імплантів: експериментальне дослідження на тваринах. Int. J. Oral Maxillofac. Implant. 2009, 24, 52–58.
- Шварц, Ф.; Хертен, М.; Загер, М.; Бієлінг, К.; Скулян, А.; Беккер, Дж. Порівняння природних та індукованих лігатурою дефектів кістки періімплантиту у людей та собак. Clin. Oral Implant. Res. 2007, 18, 161–170, Erratum in Clin. Oral Implant. Res. 2007, 18, 397. [CrossRef] [PubMed]
- Віньолетті, Ф.; Йоганссон, С.; Альбректссон, Т.; Де Санктіс, М.; Роман, Ф.С.; Санз, М. Раннє загоєння імплантів, розміщених у свіжих екстракційних лунках: експериментальне дослідження на собаках біглів. Формування нової кістки. J. Clin. Periodontol. 2009, 36, 265–277. [CrossRef] [PubMed]
- Лю, Й.; Ван, Дж. Впливи мікрозазору та мікродвигунів інтерфейсу імплант-абатмент на втрату краєвої кістки навколо шийки імпланта. Arch. Oral Biol. 2017, 83, 153–160. [CrossRef] [PubMed]
- Родрігес, Х.; Вела, Х.; Кальво-Гуїрадо, Дж.Л.; Нарт, Дж.; Степперт, К.Ф. Вплив платформного перемикання на орієнтацію колагенових волокон та резорбцію кістки навколо зубних імплантів: попереднє гістологічне дослідження на тваринах. Int. J. Oral Maxillofac. Implant. 2012, 27, 1116–1122.
- Нельсон, С.М. Геометричний контроль морфогенезу тканин. Biochim. Biophys. Acta BBA Mol. Cell Res. 2009, 1793, 903–910. [CrossRef] [PubMed]
- Лопес-Лопес, П.Й.; Марек-Буено, Дж.; Бокете-Кастро, А.; Агілар-Сальват'єра Рая, А.; Мартінес-Гонсалес, Дж.М.; Кальво-Гуїрадо, Дж.Л. Впливи абатментів для загоєння різного розміру та анатомічної форми, розміщених безпосередньо в екстракційних лунках, на тверді та м'які тканини навколо імплантів. Пілотне дослідження на собаках фоксхаунд. Clin. Oral Implant. Res. 2016, 27, 90–96. [CrossRef]
- Ковані, У.; Джаммарінаро, Е.; Ді П'єтро, Н.; Бонкомпаньї, С.; Растеллі, Г.; Ромаско, Т.; Веласко-Ортеґа, Е.; Хіменес-Герра, А.; Ієцці, Г.; П'яттеллі, А.; та ін. Електронна мікроскопія (ЕМ) аналіз колагенових волокон у періімплантних м'яких тканинах навколо двох різних абатментів. J. Funct. Biomater. 2023, 14, 445. [CrossRef]
- Беллоні, А.; Беллоні, А.; Фурлані, М.; Фурлані, М.; Греко, С.; Греко, С.; Нотарстефано, В.; Нотарстефано, В.; Про, С.; Про, С.; та ін. Лейоміома матки як корисна модель для виявлення морфометричного та макромолекулярного стану колагену та порушень у фіброзних захворюваннях: екс-віво людське дослідження. Biochim. Biophys. Acta BBA Mol. Basis Dis. 2022, 1868, 166494. [CrossRef]
- Карьялайнен, В.-П.; Кестіла, І.; Фінніла, М.; Фолькессон, Е.; Турк'євіч, А.; Оннерфьорд, П.; Х'юз, В.; Тйорнстранд, Дж.; Енглунд, М.; Саараккала, С. Кількісний тривимірний аналіз орієнтації колагену задньої роги людського меніска у здоров'ї та остеоартриті за допомогою мікро-комп'ютерної томографії. Osteoarthr. Cartil. 2021, 29, 762–772. [CrossRef]
- Томасі, Ч.; Тессароло, Ф.; Каола, І.; Веннстром, Дж.; Нолло, Г.; Берґлунд, Т. Морфогенез періімплантної слизової знову розглянуто: експериментальне дослідження на людях. Clin. Oral Implant. Res. 2014, 25, 997–1003. [CrossRef]