Преклінічне рандомізоване контрольоване дослідження двосторонньої дисектомії проти двосторонньої дископексії у овець породи Блек Меріно в скронево-нижньощелепному суглобі: TEMPOJIMS – Фаза 1 - гістологічні, іміджеві та результати ваги тіла
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Вступ: Роль хірургії скронево-нижньощелепного суглоба (СНЩС) не визначена чітко через відсутність якісних рандомізованих контрольованих клінічних випробувань, які порівнюють різні хірургічні методи лікування СНЩС з медичними та плацебо втручаннями. Дослідження міжсуглобового матеріалу СНЩС (TEMPOJIMS) є суворим доклінічним випробуванням, поділеним на 2 фази. У фазі 1 автори досліджували роль диска СНЩС, а в фазі 2 автори оцінили 3 різні міжсуглобові матеріали. Наступна робота TEMPOJIMS е фаза 1 має на меті оцінити гістопатологічні та іміджеві зміни після двосторонньої дисектомії та дископексії у СНЩС чорних меріно, використовуючи високоякісне випробування відповідно до рекомендацій ARRIVE.
Матеріали та методи: Це рандомізоване, сліпе та контрольоване доклінічне випробування було проведено на 9 чорних меріно, щоб дослідити гістопатологічні (первинний результат), іміджеві та зміни ваги тіла (вторинні результати) після двосторонньої дисектомії, дископексії та імітаційної хірургії.
Результати: В групі дисцектомії були помічені значні зміни, як в образній, так і в гістопатологічній аналізах. Зміни ваги тіла були найбільш вираженими в групі дисцектомії в перші 4 місяці після операції з відновленням до базової ваги через 6 місяців після операції. Дископексія викликала несуттєві зміни в гістопатологічних, образних та аналізах ваги тіла.
Висновки: Це дослідження підкреслює важливість розробки ефективного міжвставного матеріалу для заміни диска ТМЖ та необхідність дослідження молекулярних механізмів, що лежать в основі дегенерації хряща ТМЖ. Запропонований дизайн дослідження в TEMPOJIMS представляє собою важливий прогрес у напрямку майбутніх ретельних досліджень ТМЖ.
Вступ
У випадках важких дисфункцій скронево-нижньощелепного суглоба (ДНЩС) стандартне лікування в основному є хірургічним (Димітруліс, 2013). Однак роль хірургії ТМЖ не визначена чітко (Димітруліс, 2005) через відсутність якісних рандомізованих контрольованих клінічних випробувань, що порівнюють хірургічне лікування ТМЖ з медичним лікуванням та плацебо (Рестон і Туркельсон, 2003; Соузи та ін., 2012). Відкриті хірургічні підходи до ТМЖ для важких розладів в основному включають дисцектомію або дископексію. У випадках, коли нічого в суглобі не підлягає відновленню, може знадобитися повна заміна суглоба (Димітруліс, 2013). Незважаючи на велику кількість процедур дисцектомії, що виконуються щорічно, ми не знаємо про жодні ретельно проведені, рандомізовані контрольовані випробування, які досліджували б ефективність дисцектомії в порівнянні з дископексією, біоінженерним міжвставним матеріалом і імітаційними хірургічними втручаннями. Попередні дослідження вказували на значне збільшення остеоартрозу ТМЖ (ОА) після дисцектомії з і без заміни диска на міжвставний імплант (93% і 100% відповідно). Ці автори представили зменшену частоту ОА (62%) при використанні дископексії. Проте ця техніка була пов'язана з частими рецидивами, що вимагали вторинної дисцектомії (Трамп і Ліберг, 1995). Ці результати чітко демонструють важливість подальших досліджень для глибшого розуміння ефектів хірургії та прогресу для майбутнього розвитку міжвставних матеріалів.
Більшість клінічних випробувань використовують зображення для класифікації дегенеративного процесу в скронево-нижньощелепному суглобі (Ерікссон і Вестессон, 2001). Комп'ютерна томографія (КТ) є цінним інструментом для оцінки остеоартриту скронево-нижньощелепного суглоба (Кордейро та ін., 2016) і використовується більшістю клінічних досліджень для оцінки суглобових змін (Боман, 1947; Ерікссон і Вестессон, 1985; Холл, 1985; Кіхн і Деспрез, 1962; Сілвер, 1984; Такаку та ін., 1994; Тольванен та ін., 1988). Два важливих клінічних дослідження з тривалим спостереженням продемонстрували сплющення та склероз кондилю після дисектомії, але це не було пов'язано з симптомами скронево-нижньощелепного суглоба (Ерікссон і Вестессон, 1985; Холл, 1985; Сілвер, 1984; Тольванен та ін., 1988). Навпаки, група Деспрез (1962) запропонувала асоціацію ерозії суглоба з болем у післяопераційний період (Кіхн і Деспрез, 1962). Хоча методи зображення є ключовими показниками в клінічних дослідженнях, доклінічні дослідження надають унікальну можливість також отримати гістологічну патологію для кращого розуміння змін, викликаних хірургією скронево-нижньощелепного суглоба, і покращити знання для дослідження матеріалів для імплантації. Попередні доклінічні дослідження оцінювали гістологічні та зображувальні результати, використовуючи дизайни досліджень з потенційними джерелами упередженості (упередженість вибору, упередженість вимірювання, нерандомізація, неосліплене оцінювання результатів), що збільшує ризик помилок у результатах дослідження та подальших висновках (Блок і Був'є, 1990; Чукас та ін., 1969; Хагандора і Альморза, 2012; Лорелл та ін., 1987; Мачер та ін., 1992; Огі та ін., 1996).
Дослідження матеріалів для міжсуглобових вставок в скронево-нижньощелепному суглобі (TEM-POJIMS) було сплановано з суворим попередньо опублікованим дизайном (Ângelo та ін., 2017) відповідно до рекомендацій ARRIVE (Kilkenny та ін., 2010). Це перше високоякісне рандомізоване доклінічне дослідження, проведене на чорних меріно, було необхідним для підвищення трансляційної сили подальших досліджень та для прогресу в майбутніх варіантах лікування пацієнтів, які проходять операцію з заміни диска ТМЖ. TEMPOJIMS поділяється на фази 1 та 2. Фаза 1 була рандомізованим, сліпим доклінічним випробуванням, спроектованим для дослідження зображення ТМЖ (КТ), гістопатологічних змін та змін маси тіла овець після двосторонньої дисектомії, дископексії або імітаційної операції. Фаза 2 використовує той же дизайн для тестування різних біоінженерних каркасів для заміни диска ТМЖ у овець. Критично важливо, щоб всі оцінки виконувалися та класифікувалися незалежно двома фахівцями з кожної області, які не знають про втручання. У обох фазах основним результатом було гістологічне оцінювання патології ТМЖ. Головною метою даного дослідження було вивчення впливу двосторонньої хірургії на результати фази 1.
Матеріали та методи
Дизайн дослідження
Обґрунтування та протокол передклінічного випробування TEMPOJIMS є загальнодоступними (Ângelo et al., 2017). Незалежна рада з моніторингу даних та безпеки розкрила результати передклінічного дослідження. Дослідження було затверджено Португальською національною службою охорони здоров'я тварин під номером 026618. Дизайн та організація дослідження відповідали рекомендаціям ARRIVE (Kilkenny et al., 2010).
Популяція дослідження та зразок
Відповідні доклінічні дослідження ТМЖ були проведені на вівцях (Ishimaru і Goss, 1992; Matsuura et al., 2006; Miyamoto et al., 1999; Ogi et al., 1996; Takaishi et al., 2007), і для зменшення біологічної варіабельності в результатах TEMPOJIMS була використана специфічна чистопородна порода чорних меріносових овець (Ângelo DF et., 2017). У 2016 році наша група провела анатомічне, біомеханічне та гістологічне дослідження ТМЖ чорних меріносових овець, підкреслюючи потенціал цієї тварини для проведення доклінічних випробувань у сфері ТМЖ (Angelo et al., 2016). Використовувалися такі критерії відповідності: сертифіковані чорні меріносові вівці, дорослі (віком від 2 до 5 років), самки та в доброму стані здоров'я (оцінка проводилася ветеринарами, які також підтверджували нормальну зубну формулу).
Рандомізація
Процес рандомізації був виконаний статистичною групою, яка не брала участі в оцінці результатів. Десять овець були випадковим чином розподілені на групу втручання: двостороння імітаційна операція (n = 3), двостороння дисектомія (n = 3), двостороння дископексія (n = 3) та резервна група (n = 1). Одна резервна вівця була запланована для використання у разі смерті через анестезію або іншу ускладнення, не пов'язане з хірургічним втручанням. Розподіл до кожної рандомізованої групи був виконаний передопераційно за допомогою запечатаного конверта.
Процедури
Десять придатних овець були обрані, і базова вага тіла була виміряна на 11, 10 та 9 дні до операції. Транспортування до хірургічних приміщень було виконано за 5 днів до операції, щоб уникнути стресу у тварин і дозволити їм звикнути до тимчасового проживання. Комп'ютерна томографія голови була проведена в день операції з використанням переданестезійного седативного засобу (додатковий матеріал документ 1). Хірургічна команда не була сліпою до розподілу лікування, враховуючи тип втручання; однак члени хірургічної команди не брали участі в оцінці результатів. Серйозні небажані події визначалися як події, які були фатальними або загрожували життю, або призводили до стійкої інвалідності, або які призвели до смерті, втрати більше 10% ваги на тиждень, або клінічно значущої небезпеки чи шкоди для тварини.
Інтервенційна фаза
Протокол анестезії
Голод і обмеження води були необхідні за 24 години до операції. Седація проводилася з використанням діазепаму (0,5 мг/кг в/в), після чого проводилася індукція анестезії з використанням кетаміну (5 мг/кг в/в). Було виконано оральну інтубацію, а анестезію підтримували ізофлураном (1,5-2%). Для забезпечення аналгезії тварини мелоксикам (0,5 мг/кг в/в, двічі на день) вводили в день операції до 4 днів післяопераційного періоду. Антибіотикопрофілактика з амоксициліном та клавулановою кислотою (50 мг/кг в/в двічі на день) використовувалася протягом 5 днів після операцій.
Хірургічна інтервенція
У всіх тварин хірургічний ділянка була поголена, шкіра підготовлена розчином повідон-йоду та ізольована стерильними покривами відповідно до стандартних хірургічних процедур. За допомогою скальпеля №15 було виконано 6 см довгий передвушний шкірний розріз, після чого проводилася тупа дисекція м'яких тканин, що покривають суглоб, для оголення суглобової капсули. Використовувалися тканинні ретрактори для підтримки оголення хірургічного поля. У групі контрольних тварин (n = 3) суглобова капсула не була розрізана, а рана була зашита в 3 шари (м'язовий, підшкірний та шкіра) з використанням Vicryl 3/0. У решти тварин суглобова капсула була розрізана, і диск та його прикріплення були ідентифіковані. У групі дисектомії (n = 3) диск був оголений, і за допомогою ножиць для райських птахів були розсічені бічні, передні та задні прикріплення, що дозволило оголити та перетнути медіальне прикріплення і видалити неушкоджений диск. У групі дископексії (n = 3) бічні та задні прикріплення диска були різко відокремлені за допомогою ножиць для райських птахів. Було видалено трикутний сегмент ретродискової тканини розміром 4 мм, а потім зашито з використанням PDS 3/0. Рана, включаючи суглобову капсулу, була зашита в 4 шари (суглобова капсула, м'язовий, підшкірний та шкіра) з використанням Vicryl 3/0.
Подальші оцінки
Десять днів після операції тварини були перевезені до лабораторій TEMPOJIMS (Ângelo et al., 2017). З 19го по 21ше день після операції були зафіксовані вторинні результати спостережень, які повторювалися кожні 30 днів протягом 6 місяців (T1 до T6 відповідно). Дані з T0-T6 були розраховані на основі середніх значень триденного вимірювання кожного місяця. Шість місяців після втручання, відразу після евтаназії, всі тварини пройшли друге КТ-сканування, а блок TMJ був видалений для гістології.
Результати
Гістологічний аналіз: Цілісний TMJ був видалений за допомогою некропсійної кісткової осциляційної пилки відповідно до наступних анатомічних орієнтирів: краніальний е краніальний аспект короноідного відростка в зоні з'єднання з зигом; каудальний е зовні акустичного проходу; доральний е сквамозної скроневої кістки; та вентральний - 2 см нижче акустичного проходу в зоні кута стилогіоїдного. Суглоби фіксувалися в 10% буферному формаліні протягом 24 годин і зберігалися в 70% етанолі. Демінералізація досягалася шляхом занурення в 10% мурашиної кислоти в 5% формаліні протягом 20 днів з зміною розчину кожні 2 дні, після чого артикуляції були розрізані сагітально через весь кондил. Артикуляції TMJ потім занурювалися в три градуйовані суміші метилсаліцилату/парафіну, вморожувалися в парафін і розрізали до центральної частини TMJ. Чотири мікронні зрізи були закріплені на скляних слайдах, нагрівалися протягом 1 години при 65ºC, де-віскувалися трьома циклами по 5 хвилин з ксиленом і фарбувалися толуїдиновим синім і швидким зеленим, як було описано раніше (Little et al., 2010). Слайди, ідентифіковані номерним кодом, були рандомізовані та відправлені до лабораторій Реймонд Пурвес для оцінки двома сліпими незалежними оцінювачами, які мають досвід у оцінці гістопатології суглобів овець (CBL, MMS).
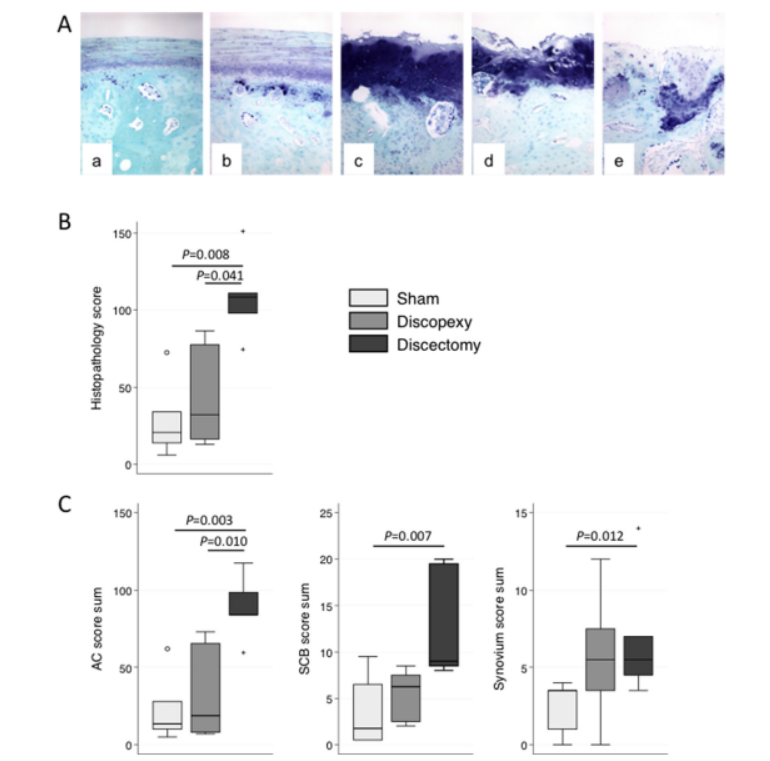
Оскільки нормальна гістоморфологія скронево-нижньощелепного суглоба (СНЩС) суттєво відрізняється від хряща в апендикулярних синовіальних суглобах (Murphy et al., 2013) (Рис. 1Aa), було використано модифікацію опублікованої системи оцінювання, специфічної для СНЩС (Li et al., 2014) (додатковий матеріал doc2). Коротко, хрящ нижньої щелепи та скроневий хрящ (структура, кількість клітин, форма та клонування, а також вміст і розподіл протеогліканів), межа, цементна лінія та субхондральна кістка (структура, кількість остеоцитів, активація остеобластів, судинне вторгнення та кальцифіковані хрящові острови) оцінювалися окремо від 0 (нормально) до 3 (>70% аномально). Крім того, гіперплазія синовіальної оболонки скроневої та ретродискової області, фіброз та інфільтрація запальних клітин також оцінювалися від 0 до 3. Загальні оцінки гістопатології хряща (максимальна можлива оцінка 60 в кожному кондилі), субхондральної кістки (максимальна можлива оцінка 15 в кожному кондилі), синовіальної (максимальна можлива оцінка 9 в кожному місці) та загальна (максимальна можлива оцінка 168) були розраховані.
Аналіз зображень: Оцінка зображень була проведена та класифікована незалежно 2 досвідченими радіологами (RS, LN), які не знали про втручання, за наведеними критеріями (додатковий матеріал док 3).
Оцінка маси тіла: Овець зважували відразу після споживання 150 грамів сухих гранул. Оцінки маси тіла проводили 2 підготовлені оцінювачі, які не були пов'язані з втручанням.
Статистичний аналіз
Статистичні аналізи проводилися за допомогою або Статистичного пакету для соціальних наук (IBM SPSS, версія 22.0), або Статистики/аналізу даних (STATA-corporation версія 14.2). Гістопатологічні бали для кожного параметра в кожному розділі 2 оцінювачів були середніми, і після розкриття сліпого методу були розраховані медіанні бали (та суми балів) для кожної групи лікування. Відмінності між лікуваннями аналізувалися за допомогою змішаної порядкової логістичної регресії.
Було проведено односторонній аналіз дисперсії (ANOVA) для крос-секційного аналізу, щоб порівняти результати змінних на трьох рівнях незалежної змінної до та після випадкового призначення групи лікування. Для довгострокового аналізу було проведено односторонній ANOVA з повторними вимірюваннями, враховуючи як внутрішньо-суб'єктні ефекти спостереження після хірургічного втручання (T1-T6) для всіх умов. Первинний аналіз перевіряв ефекти хірургічного втручання, використовуючи серії попередніх та післятестових вимірювань. Маса тіла та бал зображення використовувалися як залежні змінні для дегенеративного процесу. Маса тіла вимірювалася 3 рази в попередньому тесті для підтримки інваріантності щодо результатів вимірювань до клінічного втручання. Вторинний аналіз (післятест) оцінював результати, вимірюючи 3 рази, в 6 часових точках, по одному разу на місяць у тому ж місці, на тій же даті та в той же час, що й у попередньому тесті (Ângelo et al., 2017). Для аналізу результатів зображення були проведені непараметричні тести, враховуючи розмір вибірки та ненормальність розподілу для більшості змінних у кожній групі, тест Шапіро-Уілка ≤ .82, p ≤ .091. Тести Крускала-Уолліса були проведені для порівняння груп, з тестом Бонферроні для пост-хок множинних порівнянь. Частковий ета-квадрат (η2p) та d Коена використовувалися для розрахунків розміру ефекту. Категорії Коена використовувалися для оцінки величини цих розмірів ефекту (малий, якщо 0 ≤ |d|≤ 0.5, середній, якщо 0.5 < |d|≤ 0.8, і великий, якщо |d| > 0.8).
Результати
На початковому етапі не було виявлено жодних відмінностей між групами за масою тіла (група контрольних операцій: 55.1 ± 2.7 кг, група дископексії: 62.3 ± 6.0 кг, група дисектомії: 67.3 ± 10.2, p > .10).
Гістологічні результати
Морфологічний вигляд хряща та кістки в суглобах, що піддавалися контрольній операції, відповідав тому, що раніше описували як нормальний ТМЖ (Murphy et al., 2013; Li et al., 2015) (Рис. 1Aa). Поверхнева половина глибини хряща мала чіткий ламінарний вигляд, з рідкісними сплюснутими клітинами та обмеженим забарвленням протеогліканів, яке ставало більш інтенсивним з глибиною. Під цим шаром була область, щільно населена клітинами з мезенхімальним виглядом, і більш інтенсивне дифузне забарвлення матричних протеогліканів. Найглибший шар хряща містив зрілі та/або гіпертрофічні хондроцити, часто оточені протеоглікановою багатою перицелюлярною матрицею, але з малою або жодною міжтериторіальною протеоглікановою матрицею. У деяких зрізах можна було спостерігати межу, що відокремлює верхні два шари від найглибших шарів хряща, що свідчить про те, що нижня зона була кальцифікована. Нечітка цементна лінія відмежовувала субхондральну кістку, яка містила рівномірно розподілені остеоцити в лакунах, і повністю відокремлювала хрящ від рідкісних кісткових простору, вистелених остеобластами в глибшій кістці. Синовія в ТМЖ, що піддавався контрольній операції, була схожа на ту, що в колінному суглобі овець (Smith et al., 2008) з одним шаром синовіоцитів, що покриває пухку сполучну тканину з адипоцитами та рідкісними фібробластами і колагеном.
У дископексії та дисектомії в суглобах було відзначено різноманітні патологічні зміни різного ступеня тяжкості (Рис. 1Abee). Найлегші зміни включали потовщення хряща, незначне збільшення матриці та перицелюлярного забарвлення протеогліканів, підвищену щільність клітин, активацію судин та інвазію субхондральної кістки і кальцинованого шару хряща, при цьому як межа забарвлення, так і цементна лінія були більш виразними (Рис. 1Ab). Проміжна патологія хряща характеризувалася шорсткістю/фібриляцією поверхні, втратою типової ламінарної структури, помітним збільшенням забарвлення протеогліканів між територіями у всіх шарах, клонуванням клітин, особливо в верхніх зонах, та подальшою інвазією судин у глибокі зони (Рис. 1Ac). Подальше прогресування патології було очевидним з ерозією та втратою хряща поверхневих зон, зменшенням щільності клітин у середній зоні, але клонуванням у всіх шарах, інвазією судин у середню зону (Рис. 1Ad), і, зрештою, повною втратою цілісності хряща та помітним ремоделюванням субхондральної кістки (Рис. 1Ae). Поряд з остеохондральними змінами спостерігалася синовіт з гіперплазією поверхневих клітин, підсиновіальною фіброзною тканиною з втратою адипоцитів та як периваскулярною, так і дифузною інфільтрацією запальних клітин (не показано). Сліпий оцінювання показало значне збільшення загального медіанного гістопатологічного балу в дисектомії в порівнянні з іншими групами (Рис. 1B). Це було зумовлено значним збільшенням патології в хрящі, кістці та синовії в дисектомії в порівнянні з суглобами, які піддавалися шемоперації (Рис. 1C). Сустави дископексії продемонстрували деякі ознаки патології хряща та синовії, але це було досить варіабельно і не досягло статистичної значущості.
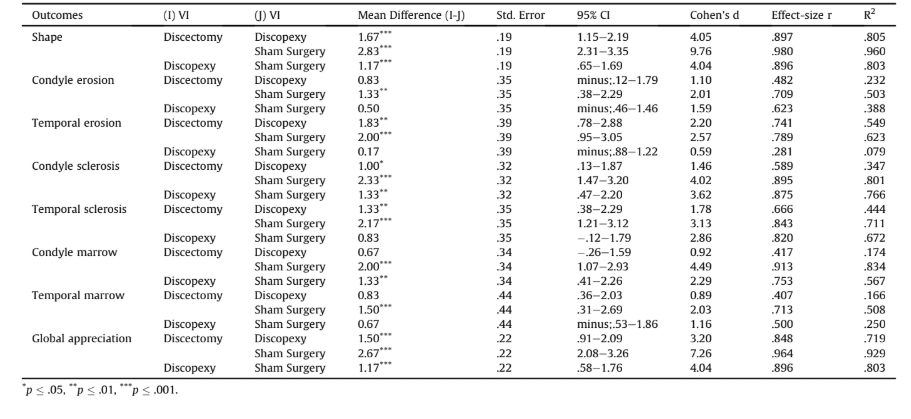
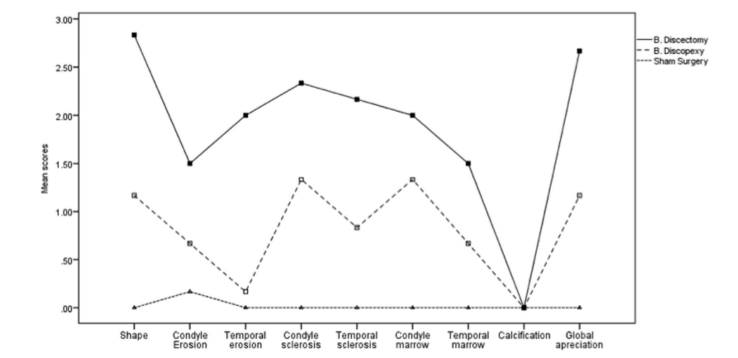
Результати зображення
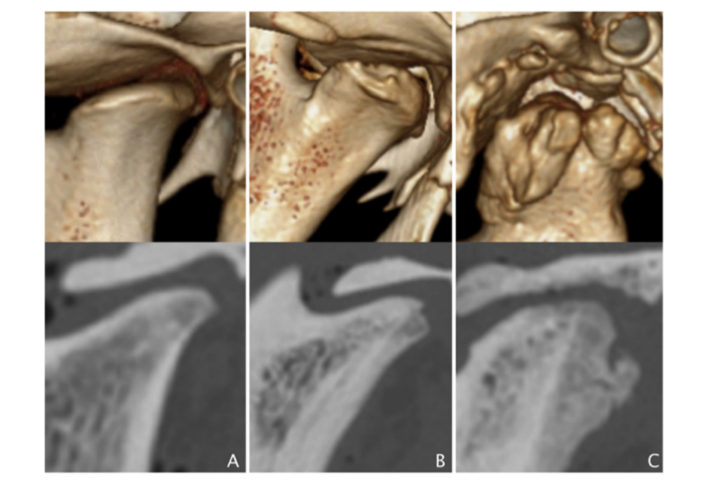
Автори порівняли результати всіх умов хірургії (Таблиця 1). Загалом, різниці були дуже значними (η2p, що відповідає 90.8%, статистична потужність > .999) для всіх результатів, за винятком кальцифікації. Розглядаючи кожен результат, різниці були вищими для форми, за якою йшли склероз кондилю, склероз скроневої кістки, кістковий мозок кондилю, ерозія скроневої кістки, ерозія кондилю та кістковий мозок скроневої кістки. Розмір ефекту різниць коливався від 43.4% до 90.8%. Рис. 2 є репрезентативним КТ-зображенням групи імітаційної хірургії (Рис. 2A), групи дископексії (Рис. 2B) та дисектомії (Рис. 2C).
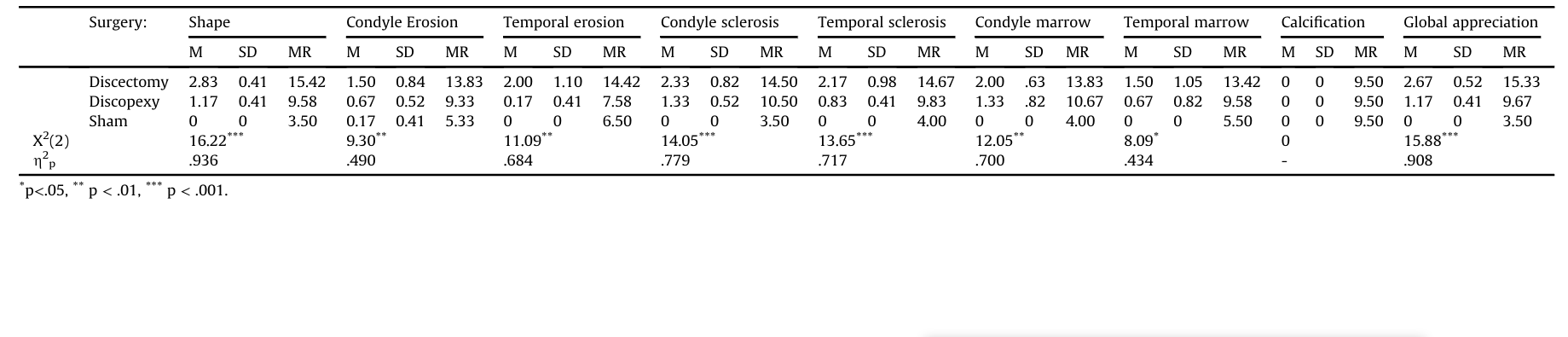
Виключаючи різницю між дископексією та плацебо-хірургією для тимчасової ерозії (d = 0.59), всі інші різниці були класифіковані як великі (d > 0.80). Найбільші різниці спостерігалися між дисектомією та плацебо-хірургією (R2, що відповідає 92.9% дегенерації в глобальному оцінюванні), головним чином через форму (R2 = 96.0%), кістковий мозок кондилю (R2 = 83.4%) та склероз кондилю (R2 = 80.1%). Ерозія кондилю та тимчасовий мозок були найменш уражені, незважаючи на розмір ефекту R2 50.3% та 50.8% відповідно. Тимчасовий склероз та тимчасова ерозія показали розміри ефекту R2 71.1% та 62.3% відповідно. Дископексія також відрізнялася від плацебо-хірургії (R2, що відповідає 80.3% погіршення в глобальному оцінюванні), хоча з нижчими розмірами ефекту в порівнянні з різницями між дисектомією та плацебо-хірургією, і лише для форми (R2 = 80.3%), склерозу кондилю (R2 = 76.6%) та кісткового мозку кондилю (R2 = 56.7%) (Таблиця 2 та Рис. 3).
Результати маси тіла
Перехресний аналіз.
Статистичних відмінностей у масі тіла не було виявлено в передтесті (T0) та в усіх часах після тесту (p > .10, Таблиця 3).
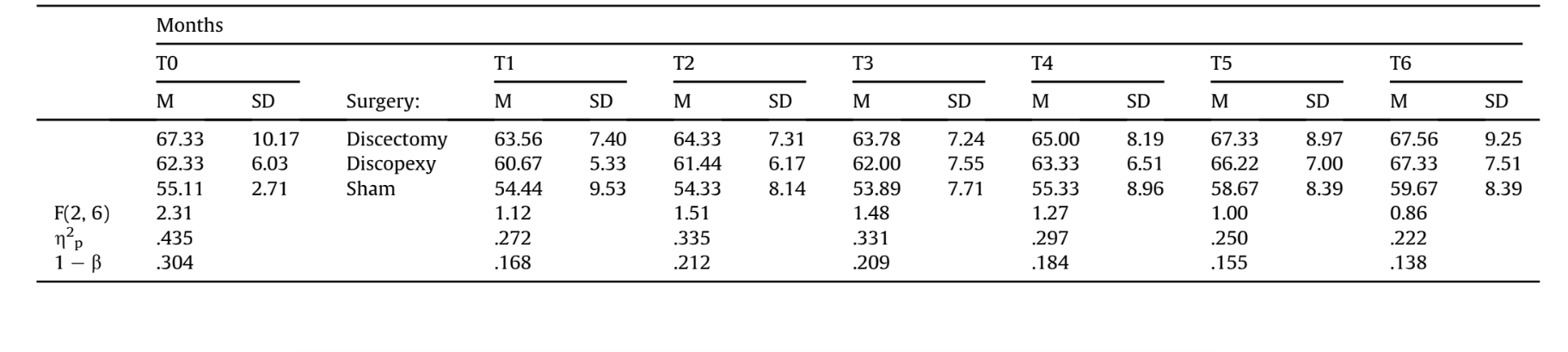
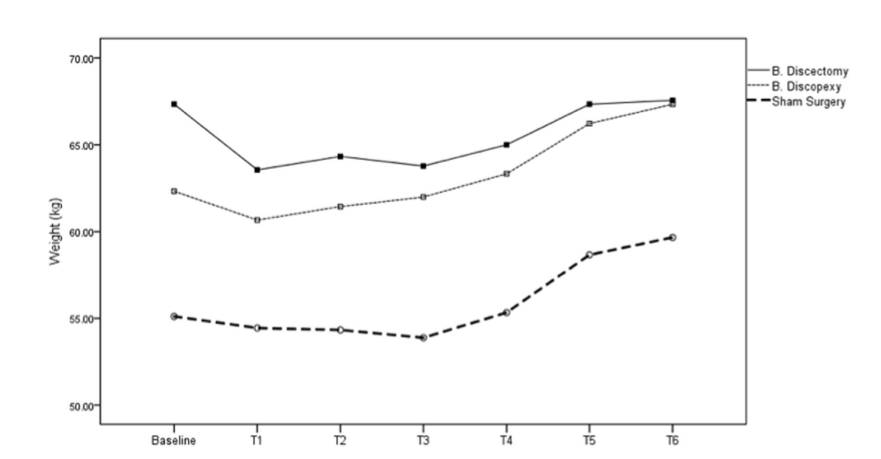
На Рис. 4 видно, що в умовах дисектомії вівці втратили вагу з 1-го по 4-й місяць і відновили свою вагу протягом 5-го і 6-го місяців після операції.
Лонгітюдний аналіз.
Було проведено односторонній дисперсійний аналіз з повторними вимірюваннями, враховуючи як внутрішньогрупові ефекти місяці після операції (T1-T6) для дисектомії, дископексії та імітаційної операції. Було виявлено статистично значущі відмінності, F(5, 10) = 9.69, 27.35 та 8.07, p < .01, η2p = .829, .932 та .801, (1 – β) = .992, 1.00 та .977 для дисектомії, дископексії та імітаційної операції відповідно, що показує, що вівці відновили вагу з T1 до T6. Тести внутрішньогрупових контрастів виявили, що збільшення відбулося з T4 до T5 як у дисектомії (p = .04), дископексії (p = .01), так і в імітаційній операції (p = .01). Незважаючи на це збільшення, лише ті, хто був у групах дископексії та імітаційної операції, збільшили свою вагу порівняно з попереднім тестом у T5 та T6, t(2) = —5.34 та —5.00, p < .04. У умовах дисектомії та імітаційної операції вівці не перевищили свою вагу на початковому рівні.
Обговорення
Це перше преклінічне дослідження темпоромандибулярного суглоба, яке використовує рандомізований, сліпий дизайн відповідно до рекомендацій ARRIVE. Використовуючи підходящих овець чорної меріно з вибором віку та статі, групу контролю з імітацією та двосторонній підхід, автори прагнули зменшити можливі упередження в результатах. У людей хрящ ТМС відрізняється від апендикулярних синовіальних суглобів (Murphy et al., 2013), з чітко ламінарним фіброзним хрящем з рідкісними протеогліканами, що нагадує меніск та annulus fibrosus міжхребцевого диска (Melrose et al., 2017; Shu et al., 2017). У суглобах, на яких проводили імітацію, у овець чорної меріно хрящ ТМС гістологічно дуже схожий на людський, що підтверджує овець як хорошу модель тварини. Щур (Zhang et al., 2016) та коза (Li et al, 2015) також мають типовий вигляд фіброзного хряща ТМС з чітко організованими шарами, тоді як у миші (Cohen et al., 2014; Xu et al., 2009) та кролика (Wu et al., 2015) ламінарна структура менш помітна.
Гістопатологічні зміни, отримані в щелепно-ліцевому суглобі овець після двосторонньої дисцектомії, були узгоджені з іншими дослідженнями, проведеними на різних видах, включаючи мишей (Cohen et al., 2014), щурів (Zhanget al., 2016), кроликів (Embree et al., 2015) та кіз (Li et al., 2015). Автори зауважили збільшення протеогліканів та округлих клітин, а також потовщення хряща після дисцектомії. Ці зміни у чорних меріно овець подібні до звітів про інші тварини (наприклад, миша (Cohen et al., 2014; Matías et al., 2016; Xu et al., 2009) та щур (Zhang et al., 2016)). Вони узгоджуються з хондроїдною метаплазією, яка потенційно пов'язана з втратою диска та збільшеним прямим навантаженням на хрящ щелепно-ліцевого суглоба. Однак, коли ця перша захисна фаза не справляється під час тривалого аномального навантаження, суглоб зазнає дегенерації з загибеллю клітин і клонуванням, ерозією поверхні, змінами субхондральної кістки та дегенерацією. Ця остання фаза добре описана і подібна до тієї, що спостерігається в колінному суглобі овець після меніскектомії (Cake et al., 2013; Little et al., 2010). У групі втручання дископексії капсула щелепно-ліцевого суглоба та внутрішньосуглобове середовище були збережені. Результат, як і очікувалося, мав менш виражені гістопатологічні зміни, оскільки диск залишався між кістковими поверхнями, розподіляючи навантаження та захищаючи хрящ щелепно-ліцевого суглоба. Варто зазначити, що ми також виявили більш виражений синовіт у випадку дисцектомії в порівнянні з дископексією, що вказує на те, що запалення є не лише реакцією на артротомію, але й частиною процесу остеоартриту в суглобі. Гістопатологічний вигляд синовіту в щелепно-ліцевому суглобі був таким же, як у колінних суглобах овець з остеоартритом (Smith et al., 2008). Проте, враховуючи основні анатомічні відмінності в хрящі, майбутні дослідження повинні вивчити молекулярні механізми, які лежать в основі патології остеоартриту щелепно-ліцевого суглоба, щоб визначити їх подібності та відмінності з апендикулярними суглобами, такими як коліно (Young et al., 2005). Такі дослідження можуть призвести до прогресу в визначенні патофізіології та управлінні дегенеративними розладами щелепно-ліцевого суглоба.
Радіографічні морфологічні зміни, спричинені дисцектомією, вперше були описані Боманом у 1947 році, який зазначив “плоскість суглобової поверхні” (Боман, 1947). У 1985 році подібні висновки були отримані щодо сплющення кондилів і склерозу після односторонньої дисцектомії, де не було описано остеофітів, але були виявлені серйозні ушкодження (Ерікссон і Вестессон, 1985). Одночасно, сплющення кондилів і склероз були найпоширенішими радіографічними знахідками в дослідженні через 33,8 років після дисцектомії (Толванен та ін., 1988). У даному дослідженні ці результати підтверджуються серйозними морфологічними змінами, які спостерігалися після двосторонньої дисцектомії. Більшість статистичних відмінностей були відзначені у формі та склерозі кондилів, що відповідає клінічним знахідкам інших авторів (Ерікссон і Вестессон, 1985; Такаку та ін., 2000). У той час як людський кондиль є опуклим і має тенденцію до сплющення після дисцектомії, овечий кондиль зазвичай плоский і має тенденцію до більш опуклої форми після дисцектомії (Рис. 2C). Тим не менш, склероз кондилів у всіх суглобах після двосторонньої дисцектомії (R2 = 80.1%) та зміни в підлягаючій трабекулярній кістці (костний мозок кондилів) також були виявлені. Коралова руйнація, що характеризується початковою руйнівною фазою, була описана Агербергом і Лундбергом у перші 6 місяців після дисцектомії (Агерберг і Лундберг, 1971). Деякі автори припускають, що ці зміни можуть виникнути, якщо навантаження не контролюється протягом цих 6 місяців (Холл, 1985). Інші автори підняли питання про те, чи викликаний лізис кондилів дисцектомією чи перевантаженням, оскільки контралатеральний неоперативний суглоб має подібні морфологічні зміни (Агерберг і Лундберг, 1971; Ерікссон і Вестессон, 1985; Такаку і Тойода, 1994; Уілкс, 1991). Яйлен, у 1979 році описав кісткову анкілозу між кондилем і скроневою кісткою через рік після односторонньої дисцектомії у Macaca fascicularis (Яйлен та ін., 1979). Пізніше, Бйорнланд виявив фіброзну анкілозу через 6 місяців після односторонньої дисцектомії (Бйорнланд і Ларгейм, 2003). У TEMPOJIMS, через 6 місяців після двосторонньої дисцектомії не було виявлено внутрішньосуглобової кальцифікації, і хоча фіброзна анкілоза не може бути виключена за допомогою КТ, це не було очевидно гістологічно. Також повідомляється про значне утворення остеофітів, яке рідко описувалося в попередніх дослідженнях, що може бути пов'язано з обмеженнями візуалізації радіографії та артрографії в порівнянні з КТ.
Наскільки нам відомо, немає клінічних або доклінічних досліджень, що оцінюють зображення після дископексії. Результати показали, що відкрита хірургія СНЩС не є безпечною, призводячи до незначних або помірних змін у глобальному ремоделюванні. Кондила більше піддається впливу, ніж скронева кістка, і лише за формою (R2 = 80.3%), склерозом кондили (R2 = 76.6%) та кістковим мозком кондили (R2 = 56.7%).
У інших захворюваннях, таких як ревматоїдний артрит (England et al., 2017), рак (Lynch et al., 2017), ВІЛ (Malvy et al., 2001) та хірургічні втручання, такі як гастричний рукав (Casillas et al., 2017), маса тіла використовувалася як цінний показник для оцінки прогресу захворювання та успішності втручання. Однак для розладів СНЩС цей показник рідко використовувався. Було зафіксовано зниження маси тіла на 4% у 60% тварин через 3 місяці після односторонньої дисектомії з видаленням кондили та скроневих поверхонь (Miyamoto et al.,1999). У дослідженні на мишах після часткової дисектомії не спостерігалося значних втрат або приростів у масі тіла експериментальних або контрольних мишей (Xu et al., 2009). У цьому дослідженні після двосторонньої дисектомії було зафіксовано втрату маси тіла на 5.2% (все сталося в перший місяць), але з повним відновленням через 6 місяців спостереження. На відміну від цього, вівці, яким проводили дископексію та плацебо-хірургію, збільшили масу тіла (в основному в T4-T6), закінчивши дослідження на 8% та 8.2% вище базового рівня відповідно. Це узгоджується з обмеженою патологією СНЩС. Оцінка маси тіла також була заходом контролю добробуту, пов'язаним зі здоров'ям і хорошим харчуванням, відповідно до принципу 3 Rs (заміна, зменшення або вдосконалення) (Richmond, 2002).
Висновок
Цей пілотний дизайн дослідження демонструє, що проведення хірургічних передклінічних випробувань на щелепно-лицевому суглобі (ЩЛС) у чорних меріно може бути здійснено. У цьому дослідженні автори спостерігали: (1) двостороння дископексія у здоровому ЩЛС не є безневинним втручанням, що призводить до змін у хрящі та синовіальній патології разом зі змінами візуалізації; (2) двостороння дисектомія викликала серйозні зміни в ЩЛС, які були виявлені як за допомогою візуалізації, так і гістопатологічного аналізу; (3) за 6-місячний період після двосторонньої дисектомії та дископексії не було виявлено фіброзного або кісткового анкілозу. І (4) крім очікуваних змін у хрящі та кістці, синовіт був показаний як частина процесу остеоартриту, що забезпечує новий показник результату та терапевтичну ціль.
Це дослідження підкреслило, що: (1) хрящ ЩЛС відрізняється від синовіальних суглобів кінцівок, і тому може вимагати унікальних терапевтичних підходів; (2) необхідні подальші дослідження для вивчення ефективного матеріалу для вставки, щоб замінити диск ЩЛС, і (3) необхідні подальші дослідження для вивчення молекулярних механізмів, які лежать в основі дегенерації хряща ЩЛС.
Автори: Девід Фаустіно Анджело, Педро Моруко, Флоренсіо Монхе Гіл, Лізете Моніко, Рауль Гонсалес-Гарсія, Ріта Соуза, Лія Нето, Інес Кальдейра, Маргарет Сміт, Сюзан Сміт, Девід Санз, Фабіо Абаде душ Сантос, Маріо Піньйо, Бельміра Карапічо, Сандра Кавако, Карла Мора, Нуну Алвеш, Франциско Сальвадо, Крістофер Літтл
Посилання:
- Агерберг Г, Лундберг М: Зміни в скронево-нижньощелепному суглобі після хірургічного лікування. Радіологічне спостереження. Oral Surg Oral Med Oral Pathol 32(6): 865e875, 1971
- Анджело ДФ, Моруко П, Алвеш Н, Віана Т, Сантос Ф, Гонсалес Р та ін.: Вибір овець (Ovis aries) як модель для дослідження скронево-нижньощелепного суглоба: морфологічна, гістологічна та біомеханічна характеристика суглобового диска. Morphologie 100(331): 223e233, 2016
- Анджело ДФ, Гіл ФМ, Гонсалес-Гарсія Р, Моніко Л, Соуза Р, Нето Л та ін.: Вплив двосторонньої дисектомії та двосторонньої дископексії на кінематику жування чорних меріно: TEMPOJIMS - фаза 1-пілотне сліпе, рандомізоване доклінічне дослідження. J Craniomaxillofac Surg, 2017a S1010e5182(17)30415-8
- Анджело ДФ, Монье ФГ, Гонсалес-Гарсія Р, Літтл КБ, Моніко Л, Піньйо М та ін.: Біоінженерні імплантати диска скронево-нижньощелепного суглоба: протокол дослідження для двофазного експлораційного рандомізованого доклінічного пілотного випробування на 18 чорних меріно (TEMPOJIMS). JMIR Res Protoc 6(3): e37, 2017b
- Бйорнланд Т, Ларгейм ТА: Дисектомія скронево-нижньощелепного суглоба: 3-річне спостереження як предиктор 10-річного результату. J Oral Maxillofac Surg 61(1): 55e60, 2003
- Блок МС, Був'є М: Адаптивне ремоделювання скронево-нижньощелепного суглоба кролика після дисектомії та зміни в дієті. J Oral Maxillofac Surg 48(5): 482e486, 1990
- Боман К: Артроз скронево-нижньощелепного суглоба та його лікування шляхом екстирпації диска: клінічне дослідження. Спостереження. Acta Chir Scand 95(192), 1947
- Кейк МА, Рід РА, Корфілд Г та ін.: Порівняння результатів ходи та патології трьох меніскальних процедур для індукції остеоартриту коліна у овець. Osteoarthr Cartil 21(1): 226e236, 2013
- Касільяс РА, Кім Б, Фішер Г, Зелада JL, Ум СС, Колеман КД: Порівняльна ефективність гастректомії рукава та шунту Руа-ен-І для зниження ваги та безпеки у літніх людей. Surg Obes Relat Dis 13(9): 1476e1483, 2017
- Чукас НС, Тото ПД, Шон ДжЕ: Грубі та гістологічні зміни в щелепах мавпи Macaca rhesus після хірургії. Oral Surg Oral Med Oral Pathol 27(6): 795e805, 1969
- Коен ВА, Сервейс ДжМ, Полур І, Лі Y, Сюй Л: Дегенерація суглобового хряща в контралатеральному неоперативному скронево-нижньощелепному суглобі у мишей з односторонньою частковою дисектомією. J Oral Pathol Med 43(2): 162e165, 2014
- Кордейро ПК, Гімараєс JP, де Соуза ВА, Діас ІМ, Сілва ЖН, Девіто КЛ та ін.: Участь скронево-нижньощелепного суглоба у пацієнтів з ревматоїдним артритом: асоціація між клінічними та томографічними даними. Acta Odontol Latinoam 29(3): 123e129, 2016
- Дімітруліс Г: Роль хірургії в лікуванні розладів скронево-нижньощелепного суглоба: критичний огляд літератури. Частина 2. Int J Oral Maxillofac Surg 34(3): 231e237, 2005
- Дімітруліс Г: Нова хірургічна класифікація для розладів скронево-нижньощелепного суглоба. Int J Oral Maxillofac Surg 42: 218e222, 2013
- Ембрі МС, Іваока ГМ, Конг Д, Мартін БН, Патель РК, Лі АГ та ін.: Оссифікація м'яких тканин та дегенерація хряща головки після перфорації диска ТМЖ у пілотному дослідженні на кроликах. Osteoarthr Cartil 23(4): 629e639, 2015
- Англія БР, Бейкер ДжФ, Сейлз Г, Мішо К, Каплан Л, Девіс ЛА: Індекс маси тіла, втрата ваги та причина специфічної смертності при ревматоїдному артриті. Arthritis Care Res, 20 квітня. 2017
- Ерікссон Л, Вестессон ПЛ: Довгострокова оцінка меніскектомії скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 43(4): 263e269, 1985
- Ерікссон Л, Вестессон П-Л: Дисектомія як ефективне лікування болісного внутрішнього порушення скронево-нижньощелепного суглоба: 5-річне клінічне та радіографічне спостереження. J Oral Maxillofac Surg 59(7): 750e758, 2001
- Хагандора КК, Альмарза АД: Видалення диска ТМЖ: порівняння між доклінічними дослідженнями та клінічними знахідками. J Dent Res 91(8): 745e752, 2012
- Холл ХД: Менісектомія для пошкоджених дисків скронево-нижньощелепного суглоба. South Med J 78(5): 569e572, 1985
- Ісімару Дж, Госс АН: Модель остеоартриту скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 50(11): 1191e1195, 1992
- Кієн КЛ, Деспрез ЖД: Менісектомія для внутрішнього порушення скронево-нижньощелепного суглоба. Br J Plast Surg 15: 199e204, 1962
- Кілкенні К, Браун ВД, Катілл ІК, Емерсон М, Альтман ДГ: Поліпшення звітності в біонаукових дослідженнях: рекомендації ARRIVE для звітності про дослідження на тваринах. PLoS Biol 8(6): e1000412, 2010
- Лорелл КА, Тутл Р, Каннінгем Р, Бельтран Дж, Саймон Д: Магнітно-резонансна томографія скронево-нижньощелепного суглоба. Частина II: порівняння з ламінографічними, аутопсійними та гістологічними знахідками. J Prosthet Dent 58(2): 211e218, 1987
- Лі Л, Ван Л, Сунь Y, Ян Ц, Хе Д: Створення та гістологічна оцінка моделі травматичного скронево-нижньощелепного суглоба у кіз. J Oral Maxillofac Surg 73(5): 943e950, 2015
- Літтл КБ, Сміт ММ, Кейк МА, Рід РА, Мерфі МД, Баррі ФП: Ініціатива OARSI з гістопатології - рекомендації щодо гістологічних оцінок остеоартриту у овець та кіз. Osteoarthr Cartil 18(Suppl 3): S80eS92, 2010
- Лінч СМ, Стрікер КТ, Браун ДжС, Берарді ДжМ, Вонг Д, Домчек С та ін.: Оцінка інтервенції з втрати ваги на основі веб-технологій у надмірно вагових онкологічних пацієнтів віком до 50 років. Obes Sci Pract 3(1): 83e94, 2017
- Мачер ДЖ, Вестессон ПЛ, Брукс СЛ, Хікс ДГ, Талленс РХ: Скронево-нижньощелепний суглоб: хірургічно створене зміщення диска викликає артроз у кролика. Oral Surg Oral Med Oral Pathol 73(6): 645e649, 1992
- Мальві Е, Тібод Р, Марімуту К, Дабіс Ф, Група клінічної епідеміології СНІДу в Аквітанії: Втрата ваги та індекс маси тіла як предиктори прогресування ВІЛ-інфекції до СНІДу у дорослих. Когорта Аквітанії, Франція, 1985-1997. J Am Coll Nutr 20(6): 609e615, 2001
- Матіас ЕМ, Мечам ДК, Блек КС, Граф ДжВ, Стіл СД, Вільгельм СК та ін.: Модель неправильної прикусу для остеоартриту скронево-нижньощелепного суглоба у мишей з і без рецептора для продуктів глікації. Arch Oral Biol 69: 47e62, 2016
- Мацура Х, Міямото Х, Куріта К, Госс АН: Вплив автогенних реберно-хрящових трансплантатів на фіброзну та кісткову анкілозу скронево-нижньощелепного суглоба: попереднє експериментальне дослідження. J Oral Maxillofac Surg 64(10): 1517e1525, 2006
- Мелроуз Дж, Фуллер ЕС, Літтл КБ: Біологія меніскальної патології в остеоартриті та її внесок у захворювання суглобів: за межами простих механік. Connect Tissue Res 58(3e4): 282e294, 2017
- Міямото Х, Куріта К, Ісімару Дж, Госс АН: Модель овець для анкілозу скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 57(7): 812e817, 1999
- Мерфі МК, МакБарб РФ, Вонг МЕ, Афанасіу КА: Розлади скронево-нижньощелепного суглоба: огляд етіології, клінічного управління та стратегій тканинної інженерії. Int J Oral Maxillofac Implant 28(6): e393e414, 2013
- Огі Н, Куріта К, Ханда Я, Госс АН: Короткостроковий ефект дисектомії на остеоартритний скронево-нижньощелепний суглоб у овець. Int J Oral Maxillofac Surg 25(4): 319e324, 1996
- Рестон ДжТ, Туркельсон КМ: Мета-аналіз хірургічних методів лікування артритних розладів скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 61(1), 2003 3e10-2
- Річмонд Дж: Удосконалення, зменшення та заміна використання тварин для регуляторного тестування: майбутні поліпшення та впровадження в регуляторну структуру. ILAR J 43(Suppl): S63eS68, 2002
- Шу CC, Сміт ММ, Сміт СМ, Дарт АД, Літтл КБ, Мелроуз Дж: Гістопатологічна схема для кількісного оцінювання дегенерації міжхребцевого диска та терапевтичної корисності дорослих мезенхімальних стовбурових клітин для регенерації міжхребцевого диска. Int J Mol Sci 18(5), 2017
- Сілвер СМ: Довгострокові результати меніскектомії скронево-нижньощелепного суглоба. Cranio 3(1): 46e57, 1984
- Сміт ММ, Кейк МА, Гош П, Шіавінато А, Рід РА, Літтл КБ: Значна синовіальна патологія в моделі меніскектомії остеоартриту: модифікація за допомогою внутрішньосуглобової терапії гіалуронаном. Rheumatology (Oxford) 47(8): 1172e1178, 2008
- Соуза РФ, Ловато да Сілва ЧХ, Нассер М, Федорович З, Аль-Мухарракі МА: Інтервенції для лікування остеоартриту скронево-нижньощелепного суглоба. У: де Соуза РФ (ред.), База даних Кокрану систематичних оглядів; 2012, 2012
- Такайші М, Куріта К, Мацура Х, Госс АН: Вплив трансплантату хряща вушної раковини на хірургічне лікування анкілозу скронево-нижньощелепного суглоба: дослідження на тваринах за участю овець. J Oral Maxillofac Surg 65(2): 198e204, 2007
- Такаку С, Тойода Т: Довгострокова оцінка дисектомії скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 52(7), 1994 722e726-8
- Такаку С, Сано Т, Йошіда М: Довгострокова магнітно-резонансна томографія після дисектомії скронево-нижньощелепного суглоба без заміни. J Oral Maxillofac Surg 58(7): 739e745, 2000
- Тольванен М, Ойкарінен ВД, Вольф ЯА: 30-річне спостереження за меніскектоміями скронево-нижньощелепного суглоба: звіт про п'ять пацієнтів. Br J Oral Maxillofac Surg 26(4): 311e316, 1988
- Трампі ІГ, Лібег Т: Хірургічне лікування внутрішнього порушення скронево-нижньощелепного суглоба: довгострокова оцінка трьох технік. J Oral Maxillofac Surg 53(7), 1995 740e746-7
- Вілкс ЧХ: Хірургічне лікування внутрішніх порушень скронево-нижньощелепного суглоба. Довгострокове дослідження. Arch Otolaryngol Head Neck Surg 117(1): 64e72, 1991
- У Г, Чжу С, Сунь Х, Ху Дж: Зміни субхондральної кістки та хондрогенна здатність прогениторних клітин з субхондральної кістки в моделі остеоартриту скронево-нижньощелепного суглоба, індукованої коллагеназою, у кроликів. Int J Clin Exp Pathol 8(9): 9782e9789, 2015
- Сюй Л, Полур І, Лім С, Сервейс ДжМ, Добек Дж, Лі Y та ін.: Остеоартрит скронево-нижньощелепного суглоба у мишей, індукований частковою дисектомією. Osteoarthr Cartil 17(7): 917e922, 2009
- Яйлен ДМ, Шапіро ПА, Лушеї ЕС, Фельдман ГР: Менісектомія скронево-нижньощелепного суглоба - вплив на структуру суглоба та жувальну функцію у Macaca fascicularis. J Maxillofac Surg 7(4): 255e264, 1979
- Янг АА, Сміт ММ, Сміт СМ, Кейк МА, Гош П, Рід РА та ін.: Регіональна оцінка експресії генів суглобового хряща та метаболізму малих протеогліканів у тваринній моделі остеоартриту. Arthritis Res Ther 7(4): 852e861, 2005
- Чжан М, Ван Х, Чжан Дж, Чжан Х, Ян Х, Ван С, та ін.: Односторонній передній перехрест викликає аномальне мінеральне відкладення в дегенеративному хрящі скронево-нижньощелепного суглоба у щурів. Osteoarthr Cartil 24(5): 921e931, 2016
