Ефективність силіконової тромбоцитарної фібринової матриці та аутологічної кістки при регенерації кістки в дефектах черепа кроликів: радіологічне та гістологічне дослідження.
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація: Виправлення дефектів кістки в оральній хірургії часто вимагає використання технік регенерації кістки. Кремній є елементом, який використовувався як матеріал для регенерації в кількох дослідженнях. У нашому дослідженні кремній був поєднаний з аутологічною кісткою та мембранами, збагаченими тромбоцитами (PRF), щоб проаналізувати поведінку цього елемента в регенерації кістки. Чотири циркумференційні дефекти були створені в черепній коробці 5 кроликів породи Нова Зеландія. Для регенерації дефектів були застосовані наступні елементи: (P): PRF; (S): кремній та (B): аутологічна кістка, з наступним розподілом груп дослідження: Група 1 (PSB); Група 2 (PS); Група 3 (SB) та Група 4 (КОНТРОЛЬ): група без регенерації. Тварини були принесені в жертву через 3 тижні. Було проведено дослідження комп'ютерної мікротомографії (μ-CT), а також гістоморфометричні дослідження. Для порівняння результатів використовувався статистичний тест ANOVA з пост-хок тестом Бонферроні (p≤ 0.05). Радіологічно групи PSB та SB показали кращі результати щодо кількості та відсотка здорової кістки, але не значно в порівнянні з контрольною групою. Група PS показала значно гірші результати. Гістологічний тест виявив, що група PSB має найбільшу площу, відсоток та периметр мінералізованої кістки. При оцінці формуючої кістки (остеоїд) різниці між групами не було виявлено, за винятком периметра кістки, де група SB показала значно кращі результати. Змінна висоти кістки не показала значних відмінностей. У висновку можна стверджувати, що комбінація PRF, аутологічної кістки та кремнію забезпечує хороші результати через 3 тижні, тоді як група PS показує найгірші результати. Це підкреслює важливість аутологічної кістки як частини матеріалу для трансплантації, щоб кістка могла мінералізуватися.
Вступ
Кісткові дефекти в оральній хірургії є поширеними і іноді важкими для ремонту, що вимагає технік регенерації кістки для забезпечення успіху відновлювального лікування. Наукові дослідження продовжують робити кроки вперед у розумінні біологічних і фізіологічних процесів, що беруть участь у загоєнні, регенерації та ремоделюванні кістки. In vivo інженерія тканин охоплює регенерацію та реконструкцію тканин і органів безпосередньо в організмі. Основна ідея полягає в тому, що контрольоване маніпулювання екстраклітинним мікрооточенням може призвести до контролю здатності клітин організовуватися, рости, диференціюватися та формувати функціональну екстраклітинну матрицю, а зрештою і нову функціональну тканину.
Регенеративні техніки стали рутинними процедурами і мають підтверджені клінічні результати, але їх передбачуваність і час очікування все ще є деякими з факторів, що спонукають продовжувати дослідження розробки нових і покращених матеріалів для регенерації кістки. Автологічна кістка та плазма, багата тромбоцитами, є двома широко використовуваними матеріалами в галузі імплантології для регенерації м'яких і твердих тканин. Однак матеріал, який поєднує всі переваги кожного з них окремо, ще не був розроблений.
Використання аутологічної кістки широко описується в літературі, оскільки вважається золотим стандартом для регенерації кістки. Незважаючи на те, що вона має відмінні біологічні властивості остеоіндукції, остеокондукції та остеогенезу, аутограф має значну морбідність і підвищену та непередбачувану швидкість резорбції, але показав, що його поведінка покращується в комбінації з іншими кістковими замінниками, отримуючи більш об'ємний і послідовний об'єм з часом і швидше загоєння кістки.
Разом з аутологічною кісткою, похідні крові, збагачені тромбоцитами, також часто використовуються в регенерації тканин. Серед цих похідних є збагачений тромбоцитами фібрин [PRF]. Це регенеративний біоматеріал, який широко використовується в різних медичних застосуваннях. Крім того, він здобув більшу популярність у порівнянні з збагаченим тромбоцитами плазмою [PRP], оскільки це одностадійна техніка, до якої не потрібно додавати хімічні речовини. Іншою перевагою є поступове вивільнення факторів росту з часом. Одна фібринова мембрана містить велику кількість факторів росту та цитокінів, які беруть участь у регенерації кістки та дозріванні м'яких тканин. Це легко маніпульований біоматеріал, який у хірургії рота застосовується в пародонтальній терапії, збереженні альвеол, хірургічних процедурах збільшення кістки та, у комбінації з кістковими трансплантатами, у хірургії підняття гайморової пазухи. Його останнє застосування, яке ще не було клінічно протестовано, - це як дезінфікуючий засіб для шорстких титанових поверхонь завдяки його антимікробним властивостям.
Нарешті, існує кілька публікацій, які стверджують, що біоінорганічні іони, такі як цинк, марганець, магній або кремній, є необхідними для метаболізму кісток. Кремній є другим за поширеністю елементом у земній корі, а в людському тілі він в основному знаходиться в областях мінералізації та росту кісток. Він відіграє життєво важливу роль у біології кісток і сполучної тканини, і хоча його механізм дії не зовсім зрозумілий, завдяки дослідженням Карлайла та Шварца відомо, що він діє, сприяючи більшій мінералізації на кістковій матриці через синтез і стабілізацію зшивання колагенових волокон. Кремній є ініціюючим фактором у мінералізації кісток, оскільки він присутній у підвищених концентраціях в остеоїдній матриці незрілої кістки, а з розвитком кістки концентрація кремнію зменшується під впливом концентрації кальцію. Протягом років його використовували як регенеративний матеріал для кісток у вигляді покриття для зубних імплантатів, а також він був включений у керамічні біоматеріали [гідроксиапатит, трикальційфосфат або скляні кераміки], що забезпечує хороші результати щодо регенерації кісток у in vitro та in vivo дослідженнях. Ця хороша поведінка зумовлена його сильною зв'язкою. Кремній використовувався разом з іншими біоматеріалами, такими як скляні кераміки або апатит, або з трикальційфосфатом [TCP], щоб покращити біологічні властивості матеріалів, з якими він з'єднується. Однак, наскільки нам відомо, не було досліджень з кістками через утворення біологічно активного шару, подібного до апатиту, на його поверхні.
Силікон використовувався разом з іншими біоматеріалами, такими як скляні кераміки або апатит, або з трикальційфосфатом [TCP], щоб покращити біологічні властивості матеріалів, з якими він з'єднується. Однак, наскільки нам відомо, не було знайдено жодних досліджень щодо використання силікону в комбінації з аутологічною кісткою або з мембранами, багатими на тромбоцити, для використання в регенерації кістки.
У нашому дослідженні силікон був поєднаний з аутологічною кісткою та мембранами PRF для аналізу ролі цього елемента в регенерації кістки, коли він поєднується з іншими широко використовуваними біоматеріалами. Основною метою було оцінити регенерацію кістки, отриману в різних проаналізованих групах (це (P): PRF; (S): силікон та (B): аутологічна кістка, з розподілом групи дослідження наступним чином: Група 1 (PSB); Група 2 (PS); Група 3 (SB) та Група 4 (КОНТРОЛЬ): нерегенеративна група) протягом 3 тижнів у моделі тестування на тваринах.
Матеріали та методи
Тестові зразки тварин
Експериментальне дослідження було проведено на парієтальній кістці 5 лабораторних кроликів породи Новозеландський віком 6 місяців та вагою від 3.5 до 4 кг. Тварини щоденно годувалися (ad libitum) лабораторною дієтою для тварин, використовуючи Harlan-Teklad (2030). Тварини піддавалися хірургічному втручанню під загальною анестезією в Центрі мінімально інвазивної хірургії Хесуса Усона, [Касерес, Екстремадура, Іспанія]. Експеримент проводився відповідно до рекомендацій Іспанського національного інституту здоров'я (NIH) та Європейської директиви 86/609/EEC щодо догляду та використання експериментальних тварин. Дослідження також відповідало Європейській директиві 2010/63/EU про захист тварин, що використовуються в експериментальних цілях, та всім місцевим законам і нормативам. Дослідники отримали схвалення Етичного комітету установи (CCMI-Ref 028/16). Ідентифікація тварин, що входять до груп, які підлягають оцінці, проводилася за допомогою чіпа. Протягом експериментального періоду зразки утримувалися в індивідуальних клітках.
Хірургічна процедура
Перед початком хірургічної процедури було проведено іммобілізацію кроликів, а їхні життєві показники були зафіксовані. Використовувані анестетики включали внутрішньовенний мідазолам (0.25 мг / кг) та пропофол (5 мг / кг) та інгаляційний газ севофлуран (2.8%). Було використано два анальгетики: трамадол (3 мг / кг) та кеторолак (1.5 мг / кг). Після седативного впливу з кожного кролика було взято ретроорбітальний зразок крові за допомогою метеликової голки. Вказані зразки були поміщені в пробірки без антикоагулянту та центрифуговані протягом 12 хвилин на швидкості 2700 об/хв при кімнатній температурі для отримання мембран PRF. Після отримання мембран їх нарізали на невеликі частини приблизно 2 мм в діаметрі, які були розділені на три частини, що використовувалися потім для трьох експериментальних груп. Використовувалося 0.01 мг на см³ силіконового версенату. (Лабораторія природної енергії Венесуели, Каракас, Венесуела).
Було створено чотири дефекти кістки, що не загоюються самостійно (діаметр: 9 мм; глибина: приблизно 3 мм, досягнувши твердих оболонок) на парієтальній кістці, з обох боків середньої лінії черепа, за допомогою трепанатора (Helmut-Zepf Medical GmbH, Зейтинген, Німеччина), встановленого на хірургічний мікромотор на 2000 об/хв під зрошенням фізіологічним розчином. Для видалення внутрішньої таблиці та медулярної кістки кожного дефекту використовувалися п'єзоелектричні інструменти. Глибина контролювалася пародонтальним зондом. Після виконання дефектів отриману кістку подрібнили, а отриманий матеріал розділили на дві рівні частини. Конфігурація груп була такою: Група 1 (PSB): суміш мембрани збагаченої тромбоцитами фібрину (P) + силікон (S) + аутологічна кістка (B); Група 2 (PS): мембрана збагачена тромбоцитами фібрину (P) + силікон (S); Група 3 (SB): силікон (S) + аутологічна кістка (B) і нарешті Група 4 (КОНТРОЛЬ), в якій не було розміщено регенеративного матеріалу. Розподіл груп на парієтальній кістці можна побачити в Таблиці 1.
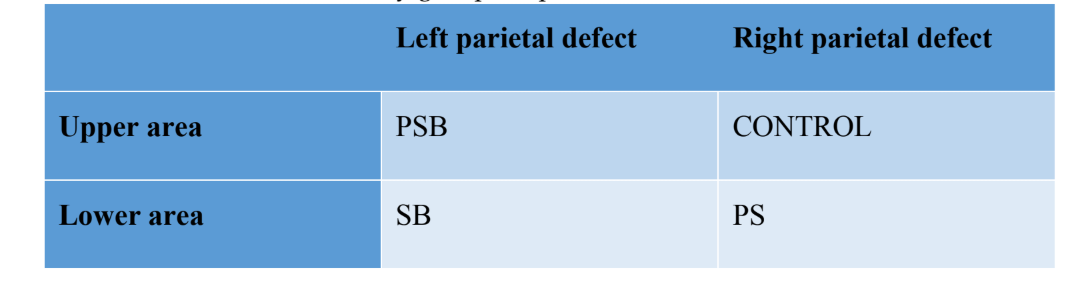
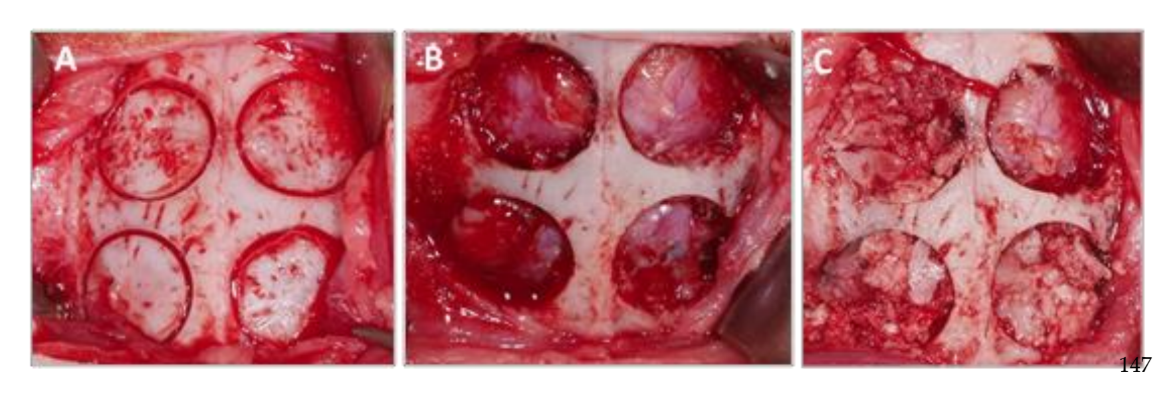
Після накладання швів були введені протизапальні та знеболювальні засоби (карпрофен 1 мл / 12,5 кг та бупренорфін 0,05 мг / кг). Нарешті, тварини були принесені в жертву за допомогою внутрішньовенного передозування хлориду калію через 3 тижні. Хірургічну процедуру можна побачити на малюнку 1.
Зразки, отримані з черепної коробки кожного екземпляра, були розрізані на анатомічній сагітальній площині, а після відділення від мозкової маси та промивання фізіологічним розчином, шматочки були розрізані та помічені індивідуально. Кожен з зразків був занурений у 10% розчин формаліну для томографічного та гістоморфометричного аналізу.
Мікрокомп'ютерна томографія (мікро-CT)
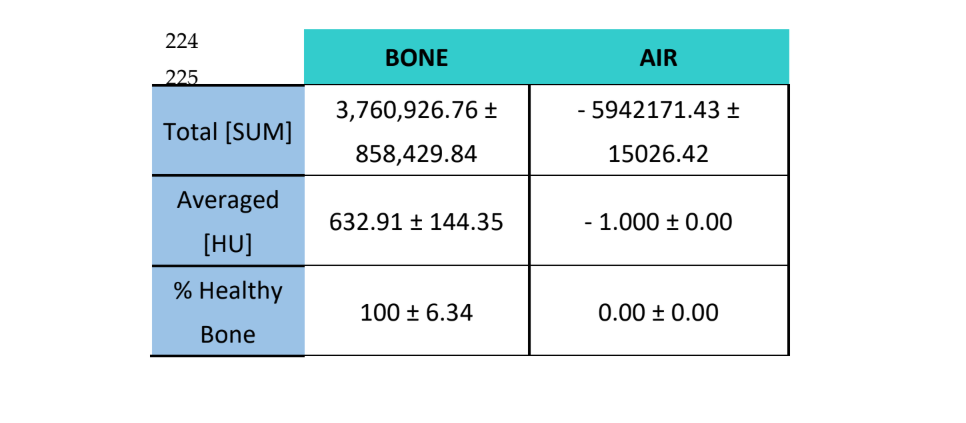
Зразки аналізувалися за допомогою комп'ютерної томографії (CT) з використанням сканера CT Bruker Albira (Bruker Co., Billerica, MA, USA). Знімки були зроблені з використанням наступних параметрів: 1000 зображень, у 360° рентгенівській проекції, при 45 кВ і 30 хвилинах часу захоплення. Томографічна реконструкція була виконана за допомогою програмного забезпечення Albira Suite (Bruker Co., Billerica, MA, USA) та стандартних параметрів реконструкції для генерації 2D та 3D об'ємів з роздільною здатністю 8.3 вокселів/мм. Середня щільність кістки, виміряна в одиницях Хаунсфілда (HU), оцінювалася за допомогою програмного забезпечення PMOD (Bruker Co., Billerica, MA, USA), розташовуючи сферичні об'єми інтересу [VOI] діаметром 2 мм у формі розетки в кожній ураженій ділянці. Високоякісні реконструкції об'єму 10 мм3 були виконані в кожній ураженій ділянці за допомогою програмного забезпечення Albira Suite, що призвело до об'ємів з роздільною здатністю 20 вокселів/мм. Для кожного з об'ємів були оцінені наступні змінні: (1) Загальна сума значень Хаунсфілда всіх вокселів (TOTAL SUM), (2) середнє значення всіх значень Хаунсфілда вокселів (Averaged) в одиницях Хаунсфілда та (3) відсоток здорової кістки (%).
Ті ж самі змінні були оцінені для повітря ̶ як вимір для встановлення фонового шуму зображень ̶ та для навколишньої кістки, в якій відсоток очікуваної здорової кістки становить 100%.
Гістологічна обробка зразка
Зразки були отримані з черепа кожного зразка, вирізаючи уздовж анатомічної сагітальної площини. Осушені зразки були негайно занурені в розчин 4% формальдегіду та 1% кальцію, вмонтовані в акрилову смолу, і їх обробили для різання за методом Доната та Бреунера для отримання гістологічних зрізів товщиною 5 мкм. Зразки були пофарбовані за методом Вона Коссі (VK) 5% нітратом срібла (Sigma-Aldrich Chemical Co., Poole, Великобританія), щоб побачити мінералізовану кістку через 3 тижні, і їх спостерігали за допомогою оптичного мікроскопа Olympus BXB61 (Olympus, Токіо, Японія) з об'єктивами 1.5 та 20x. Зображення були зроблені за допомогою цифрового сигналізатора DSP DS-Fi1 (Nikon, Токіо, Японія) у поєднанні з програмним забезпеченням NIS-Elements 4.0 BR (Nikon, Токіо, Японія). Було зроблено зображення кожного дефекту кістки. За тиждень до жертвування зразків (на 2 тижні) кроликам було введено флуоресцентний маркер для спостереження за депозицією кальцеїну на нещодавно відкладеній кістковій матриці. Флуоресцентні зображення були зроблені за допомогою камери DSP DS-Fi1 [Nikon, Токіо, Японія] у поєднанні з програмним забезпеченням NIS-Elements 4.0 BR [Nikon, Токіо, Японія].
Для обох видів фарбування (VK та імунофлуоресценція) було проаналізовано чотири змінні: висота кістки (тільки на VK) (мм) (BH), площа кістки (µm2) (BA), відсоток площі кістки (%) (BA) та периметр кістки (µm) (BP).
Статистичний аналіз
Для статистичного аналізу отриманих результатів був застосований t-тест ANOVA з подальшим тестом Бонферроні для порівняння результатів, отриманих у обох групах дослідження, з використанням програмного забезпечення STATVIEW F-4.5. Результати були виражені як медіана ± стандартне відхилення для всіх проаналізованих змінних. Рівень значущості був встановлений на p ≤ 0.05.
Результати
Результати для радіологічних змінних
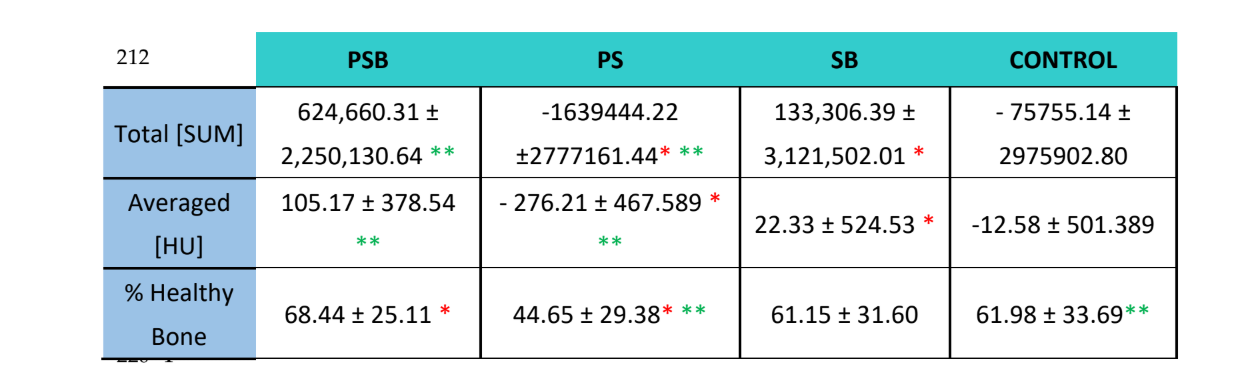
Використовуючи програмне забезпечення Albira Suite, були отримані високоякісні 2D та 3D реконструкції (Рисунок 2) та виміряні змінні кількісної оцінки кістки, в яких після 3 тижнів не було статистично значущих відмінностей між групами PSB, SB та CONTROL у змінних Загальна СУМА, Середня та % Здорової Кістки. Група PS отримала найменш значущі значення для цих трьох змінних (Таблиці 2 та 3).
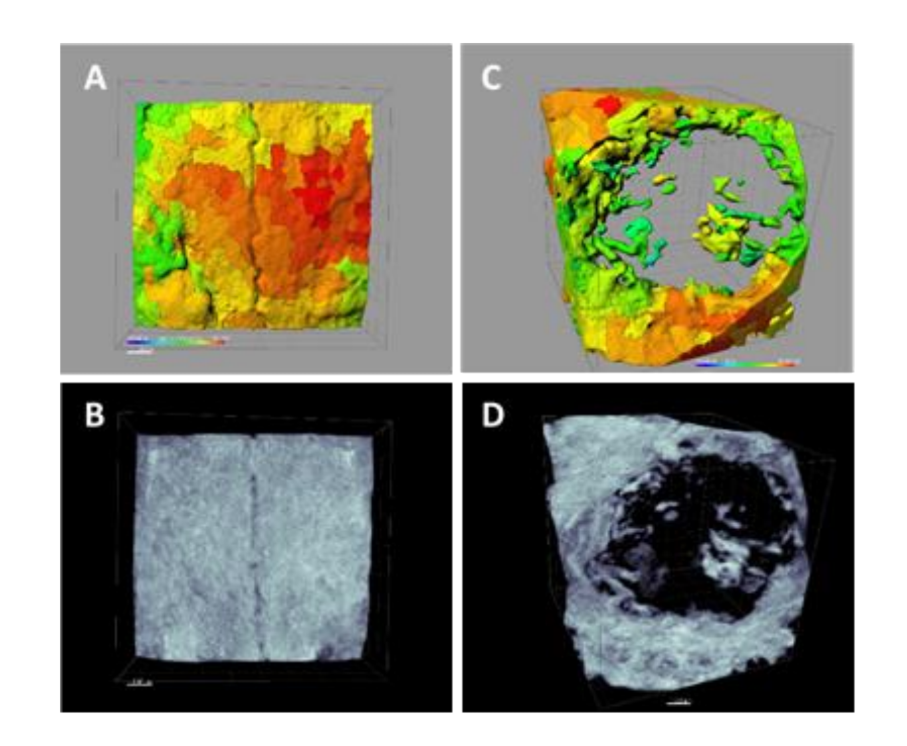
Через три тижні були проведені гістологічні оцінки чотирьох груп (Таблиця 4). Змінна висоти кістки не показала статистично значущих відмінностей між групами після 3 тижнів загоєння.
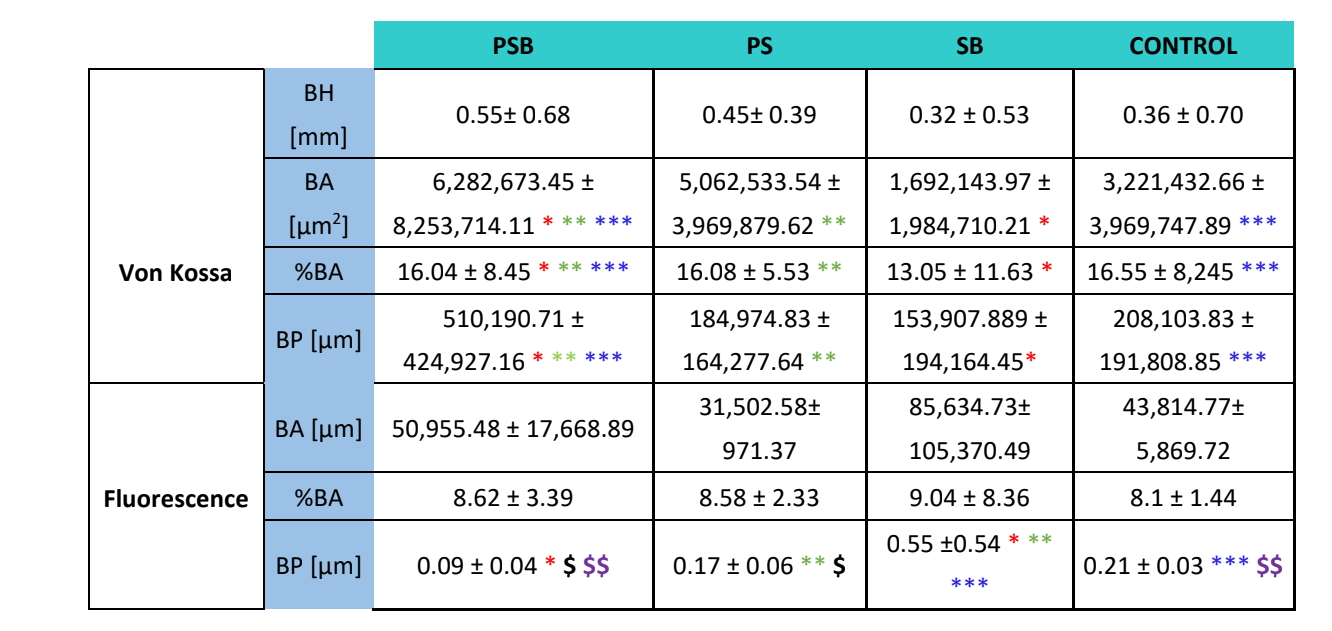
Було проведено два гістологічних фарбування, Вон Косс і флуоресценція (Рисунок 4). Перше використовувалося для спостереження за мінералізованою кісткою. Спостерігалися площа кістки [BA], відсоток площі [%BA] та периметр кістки [BP]. Фарбування Вон Косс показало, що група PSB мала статистично вищі BA та BP, ніж інші групи. Відсоток площі [%BA] був вищим у контрольній групі, хоча і незначно в порівнянні з усіма групами, оскільки розмір вибірки був дуже малим.
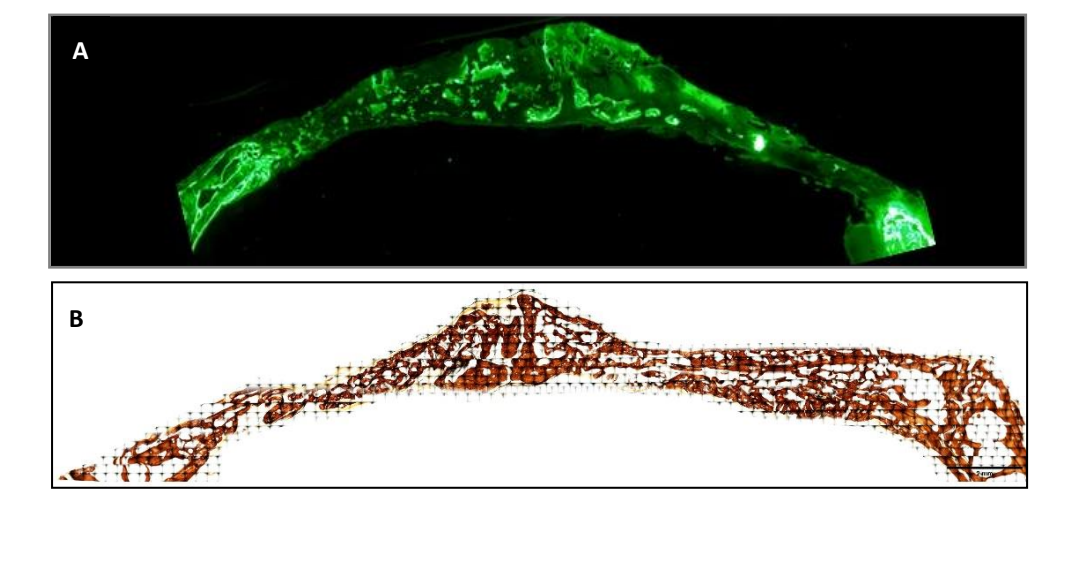
Флуоресцентне фарбування було використано для вимірювання вищезазначених змінних у нововідкладеній кістці. Статистично значущих відмінностей між групами за змінними BA та %BA не спостерігалося після 3 тижнів. У групі SB периметр кістки був значно більшим, тоді як група PSB показала значно нижче значення.
Обговорення
У цьому радіологічному та гістологічному дослідженні ми спостерігали кістку, що утворилася після розміщення різних матеріалів для регенерації кістки, до яких був доданий кремній, щоб оцінити його роль як стимулятора утворення кістки.
У радіологічному дослідженні (Таблиця 2) було виявлено, що групи PSB та SB показали вищі значення щодо кількості та відсотка здорової кістки. Однак ці відмінності не були статистично значущими щодо контрольної групи. З іншого боку, група PS дійсно продемонструвала значно нижчі значення в порівнянні з рештою груп.
Гістологічне дослідження (Таблиця 4) виявило, що група PSB мала найбільшу площу, відсоток та периметр мінералізованої кістки в порівнянні з іншими групами. Навпаки, при оцінці депонування кальцеїну на кістковій матриці не було виявлено різниці між групами щодо площі кістки та відсотка площі. Група SB продемонструвала значно більший периметр кістки. Змінна висоти кістки не показала різниць між групами.
Силікон є біоінорганічним іоном, який використовувався як регенеративний матеріал у кількох дослідженнях, зазвичай разом з іншими неорганічними біоматеріалами, такими як фосфат кальцію або гідроксиапатит. Переваги, які вони пропонують, - це низька вартість та тривалий термін служби. Біоактивність силікону залежатиме від накопичення іонів силікону, коли він піддається впливу рідин організму, таких як кров, як у випадку цього дослідження. Це явище призвело до утворення шару, подібного до біологічно активного апатиту.
Наскільки нам відомо, в літературі немає доказів використання силіконового версенату як регенеративного матеріалу, тому порівняння з іншими дослідженнями слід проводити з обережністю.
Зазвичай використовуваний метод полягає в заміні гідроксиапатиту або кальційфосфату на силікон за допомогою методів осадження, що дозволяє отримувати регенеративні біоматеріали з кращими властивостями. Кілька in vitro досліджень показали, що силікон є біосумісним і біоінертним елементом. Крім того, він сприяє ангіогенезу, остеобластичній диференціації та збільшує мінеральну щільність кістки, прискорюючи її формування. У недавньому дослідженні дефекти були регенеровані на черепних склепіннях щурів, і через 4 тижні було виявлено, що значно більше утворення кістки відбулося в порівнянні з подібною сумішшю, до якої силікон не був доданий.
Також були проведені змішані in vitro та in vivo дослідження, в яких було можливим порівняти поведінку силікону в обох ситуаціях. Мао та ін. провели дослідження, в якому силікон був доданий до суміші кальційфосфату та склокераміки для регенерації дефектів черепних склепінь у кроликів. Спостерігалася клітинна життєздатність, подібна до тієї, що спостерігалася в губчастій кістці великої рогатої худоби, але з вищим рівнем клітинної проліферації. Все це було приписано включенню іонів силікону, які також сприяли іншим клітинним функціям, таким як клітинна адгезія. У гістологічному дослідженні, що проводилося, було виявлено збільшення утворення нової кістки в експериментальній групі.
Відповідно до переглянутої літератури, очікується, що більша кількість мінералізованої кістки буде знайдена в групах, що містять кремній. У нашому дослідженні групи PS та SB не показали різниці в порівнянні з контрольною групою, тоді як комбінація кремнію, фібрину, збагаченого тромбоцитами, та аутологічної кістки [група PSB] дозволила досягти значно вищого рівня мінералізованої кістки, ніж інші.
Аутологічна кістка все ще вважається золотим стандартом матеріалу для регенерації, оскільки є єдиною, що має остеогенні, остеоіндуктивні та остеокондуктивні властивості, що надає їй перевагу в порівнянні з іншими доступними матеріалами. Незважаючи на це, її обмежена доступність, захворюваність та вищий рівень резорбції спонукали до пошуку нових біоматеріалів.
У нашому дослідженні аутологічна кістка в комбінації з кремнієм [SB] не показала значної різниці в порівнянні з групами PS та контрольною групою щодо кальцифікованої кістки. Однак, після групи PSB, вона була тією, що представила більшу кількість кістки та більший периметр остеоїдної кістки. Немає публікацій, в яких будь-яка з груп дослідження використовувала б аутологічну кістку з кремнієм; і наші попередні результати свідчать про те, що нам потрібно буде спостерігати, як веде себе аутологічна кістка протягом тривалих періодів.
Плазма, багата на фібрин, раніше використовувалася в регенерації кісток як єдиний матеріал для заповнення або в комбінації з аутологічною кісткою, ксенографтами або алопластичними графтами, що забезпечує кращі результати щодо регенерації кісток і швидшого загоєння в порівнянні з негативними контрольними групами. Однак є обмежені докази щодо комбінації кремнію та концентратів, багатих на тромбоцити. У літературі було знайдено лише два дослідження, які поєднують обидва матеріали. Їх результати відрізняються, як і наші. У першому дослідженні комбінація PRP/кремній була згодом гелевою з хлоридом кальцію. Вона була застосована на клітинній культурі остеобластів, і в експериментальній групі спостерігалися більша проліферація, більша життєздатність клітин і більше осадження кальцію, ніж у групі без кремнію. Навпаки, у другому дослідженні фактор, що генерує клітини (CGF), був поєднаний з натрієвим ортосилікатом на людських остеобластах. Не було виявлено статистично значущих відмінностей щодо клітинної проліферації або росту в порівнянні з групами, в яких було введено лише ортосилікат або лише концентрат тромбоцитів. Навпаки, було спостережено більшу продукцію колагену типу I. У обох дослідженнях було зроблено висновок, що остеокондуктивні властивості кремнію будуть підсилені факторами росту в CGF. Обидва результати відрізнялися в нашому дослідженні, в якому група PS отримала значно нижчі радіологічні значення, хоча гістологічно не показала різниці в порівнянні з контрольною групою. Порівняння з обома публікаціями слід проводити з обережністю, оскільки це були in vitro дослідження з іншим матеріалом. Незважаючи на це, наші результати відповідали двом випробуванням, проведеним на кістці кролика, в яких було спостережено, що PRF не покращує регенерацію кісток в значній мірі в порівнянні з негативною контрольною групою.
У нашому дослідженні спостерігалося більше утворення мінералізованої кістки в групі PSB, і це може бути зумовлено двома факторами: перший з них полягає в тому, що кремній та PRF підвищують його остеокондуктивну здатність при поєднанні один з одним і одночасно прискорюють мінералізацію кістки. Це може пояснити кращі результати групи PSB у нашому дослідженні. Другим фактором є додавання аутологічної кістки до біоматеріалу, який, як було зазначено раніше, вважається референтним матеріалом у регенерації кістки.
Серед обмежень дослідження варто зазначити невелику кількість зразків у вибірці, а також оцінюваний період часу. Групи дослідження PSB та SB продемонстрували хороші результати регенерації, однак радіологічно вони не показали значної різниці в порівнянні з контрольною групою. Способом покращення дослідження могло б бути оцінювання більш тривалих періодів часу, що, можливо, дало б більш показові результати щодо поведінки цих регенеративних матеріалів. Крім того, використання позитивної контрольної групи (заповнення дефекту аутологічною кісткою без кремнію або сумішшю лише аутологічної та гетерологічної кістки) могло б бути розглянуте. Ще одне обмеження дослідження полягає в складнощах порівняння через тип використаного матеріалу (кремнієвий версенат). Кремній є елементом, який використовується в дуже різних формах у літературі, таких як діоксид кремнію, ацетат кремнію та силікат натрію, і досі немає валідаційного протоколу. У нашому дослідженні використовувався гранульований кремній. У фізіологічних умовах біодоступний кремній знаходиться у формі орто-силікатної кислоти, тоді як у дослідженнях, де використовувався гідроксиапатит, заміщений кремнієм, кремній використовувався у формі SiO4, хоча, з іншого боку, нещодавно було показано, що кремній у своїй фізіологічній формі не може концентруватися на неорганічному мінеральному етапі кістки без попередньої метаболізації його в орто-силікат.
У радіологічному дослідженні не було виявлено статистично значущої різниці між групами дослідження в порівнянні з контрольною групою, і це може бути пов'язано з відсутністю використання мембран або фіксуючих агентів для покриття дефекту, щоб стабілізувати коагуляцію та запобігти затримці в повній осифікації області, хоча період, що вивчався (3 тижні), був би недостатнім для спостереження цього.
Висновки
Силікон є перспективним елементом як матеріал, який можна включити з іншими матеріалами для регенерації кістки через його низьку вартість і хороші властивості, виявлені in vitro та in vivo, хоча визначення його властивостей та оптимальних умов використання все ще досліджується. Комбінація фібрину, збагаченого тромбоцитами, аутологічної кістки та силікону дає хороші результати після 3 тижнів. Групи PSB та SB показують хороші результати, при цьому група PSB демонструє вищу швидкість мінералізації кістки в порівнянні з SB, і це може бути пов'язано з включенням плазми, збагаченої тромбоцитами, та силікону. Отримані результати цього дослідження підкреслюють важливість аутологічної кістки як частини матеріалу для трансплантації, щоб кістка могла мінералізуватися.
У межах цього дослідження гістологічний аналіз регенерованих тканин може надати корисну інформацію про природу та кількість кістки, що утворюється за допомогою кремнію, фібрину, збагаченого тромбоцитами, та аутохтонної кістки. Потрібні подальші дослідження, щоб отримати знання про справжній регенеративний потенціал біоінорганічних іонів, таких як кремній.
Автори: Аргіміро Ернандес-Суарез, Марія Різо-Горріта, Дубраска Суарез-Вега, Гладис Веласко, Іван Родрігес Гельфенштейн, Марія-Ангелес Серрера-Фігальо та Даніель Торрес-Лагарес
Посилання:
- Феррес Е. Дослідження ефекту додавання кремнію до бета-фосфату трикальцію та гідроксиапатиту в неоформленій кістці в критичних дефектах у черепах і кроликах. Докторська дисертація. Університет Мурсії. 2017.
- Моралес Д. Інженерія тканин як опора регенеративної медицини в стоматології. Кубинський журнал стоматології 2014;51(3):288-304
- Оппенгеймер А. Дж., Тонг Л., Бухман С. Р. Краньофаціальна кісткова трансплантація: закон Вольфа знову розглянуто. Краніомаксилофасційна травма реконструкція. 2008;1(1):49-61.
- Генкель Дж., Вудрафф М. А., Епарі Д. Р., Штек Р., Глатт В., Дікінсон І. С., Чунг П. Ф., Шутц М. А., Хутмахер Д. В. Регенерація кістки на основі концепцій інженерії тканин - перспектива XXI століття. Дослідження кістки. 2013 25 вересня;1(3):216-48.
- Морденфельд А., Йоганссон К. Б., Альбректссон Т., Халльман М. Випадкове контрольоване клінічне дослідження двох різних складів депротеїнізованої великої рогатої кістки та аутохтонної кістки, використаних для бічного підвищення гребеня. Клінічні дослідження імплантів. 2014 березня;25(3):310-320.
- Масуді Е., Рібас Дж., Каушік Г., Лейтен Дж., Хадемхоссейні А. Продукти крові, збагачені тромбоцитами, для інженерії тканин на основі стовбурових клітин і регенерації. Поточні звіти про стовбурові клітини. 2016 березня;2(1):33-42.
- Анітуа Е., Санчес М., Нурден А. Т., Нурден П., Оріве Г., Андія І. Нові погляди та нові застосування терапій з фібрином, збагаченим тромбоцитами. Тенденції біотехнологій. 2006 травня;24(5):227-34.
- Амарал Валладао К. А. молодший, Фрейтас Монтейро М., Жолі Дж. Керована регенерація кістки в етапному вертикальному та горизонтальному підвищенні кістки з використанням фібрину, збагаченого тромбоцитами, у поєднанні з кістковими трансплантатами: ретроспективне клінічне дослідження. Міжнародний журнал імплантології. 2020 17 жовтня;6(1):72.
- Чо Й. С., Хванг К. Г., Чун Ш. Х., Талларіко М., Квон А. М., Парк Ч. Дж. Радіологічний порівняльний аналіз між заповненням фізіологічним розчином і фібрином, збагаченим тромбоцитами, після гідравлічного транс-крестального підняття синуса без додаткового кісткового трансплантату: випадкове контрольоване дослідження. Клінічні дослідження імплантів. 2020 листопада;31(11):1087-1093.
- Ареевонг К., Чантарамунгкорн М., Хонгкхунтіан П. Фібрин, збагачений тромбоцитами, для збереження альвеолярних кісткових лунок після видалення зуба: випадкове контрольоване дослідження. Клінічні дослідження імплантів та супутніх досліджень. 2019 грудня;21(6):1156-1163.
- де Алмейда Баррос Мораун CF, де Мело-Мачадо Р. С., Джавід К., Морасchini В. Використання фібрину, збагаченого лейкоцитами та тромбоцитами, в управлінні загоєння м'яких тканин і болю в лунках після видалення: випадкове клінічне дослідження. Журнал краніомаксилофасційної хірургії. 2020 квітня;48(4):452-457.
- Кастро А. Б., Ерреро Е. Р., Сломка В., Пінто Н., Тейгельс В., Квірінен М. Антимікробна здатність фібрину, збагаченого лейкоцитами та тромбоцитами, проти періодонтальних патогенів. Наукові звіти. 2019 3 червня;9(1):8188.
- Шульдт Л., Бі Дж., Оуен Г., Шен Й., Хаапасало М., Хаккінен Л., Ларява Х. Деконтамінація грубих поверхонь імплантів, колонізованих багаточисельними оральними біоплівками, шляхом застосування фібрину, збагаченого лейкоцитами та тромбоцитами. Журнал пародонтології. 2020 27 серпня.
- Зофкова І., Нємчікова П., Матуча П. Слідові елементи та здоров'я кісток. Клінічна хімія та лабораторна медицина. 2013 серпня;51(8):1555-61.
- Чжан Д., Вонг Ч. С., Вень Ц., Лі Й. Клітинні реакції остеобластоподібних клітин на 17 елементів металів. Журнал біомедичних матеріалів. 2017 січня;105(1):148-158.
- Арора М., Арора Е. Обіцянка кремнію: регенерація кістки та збільшена щільність кістки. Журнал артроскопії та суглобової хірургії 2017;4(3):103-105.
- Карлайл Е. М. Кремній. Можливий фактор у кальцифікації кістки. Наука 1970;167:279–280.
- Карлайл Е. М. Кремній як необхідний слідовий елемент у харчуванні тварин. Симпозіум Фонду Сіби. 1986;121:123-39.
- Шварц К., Мілн Д. Б. Ефекти, що сприяють росту кремнію у щурів. Природа. 1972 6 жовтня;239(5371):333-4.
- Донг М., Цзяо Г., Лю Х., У В., Лі С., Ван Ц., Сюй Д., Лі Х., Лю Х., Чен Й. Біологічний кремній стимулює синтез колагену типу 1 та остеокальцину в остеобластоподібних клітинах людини через сигнальний шлях BMP-2/Smad/RUNX2. Біологічні сліди елементів. 2016 жовтня;173(2):306-15.
- Прайс К. Т., Ковал К. Дж., Лангфорд Дж. Р. Кремній: огляд його потенційної ролі в профілактиці та лікуванні постменопаузального остеопорозу. Міжнародний журнал ендокринології. 2013;2013:316783.
- Зоу С., Айрленд Д., Брукс Р. А., Раштон Н., Бест С. Впливи силікатних іонів на адгезію, проліферацію та диференціацію остеобластів людини. Журнал біомедичних матеріалів. 2009 липня;90(1):123-30. Урібе П., Йоганссон А., Джугдаохсінг Р., Пауелл Дж. Дж., Магнуссон С., Давіла М., Вестерлунд А., Рансйо М. Розчинний кремнезем стимулює остеогенну диференціацію та комунікацію через щілинні з'єднання в клітинах зубного фолікула людини. Наукові звіти. 2020 18 червня;10(1):9923.
- Кім, Е. Дж., Бу, С. Й., Сунг, М. К. & Чой, М. К. Вплив кремнію на активність остеобластів та мінералізацію кістки клітин MC3T3-E1. Біологічні сліди елементів. 2013; 152(1):105–12.
- Хенч Л. Л., Ікснос І. Д., Полак Дж. М. Біоактивні скласти для регенерації тканин in situ. Журнал науки про біоматеріали. 2004;15(4):543-62.
- Чоудхурі М. Кремнієві формуляції для доставки ліків, лікування кісток та регенерації кісток. ChemBioEng Rev 2016; 3(5):229-246.
- Бйун І. С., Саркар С. К., Анірбан Джйоті М., Мін Й. К., Сео Х. С., Лі Б. Т., Сонг Х. Й. Початкова біосумісність та підвищена реакція остеобластів на Si-допування в пористому заміннику кісткового трансплантату BCP. Журнал матеріалів науки та матеріалів. 2010 червня;21(6):1937-47.
- Мао З., Гу Й., Чжан Дж., Шу В. В., Цуй Й. Вища біологічна продуктивність та остеоіндуктивна активність частинок біоактивної регенерації кістки, що містять Si, для реконструкції альвеолярної кістки. Кераміка. Інт. 2020. 46(2020):353-364.
- Ван Х., Іто А., Сого Й., Лі Х., Ойане А. Силікатно-апатитні композитні шари на зовнішніх фіксуючих стрижнях та in vitro оцінка за допомогою фібробластів та остеобластів. Журнал біомедичних матеріалів. 2010 1 березня;92(3):1181-9.
- Рох Дж., Кім Дж. Й., Чой Й. М., Ха С. М., Кім К. Н., Кім К. М. Регенерація кістки з використанням суміші кремнієвого коралового HA та β-TCP у моделі дефекту черепної кістки щура. Матеріали (Базель). 2016 6 лютого;9(2):97.
- Толедано М., Толедано-Осоріо М., Осоріо Р., Карраско-Кармоно А., Гут'єррес-Перес Х. Л., Гут'єррес-Корралес А., Серрера-Фігальо М. А., Лінч К. Д., Торрес-Лагарес Д. Доксициклін і полімери на основі кремнезему, завантажені цинком, як біоматеріали для регенерації кістки. Полімери (Базель). 2020 25 травня;12(5):1201.
- Санчез Ф., Ореро А., Соріано А., Коррехер С., Конде П., Гонсалес А., Ернандес Л., Молінер Л., Родрігес-Альварес М. Дж., Відал Л. Ф., Бенльох Дж. М., Чепмен С. Е., Ліві В. М. ALBIRA: система ПЕТ∕СЕПТ∕КТ для малих тварин. Медична фізика. 2013 травня;40(5):051906.
- Донат К., Брюннер Г. Метод для вивчення некальцифікованих кісток і зубів з прикріпленими м'якими тканинами. Техніка Säge-Schliff (пиляння та шліфування). Журнал оральної патології. 1982 серпня;11(4):318-26.
- Гарбо С., Локс Дж., Д'Есте М., Демазо Г., Мокану А., Роман С., Хоровіц О., Томоая-Котісел М. Розвинені багатозаміщені гідроксиапатити Mg, Zn, Sr, Si для регенерації кістки. Міжнародний журнал наномедицини. 2020 13 лютого;15:1037-1058.
- Ван В., Єунг К. В. Кісткові трансплантати та біоматеріали замінники для ремонту дефектів кістки: огляд. Біоактивні матеріали. 2017 червня 466 7;2(4):224-247.
- Гьотц В., Тобіасч Е., Вітцлебен С., Шульце М. Впливи кремнієвих сполук на біомінералізацію, остеогенез та формування твердих тканин. Фармацевтичні засоби. 2019 12 березня;11(3):117.
- Гібсон І. Р., Бест С. М., Бонфілд В. Вплив заміщення кремнієм на спікання та мікроструктуру гідроксиапатиту. Журнал Американського керамічного товариства. 2002;85(11):2771–2777
- Портер А. Е., Ботелхо К. М., Лопес М. А., Сантос Дж. Д., Бест С. М., Бонфілд В. Ультраструктурне порівняння розчинення та осадження апатиту на гідроксиапатиті та гідроксиапатиті, заміненому кремнієм, in vitro та in vivo. Журнал біомедичних матеріалів. 2004 червня 15;69(4):670-9.
- Лі Х., Чанг Дж. Біоактивні силікатні матеріали стимулюють ангіогенез у системі спільної культури фібробластів та ендотеліальних клітин через паракринний ефект. Активація біоматеріалів. 2013 червня;9(6):6981-91.
- Ші М. Й., Дінг С. Дж., Чанг Х. С. Роль кремнію в проліферації та апоптозі остеобластоподібних клітин. Активація біоматеріалів. 2011 477 червня;7(6):2604-14.
- Тіан Е. С., Хуанг Дж., Бест С. М., та ін., Відповідь остеобластів на нанокристалічний гідроксиапатит, замінений кремнієм, тонкий шар. Біоматеріали 2006; 27(13):2692–2698
- Лі, С. Х., Кім, С. В., Лі, Дж. І., Юн, Х. Дж. Вплив фібрину, збагаченого тромбоцитами, на регенерацію кістки та ангіогенез у дефектах черепа кролика. Тканинна інженерія та регенеративна медицина 2015. 12(5):362-370.
- Джон Й. Р., Кім М. Дж., Кім Й. О., Рох Т. С., Лі В. Дж., Кан Е. Х., Юн І. С. Регенерація кістки без каркаса з використанням фібрину, збагаченого тромбоцитами, у моделі дефекту черепа. Журнал черепно-лицевої хірургії. 2018 січня;29(1):251-254.
- Сіндел А., Деречі Ö, Тору Х. С., Тозоглу С. Гістоморфометричне порівняння регенерації кістки в критичних дефектах кістки з використанням демінералізованої кісткової матриці, фібрину, збагаченого тромбоцитами, та гіалуронової кислоти як замінників кістки. Журнал черепно-лицевої хірургії. 2017 жовтня;28(7):1865-1868.
- Кокдере Н. Н., Байкул Т., Фіндік Й. Використання фібрину, збагаченого тромбоцитами (PRF), та PRF-мішаного часткового аутохтонного кісткового трансплантату в лікуванні дефектів кістки: експериментальне та гістоморфометричне дослідження. Журнал досліджень стоматології (Ісфахан). 2015 вересня-жовтня;12(5):418-24.
- Караюрека Ф., Кадироглу Е. Т., Нергіз Й., Кошкун Акчай Н., Тунік С., Ерсöz Канай Б., Уйсал Е. Поєднання фібрину, збагаченого тромбоцитами, з різними матеріалами кісткових трансплантатів: експериментальне дослідження гістопатологічних та імуногістохімічних аспектів загоєння кістки. Журнал краніомаксилофасційної хірургії. 2019 травня;47(5):815-825.
- Кнапен М., Гельдоф Д., Дріон П., Лайроль П., Ромпен Е., Ламбер Ф. Вплив фібрину, збагаченого лейкоцитами та тромбоцитами (L-PRF), на регенерацію кістки: дослідження на кроликах. Клінічні дослідження імплантів та супутніх досліджень. 2015 січня;17 Додаток 1:e143-52.
- Сані Ф., Мехдіпур Ф., Талаєі-Хозані Т., Сані М., та Разбан В. Виготовлення каркасів з плазми, збагаченої тромбоцитами/кремнеземом для інженерії кісткових тканин. Біоінспіровані, біоміметичні та нанобіоматеріали 2018 7:2, 74-81.
- Бонацца В., Борсани Е., Буффолі Б., Пароліні С., Інчінголо Ф., Реззані Р., Роделла Л. Ф. Ін витро лікування з концентрованими факторами росту (CGF) та натрієм орто-силікатом позитивно впливає на відновлення клітин у трьох різних людських клітинних лініях. Міжнародна клітинна біологія. 2018 березня;42(3):353-364.
- Фаот Ф., Депрез С., Вандамме К., Камаргос Г. В., Пінто Н., Вутерс Дж., ван ден Оорд Дж., Квірінен М., Дуйк Дж. Вплив мембран L-PRF на загоєння кістки в дефектах кістки тибії кролика: результати мікро-КТ та біомаркерів. Наукові звіти. 2017 12 квітня;7:46452.
- Філдінг Г. А., Смуут В., Босе С. Впливи SiO2, SrO, MgO та ZnO домішок у трикальцієвих фосфатах на експресію остеобластів Runx2. Журнал біомедичних матеріалів. 2014 липня;102(7):2417-26.
- Камітакхара М., Татсукава Е., Сібата Й., Умемото С., Йокої Т., Іоку К., Ікеда Т. Вплив включення силікатів на in vivo реакції α-трикальцієвих фосфатних керамік. Журнал матеріалів науки та матеріалів. 2016 травня;27(5):97.
- Чаппелл Х. Ф., Джугдаохсінг Р., Пауелл Дж. Дж. Фізіологічне включення кремнію в мінерал кістки вимагає метаболізму орто-силікатної кислоти до SiO44. Журнал Королівського товариства Інтерфейсу. 2020 червня;17(167):20200145.
- Гут'єррес-Прієто С. Х., Фонсека Л. Ф., Секеда-Кастаньеда Л. Г., Діас К. Дж., Кастаньеда Л. Й., Лейва-Рохас Х. А., Сальседо-Рейес Х. С., Акоста А. П. 508 Розробка та біосумісність матеріалу гідроксиапатиту, отриманого з яєчної шкаралупи, модифікованого Si/PLGA для регенерації кістки в стоматології. Міжнародний журнал стоматології. 2019 5 грудня;2019:5949232.
- Сзурковська К., Сзелесцук Ł., Колмас Й. Впливи умов синтезу на формування Si-замінених альфа-трикальцієвих фосфатів. Міжнародний журнал молекулярної науки. 2020 1 грудня;21(23):9164.
