Ефективність тривалої низькодозової терапії макролідами у запобіганні ранньому рецидиву носових поліпів після ендоскопічної синусної хірургії
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Передумови: Це дослідження оцінювало ефективність “довгострокової” терапії макролідами кларитроміцином як доповнення до підтримуючої терапії назальними кортикостероїдами для запобігання рецидиву носових поліпів (NP) після функціональної ендоскопічної хірургії синусів (FESS).
Методи: Усього 66 пацієнтів з хронічним риносинуситом та двосторонніми NP були рандомізовані на 3 групи, по 22 пацієнти в кожній групі. Після FESS пацієнти в першій та другій групах отримували кларитроміцин 250 мг/день протягом 12 та 24 тижнів відповідно, тоді як пацієнти в третій групі не отримували жодного кларитроміцину. Пацієнти в усіх 3 групах отримували підтримуючу терапію з мометазону фуроату 400 мкг/день. Оцінка пацієнтів проводилася до операції та через 6, 12 і 24 тижні після операції, за допомогою візуальної аналогової шкали (VAS), 20-пунктового тесту результатів синусів (SNOT-20), акустичної ринометрії, риноманометрії, часу транзиту сахарину, назальної ендоскопії, комп'ютерної томографії (КТ) придаткових пазух носа та вимірювання рівня еозинофільного катіонного білка (ECP) у їхніх назальних секретах.
Результати: Дослідження підтвердило ефективність “довгострокової” терапії макролідами, що призвело до значного поліпшення всіх параметрів, за винятком акустичної ринометрії та VAS у обох групах кларитроміцину в порівнянні з контролем. Концентрація ECP у носових секретах різко зросла після операції, а потім повернулася до базових рівнів після 12 та 24 тижнів лікування кларитроміцином. У контрольній групі рівень ECP продовжував зростати і був значно вищим на кінцевому етапі. Обидві групи з кларитроміцином показали значно кращі ендоскопічні та КТ оцінки, ніж контрольна група на кінцевому етапі.
Висновок: “Довгостроковий” низькодозовий кларитроміцин 250 мг/день здатний контролювати еозинофільне запалення та запобігати ранньому рецидиву НП після FESS 2014 ARS-AAOA, LLC.
Хронічний риносинусит (ХРС) часто виникає у поєднанні з носовими поліпами (НП). У 1 дослідженні ХРС з НП (ХРСзНП) був діагностований у 4% усієї популяції і асоціюється з бронхіальною астмою (БА) у 7% до 13% випадків. Крім того, аспірин-екзасербоване респіраторне захворювання (АЕРД) та НП присутні у великої кількості пацієнтів (від 36% до 96%). У ХРСзНП переважаючою запальною клітиною є еозинофіл, який виявляється як у тканинах, так і в слизу дихальних шляхів майже у всіх пацієнтів з ХРСзНП. Хоча роль інфекції (нейтрофільне запалення) була досліджена, вона не здається первинним фактором у розвитку ХРСзНП, хоча ХРСзНП асоціюється з БА. Алергія, здається, є супутнім станом, а не первинним фактором у розвитку ХРСзНП. На сьогоднішній день жодне медичне чи хірургічне лікування не може забезпечити постійний контроль або тривале лікування. Наразі єдиним доведеним лікуванням для ефективного контролю ХРСзНП є топічні назальні стероїдні спреї з або без системних глюкокортикостероїдів (ГКС). Рецидивуючий ХРСзНП не завжди запобігається навіть за допомогою системних ГКС, і побічні ефекти можуть бути серйозними, включаючи катаракту та компресію хребців. Оскільки контроль захворювання може бути складним навіть за допомогою системних ГКС, ми вирішили вивчити лікування “довгостроковою” терапією (3-6 місяців і більше) з використанням низькодозових макролідних антибіотиків. Очевидно, що неантибактеріальні властивості макролідів (еритроміцин, рокситроміцин, кларитроміцин) сприяють їхнім протизапальним ефектам, які включають інгібування як нейтрофільного, так і еозинофільного запалення. Макроліди здатні модулювати імунну відповідь, інгібувати ріст поліпів, знищувати біоплівки та підвищувати захисні властивості слизової оболонки дихальних шляхів.
Ефективність макролідів у пацієнтів з ХРС без НП була підтверджена; однак їхня ефективність у пацієнтів з ХРС з НП не була ретельно досліджена. Тому наше проспективне рандомізоване контрольоване дослідження було спроектовано для оцінки ефективності та безпеки тривалого курсу (3 та 6 місяців) терапії низькими дозами кларитроміцину у пацієнтів з ХРС з НП після функціональної ендоскопічної хірургії синусів (ФЕХС).
Пацієнти та методи
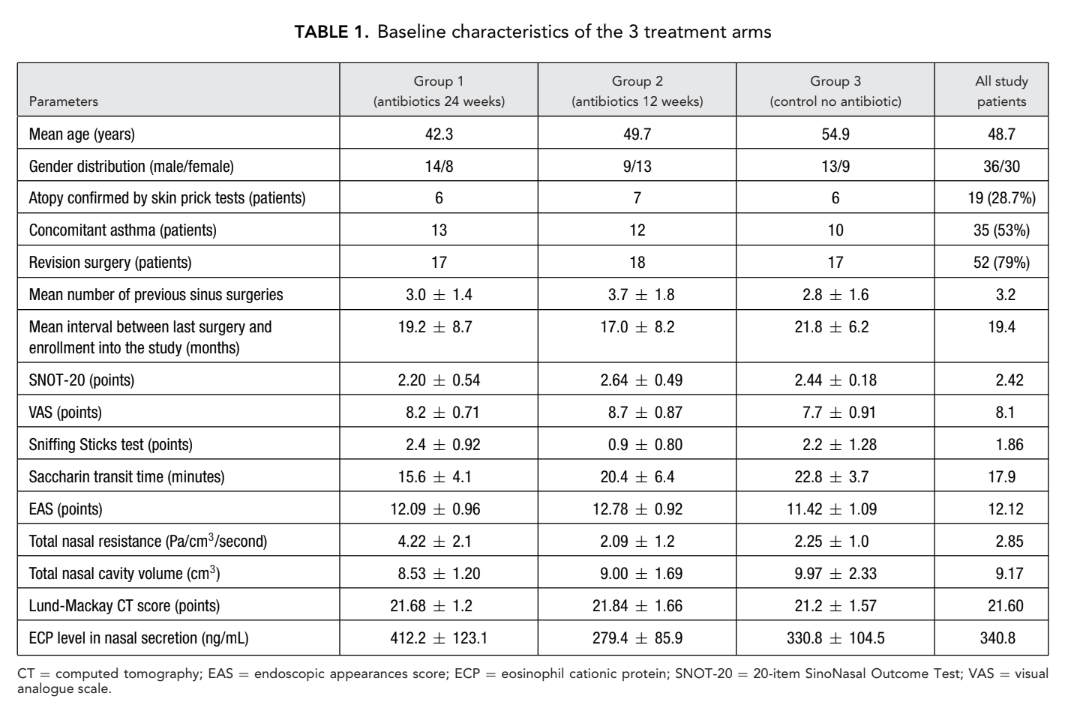
У дослідження було залучено 66 пацієнтів (36 чоловіків та 30 жінок) віком від 18 до 77 (в середньому, 48.7) років з двостороннім ХРС з НП, підтвердженим ендоскопією. Період дослідження тривав з січня 2008 року по березень 2011 року. Усі 66 пацієнтів були випадковим чином розподілені (система запечатаних конвертів) на 1 з 3 груп дослідження (22 пацієнти в групі) наступним чином: група 1 (антибіотики на 24 тижні); група 2 (антибіотики на 12 тижнів); та група 3 (контрольна, без антибіотиків).
Усі 3 групи отримували топічний назальний стероїдний спрей (мометазону фуроат), 400 μg/день протягом 24 тижнів після ФЕХС. Макролідний антибіотик, що використовувався в обох групах 1 та 2, був кларитроміцин 250 мг/день (Клацид; Abbott Laboratories, Abbott Park, Illinois, USA). Більшість пацієнтів (79%) мали принаймні 1 попередню хірургію синусів без тривалого успіху; середня кількість попередніх хірургій у всіх 66 пацієнтів становила 3.2 (Таблиця 1).
Критерії виключення включали наступне: односторонній CR-SwNP, непереносимість макролідів, використання системних стероїдів, вагітність, лактацію та тяжкі соматичні захворювання. Ми виключили всіх пацієнтів, які отримували системні стероїди, оскільки в Росії системна стероїдна терапія зарезервована лише для тяжких пацієнтів з БА. Було б неетично припиняти системні стероїди у цих пацієнтів з БА; крім того, системні стероїди могли б негативно вплинути на надійність результатів нашого дослідження. Етичний комітет Першого Московського державного медичного університету імені Сеченова вимагав, щоб усі пацієнти в усіх 3 групах продовжували використовувати топічні назальні стероїди після FESS, інакше НП може швидко повторитися.
Після набору учасників всі 66 пацієнтів пройшли двосторонню FESS, яку виконував один і той же хірург (старший автор Лопатін А.). Пацієнти групи 1 (антибіотики протягом 24 тижнів) та групи 2 (антибіотики протягом 12 тижнів) розпочали тривалу терапію кларитроміцином 250 мг/день у перший післяопераційний день і протягом 24 тижнів (6 місяців) або 12 тижнів (3 місяці) відповідно. На 7-й день після операції всі пацієнти розпочали підтримуючу терапію назальним спреєм мометазону фуроат (Назонекс, MSD, Merck & Co., Inc., NJ, США) 400 μg/день протягом повних 6 місяців, включаючи пацієнтів групи 3 (контроль без антибіотиків). Етичний комітет затвердив остаточний протокол дослідження, і всі 66 учасників підписали форми згоди.
Пацієнтів ретельно спостерігали та оглядали через 6 тижнів, 12 тижнів і 24 тижні після FESS (Рис. 1). Результати лікування базувалися на оцінці наступних тестів.
20-елементний тест результатів синуситів (SNOT-20) 20-елементний тест результатів синуситів (SNOT-20) є анкетою для оцінки якості життя (QoL) у пацієнтів з риносинуситом.
Візуальна аналогова шкала
Тяжкість захворювання оцінювалася суб'єктивною оцінкою пацієнтів за 10-сантиметровою візуальною аналоговою шкалою (VAS); 1 см на шкалі відображав 1 бал оцінки пацієнта; 0 до 3 балів відповідали легкому захворюванню, 3 до 7 балів відповідали помірному захворюванню, а 7 до 10 балів відповідали важкому захворюванню.
Тест на нюх
Для кожного пацієнта використовувався тест «Sniffin Sticks», розширена версія (Burghart Messtechnik GmbH, Ведель, Німеччина). Ідентифікація запахів оцінювалася за допомогою 16 пробірок з різними запахами. Кількість правильних відповідей була пов'язана з ступенем нюхових порушень, при цьому 16 було максимальним можливим балом. Бал від 0 до 6 відображає аносмію, бал від 7 до 12 називається гіпосмією, тоді як бал від 13 до 16 є нормальним.
Тест часу транзиту сахарину
Цей тест вимірює час транзиту частинки сахарину від передньої частини нижньої носової раковини до глотки, коли пацієнт вперше відчуває смак солодощів.
Насальна ендоскопія
Ендоскопія проводилася за допомогою жорсткого ендоскопа діаметром 2,7 мм (Karl Storz, Тутлінген, Німеччина) без деконгестії. Напівкількісні оцінки були зафіксовані для поліпів, набряку, виділень, кірки та рубцювання на початковому етапі, через 6 тижнів, 12 тижнів та на фінальному оцінюванні через 24 тижні після FESS. Ці результати оцінювалися за допомогою оцінки ендоскопічного вигляду (EAS). Поліпи оцінювалися за розміром від 0 до 3 балів; відсутність поліпів оцінювалася як 0, поліпи, що з'являються лише в середньому носовому ході, оцінювалися як 1; поліпи, що виходять за межі середнього носового ходу, але не заважають носу, оцінювалися як 2; а поліпи, які повністю закривають ніс, оцінювалися як 3. Виділення оцінювалися наступним чином: 0 = без виділень; 1 = прозорі, тонкі виділення; і 2 = густі, гнійні виділення. Мукозний набряк оцінювався наступним чином: 0 = відсутній; 1 = легкий; 2 = важкий. Кірка та рубцювання в післяопераційній порожнині оцінювалися наступним чином: 0 = відсутні; 1 = легкі; і 2 = важкі; ці результати оцінювалися для правої та лівої носової порожнини окремо.
Активна передня ринометрія та акустична ринометрія
Активна передня ринометрія (AAR) та акустична ринометрія (AR) були проведені за допомогою пристрою SRE 2000 (Rhinometrics, Lynge, Данія), який дозволив виконати обидва тести: AAR об'єктивно оцінював як носовий опір, так і носовий повітряний потік, тоді як AR відображав геометрію та об'єм всієї носової порожнини.
Мультирізьбова комп'ютерна томографія Мультирізьбова комп'ютерна томографія (КТ) носа та придаткових пазух була проведена до та через 6 місяців після FESS у всіх пацієнтів. Було отримано зрізи товщиною півсантиметра (5 мм) в аксіальній та корональній площинах. Ступінь затемнення конкретної пазухи (0-2) та остіометального комплексу (0 = цілий, 2 = закритий) були розраховані за допомогою системи оцінювання Лунда-Маккея.
Еозинофільний катіонний білок
Вміст еозинофільного катіонного білка (ECP) у носовому виділенні вимірювався за допомогою набору для збору з даними, отриманими автоматичним хемілюмінесцентним аналізатором IMMULITE 1000 (Siemens Healthcare Diagnostics Inc, NY, США). Для збору слизу в середній носовий хід на 20 хвилин була введена частина стерильного поролонового спонжа розміром 20 × 20 × 5 мм. Після видалення спонж був поміщений у пробірку об'ємом 10 мл і центрифугований протягом 3 хвилин на швидкості 4000 об/хв, що дозволило зібрати 0.2 до 1.0 мл слизу для подальшого аналізу. Чутливість тесту становила 0.2 нг/мл.
Мікробіологічне тестування
Носовий мазок для мікробіологічного тестування був взятий з середнього носового ходи перед FESS та на всіх післяопераційних візитах. Культура та тестування чутливості (резистентності) проводилися за допомогою бактеріологічного аналізатора Walk Away-40 (Dade Behring, Марбург, Німеччина) та методу дифузії дисків (диски Becton Dickinson з кларитроміцином, США). Результати оцінювалися відповідно до рекомендацій CLSI (інститут клінічних і лабораторних стандартів).
Тести на шкірні алергени
Тести на шкірні алергени для внутрішніх та зовнішніх алергенів проводилися у всіх пацієнтів за стандартними методами.
Фінальна оцінка результатів лікування
Фінальна оцінка результатів лікування проводилася за змінами оцінок EAS та Lund-Mackay CT через 24 тижні після FESS.
Статистичний аналіз
Після консультації з медичним статистиком отримані результати були внесені в комп'ютеризовану базу даних та оброблені за допомогою статистичного програмного пакету SPSS версії 17.0 для Windows. Тести Вілкоксона з підписаними рангами були проведені для оцінки ефектів лікування в різні моменти часу. Значення були представлені як середні ± стандартні відхилення. Зміни всередині та між групами вважалися статистично значущими, коли p значення були <0.05.
Результати
Одинадцять пацієнтів були виключені з дослідження з різних причин: 8 пацієнтів у групі 2 (антибіотики протягом 12 тижнів) були відкликані. Один пацієнт відчув біль у животі після початку терапії кларитроміцином; другого пацієнта відкликали через нічні жахи, які почалися через 3 дні після початку лікування кларитроміцином. Одна жінка з тієї ж групи зазнала загострення ерозивного дуоденіту через 2 місяці після вступу і була відкликана, тоді як 5 інших були відкликані через невиконання рекомендацій. Одна жінка з групи 3 (контроль без антибіотиків) була виключена через вагітність, а 2 інших у цій групі були відкликані через невиконання рекомендацій. Таким чином, 55 пацієнтів завершили дослідження, і на останньому візиті всі 22 пацієнти в групі 1 (антибіотики протягом 24 тижнів) завершили дослідження, 14 пацієнтів залишилися в групі 2 (антибіотики протягом 12 тижнів), а 19 пацієнтів залишилися в групі 3 (контроль без антибіотиків).
Тридцять п'ять пацієнтів мали БА, і 27 з цих 35 пацієнтів мали AERD. Атопія була підтверджена шкірними пробами на алергію у 19 з 66 початкових пацієнтів. Не було значних відмінностей між 3 групами щодо віку, статі, наявності атопії, тяжкості захворювання та кількості попередніх операцій, а також усіх інших початкових параметрів, які ми досліджували. Початкові характеристики кожної з 3 лікувальних груп: група 1 (антибіотики протягом 24 тижнів), група 2 (антибіотики протягом 12 тижнів) та група 3 (контроль без антибіотиків) представлені в Таблиці 1.
Результати лікування були кращими для пацієнтів, які завершили курс тривалого лікування кларитроміцином у групі 1 (антибіотики протягом 24 тижнів) та групі 2 (антибіотики протягом 12 тижнів) у порівнянні з пацієнтами в групі 3 (контроль без антибіотиків).
Статистично значущі відмінності (p < 0.05) були отримані для всіх параметрів (але не на кожному візиті) між групами досліджуваних препаратів 1 та 2 і групою 3 (контроль без антибіотиків), єдиним винятком були VAS та AR, де статистично значущі дані не були отримані.
SNOT-20
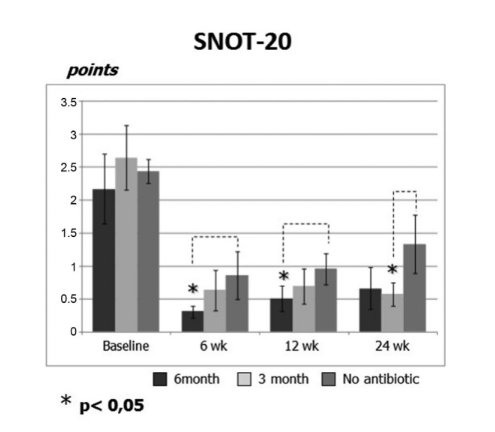
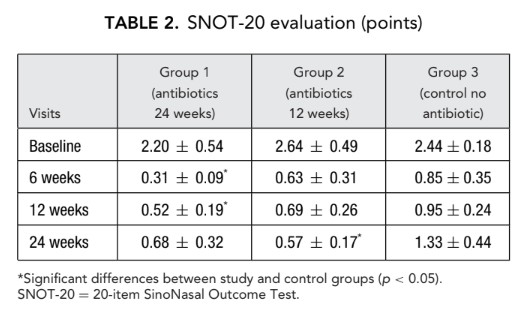
Початкові бали SNOT-20 становили 2.20 ± 0.54 у групі 1 (антибіотики протягом 24 тижнів), 2.64 ± 0.49 у групі 2 (антибіотики протягом 12 тижнів) та 2.44 ± 0.18 у групі 3 (контроль без антибіотиків). Після FESS якість життя покращилася, і тяжкість симптомів риносинуситу зменшилася у всіх учасників дослідження. Однак бали SNOT-20 пацієнтів у групі 1 (антибіотики протягом 24 тижнів) на візитах через 6 тижнів та 12 тижнів після FESS (0.31 ± 0.09 та 0.52 ± 0.19 відповідно), а також бали SNOT-20 пацієнтів у групі 2 (антибіотики протягом 12 тижнів) на фінальному візиті (0.57 ± 0.17) були значно кращими, ніж у пацієнтів групи 3 (контроль без антибіотиків) на тих же візитах; 0.85 ± 0.35, 0.95 ± 0.24 та 1.33 ± 0.44 відповідно (p < 0.05), (Рис. 2, Таблиця 2).
Оцінки VAS
Відмінності в змінах оцінок VAS між досліджуваними групами (групи 1 і 2) та контрольною групою (група 3 без антибіотиків) не досягли статистичної значущості (Таблиця 3).
Ольфакторний тест
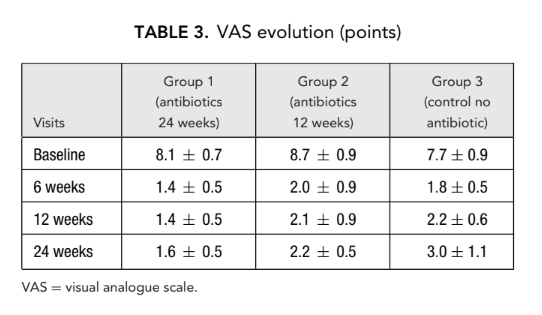
Тяжка ольфакторна дисфункція була виявлена у всіх учасників дослідження перед FESS. Повна або майже повна втрата здатності розпізнавати запахи (аносмія) спостерігалася, коли ніс був повністю заблокований дифузними носовими поліпами. Жоден з цих 66 пацієнтів не отримував системні стероїди перед FESS. На другому та третьому візитах ольфакція значно покращилася у всіх 3 групах пацієнтів, хоча жоден з пацієнтів не досяг нормальних значень. Статистично значуща різниця в середній кількості правильних відповідей (p < 0.05) була виявлена лише між групою 1 (антибіотики протягом 24 тижнів) (9.5 ± 1.3) та групою 3 (контроль без антибіотиків) (4.4 ± 0.5) на другому візиті через 6 тижнів після операції (Таблиця 4).
Час транзиту сахарину
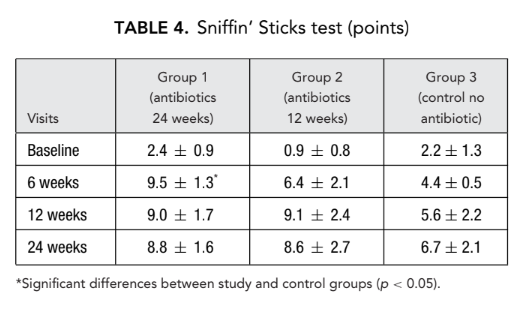
Аналогічно, через 12 тижнів після операції було виявлено значне зменшення (покращення) часу транзиту сахарину в групі 1 (антибіотики протягом 24 тижнів) (13.6 ± 3.0 хвилин) порівняно з групою 3 (контроль без антибіотиків) (21.0 ± 4.1 хвилин) (Таблиця 5).
АР і ААР
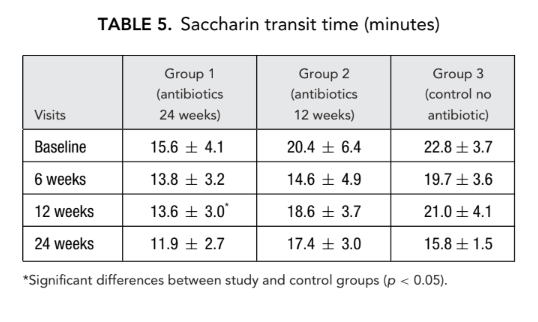
Не було значної різниці в параметрах акустичної ринометрії (об'єм носової порожнини, мінімальна перетинна площа) між усіма групами. Однак, носовий опір, виміряний за допомогою передньої риноманометрії в групі 1 (антибіотики протягом 24 тижнів) та групі 2 (антибіотики протягом 12 тижнів), був значно нижчим (краще дихання) (0.23 ± 0.02 та 0.19 ± 0.02 Па/см3/секунду відповідно) ніж у групі 3 (контроль без антибіотиків) (1.94 ± 1.50 Па/см3/секунду) на кінцевому етапі (Таблиці 6 і 7).
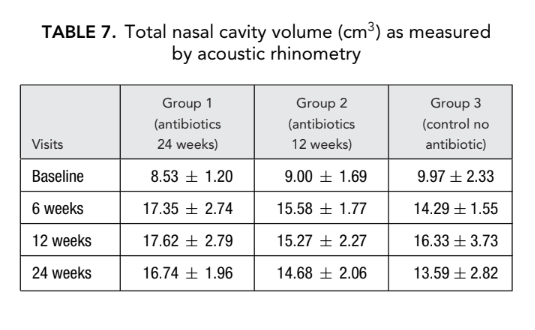
КТ-сканування
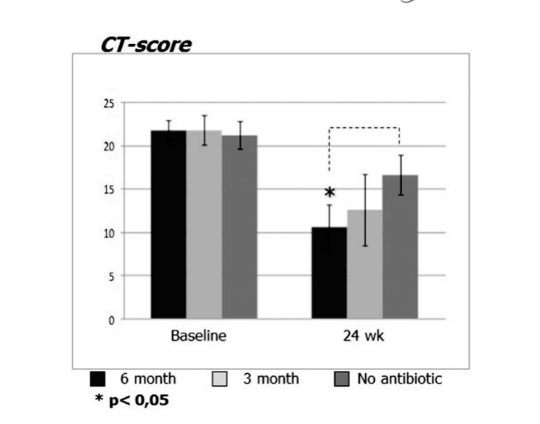
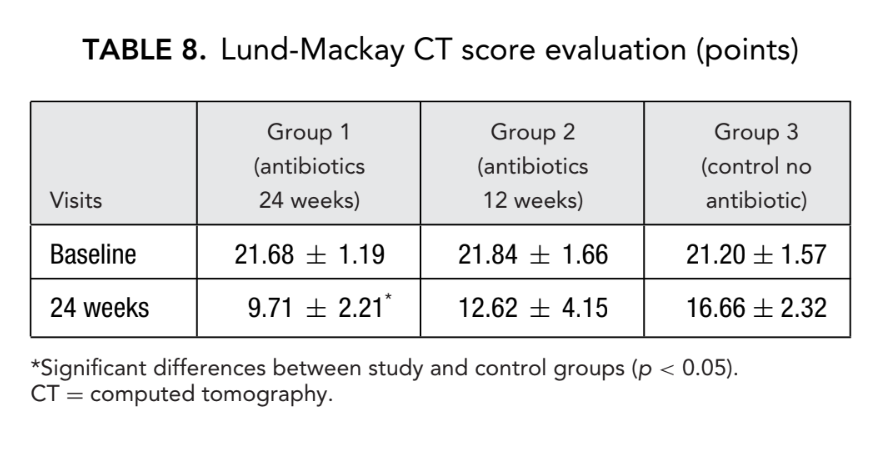
Перед початком лікування середні значення за шкалою Лунд-Маккай у першій, другій та третій групах пацієнтів не відрізнялися суттєво, становлячи 21.68 ± 1.20, 21.84 ± 1.66 та 21.2 ± 1.57 відповідно. Середній бал затемнення придаткових пазух на КТ-скануваннях різко знизився (покращився) у всіх 3 групах через 6 місяців після FESS. Однак суттєва різниця спостерігалася лише між групою 1 (антибіотики протягом 24 тижнів) зі середнім балом 9.71 ± 2.21 та групою 3 (контроль без антибіотиків) зі середнім балом 16.66 ± 2.32 (p < 0.05). У групі 2 (антибіотики протягом 12 тижнів) середній бал становив 12.62 ± 4.15, але ця різниця не досягла статистичної значущості (Рис. 3, Таблиця 8).
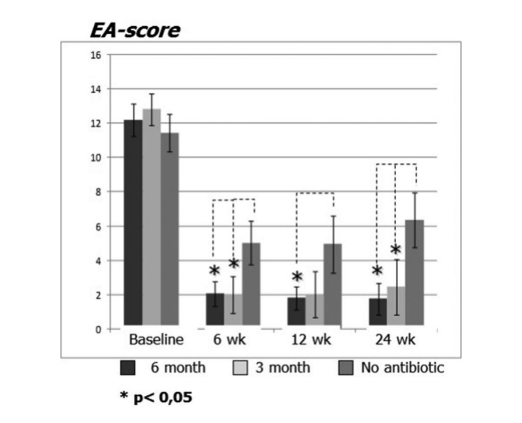
Насальна ендоскопія
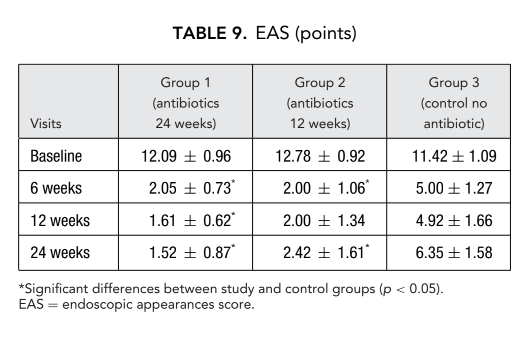
Пацієнти, які отримували терапію кларитроміцином у групі 1 (антибіотики протягом 24 тижнів) та групі 2 (антибіотики протягом 12 тижнів), показали кращий EAS на кожному візиті в порівнянні з пацієнтами в групі 3, які не приймали антибіотики (Рис. 4, Таблиця 9). Через двадцять чотири тижні після операції середні EAS становили: 1.52 ± 0.87 у групі 1 (антибіотики протягом 24 тижнів) та 2.42 ± 1.61 у групі 2 (антибіотики протягом 12 тижнів), і ці результати були значно кращими, ніж у групі 3 (контроль без антибіотиків) 6.35 ± 1.58 (p < 0.05) (Рис. 4, Таблиця 9). Один з найвражаючих випадків, що демонструє ефективність післяопераційної тривалої терапії макролідами, представлений на Рисунку 5.
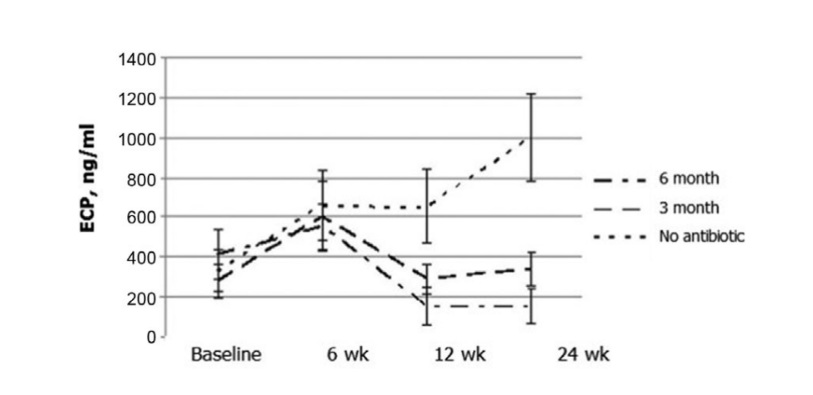
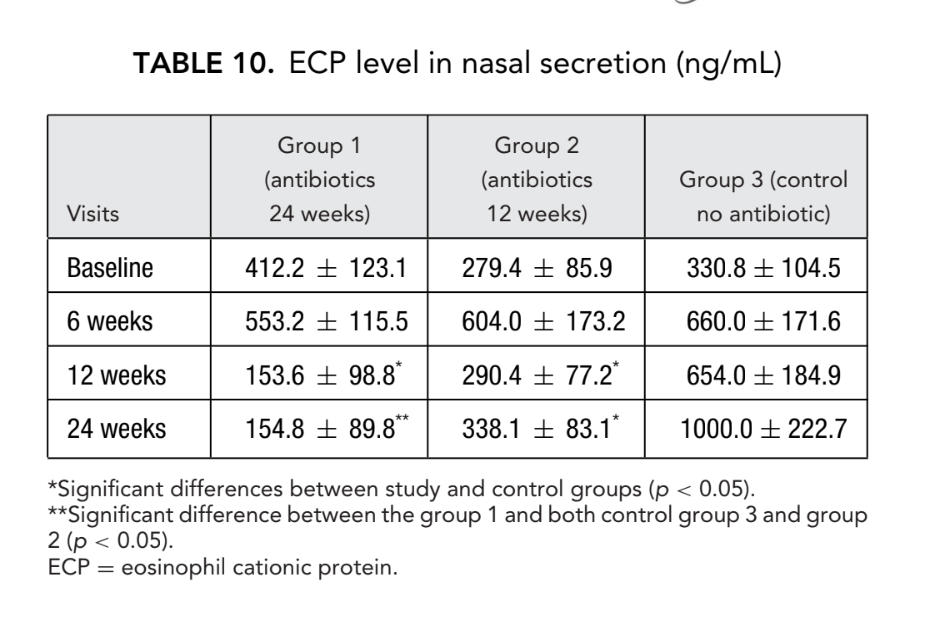
Найбільш вражаючі результати були отримані під час оцінки концентрації ECP після операції. Перед хірургічним втручанням медіанні значення концентрацій ECP у всіх 3 групах пацієнтів не відрізнялися суттєво, становлячи 412.2 ± 123.1, 279.4 ± 85.9 та 330.8 ± 104.5 відповідно. Через шість тижнів після операції рівень ECP у носовому виділенні зріс у всіх пацієнтів дослідження, становлячи 553.2 ± 115.5, 604.0 ± 173.2 та 660.0 ± 171.6 нг/мл у групах 1, 2 та 3 відповідно. Через дванадцять тижнів після FESS було чітко зафіксовано значне зниження рівня ECP у носовому виділенні в групі 1 (антибіотики протягом 24 тижнів): 153.6 ± 98.8 нг/мл (p = 0.028), та в групі 2 (антибіотики протягом 12 тижнів): 290.4 ± 77.2 нг/мл (p = 0.036). Рівень ECP у носовому виділенні у пацієнтів групи 3 (контроль без антибіотиків) суттєво не змінився і становив 654.0 ± 184.9 нг/мл (p = 0.25). Тільки в групі 1 (антибіотики протягом 24 тижнів) концентрація ECP залишалася на тому ж низькому рівні (154.8 ± 89.8 нг/мл) на 24 тижні. У групі 2 (антибіотики протягом 12 тижнів) спостерігалося незначне збільшення рівнів ECP до 338.1 ± 83.1 нг/мл (p = 0.084), коли цих пацієнтів досліджували на 24 тижні (3 місяці після припинення антибіотиків); однак, з p значенням 0.084, різниця не була статистично значущою. Середній рівень ECP у носовому виділенні в групі 3 (контроль без антибіотиків) суттєво зріс до 1000.0 ± 222.7 нг/мл (p = 0.041) (Рис. 6, Таблиця 10).
Важливо зазначити, що рівень ECP у пацієнтів, які отримували макроліди протягом повних 6 місяців (група 1), був значно нижчим, ніж у пацієнтів групи 2, які припинили антибіотикотерапію після 3 місяців лікування.
Побічні ефекти були рідкісними, і припинення антибіотикотерапії вимагалося лише у 3 пацієнтів. Рівні печінкових ферментів (аланінамінотрансфераза [ALT], аспартатамінотрансфераза [AST] та лужна фосфатаза [ALP]) залишалися нормальними у всіх пацієнтів.
Мікробіологічне дослідження мазків з середнього носового ходу виявило широкий спектр бактерій. Найпоширенішим організмом був Staphylococcus aureus (30% пацієнтів), за ним слідували Staphylococcus epidermidis (25%), Streptococcus haemolyticus (11%), Escherichia coli (9%), Pseudomonas aeruginosa (6%) та Enterobacter aerogenes (6%). Бактеріальний спектр значно змінився після операції, але співвідношення між штамами, стійкими до кларитроміцину (13%), та чутливими до кларитроміцину (87%) залишалося незмінним. На завершення дослідження деякі штами бактерій, чутливі до макролідів, набули стійкості до кларитроміцину. Цікаво, що відбулося і протилежне явище; спочатку деякі штами бактерій, стійкі до макролідів, були замінені деякими штамами бактерій, чутливими до макролідів. Загалом, кількість штамів, стійких до кларитроміцину (13%), залишалася сталою протягом усього курсу тривалої терапії кларитроміцином.
Обговорення
Сучасні дані підтримують ідею, що тривале лікування макролідами в низьких дозах є ефективним, коли його застосовують для лікування стійких до терапії неатопічних пацієнтів з хронічним риносинуситом (ХРС), у яких топічні назальні стероїди та сольові промивання не змогли контролювати симптоми. У пацієнтів з атопічним ХРС з поліпами носа терапія макролідами не була корисною.
У більш новій літературі повідомляється, що тривала терапія макролідами в низьких дозах є ефективною при ХРС, включаючи тих пацієнтів, у яких підвищені рівні імуноглобуліну E (IgE) та бронхіальної астми (БА). Недавнє проспективне дослідження продемонструвало, що 8-тижневий курс терапії кларитроміцином був однаково ефективним як для атопічних, так і для неатопічних пацієнтів з поліпозом носа. У ретроспективному дослідженні пацієнти з ХРС та атопією добре реагували на тривале лікування макролідами, тоді як пацієнти, які курили, мали найгірші результати лікування.
Результати нашого дослідження продемонстрували, що тривала терапія макролідами в низьких дозах запобігає ранньому рецидиву поліпів носа після функціональної ендоскопічної синусної хірургії (ФЕСХ), включаючи пацієнтів з атопією та БА. Існувала чітка кореляція між атопією та тяжкістю захворювання, оскільки наші атопічні пацієнти мали вищі оцінки за шкалою VAS (коефіцієнт кореляції Спірмена 0.332; p = 0.01). Наявність атопії корелювала з вищими рівнями ECP у носовому виділенні (0.834; p = 0.01). Ці результати свідчать про те, що тяжкість симптомів безпосередньо пов'язана з інтенсивністю еозинофільного запалення. На жаль, ми не досліджували загальні рівні IgE у більшості пацієнтів; тому аналіз підгрупи тих пацієнтів з низькими рівнями IgE не був можливим.
Найбільш вражаючим результатом дослідження було змінення рівнів ECP у носових виділеннях після FESS та під час післяопераційного періоду з терапією макролідами. У групі 3 (контроль без антибіотиків) ми відзначили майже тричі збільшення середнього рівня ECP через 6 тижнів після операції. Це спостереження підвищеного рівня ECP після FESS у пацієнтів групи 3 відображає загострення еозинофільного запалення, викликаного хірургічним втручанням, яке не могло бути адекватно контрольоване лише за допомогою інтраназальних топічних стероїдів. З іншого боку, у лікувальних групах 1 (антибіотики протягом 24 тижнів) та 2 (антибіотики протягом 12 тижнів) спостерігалося поступове зниження рівнів ECP з тривалою терапією низькими дозами кларитроміцину, що відображає контроль та зменшення еозинофільного запалення.
Однією з цілей цієї роботи було вивчення ефективності більш тривалого (6 місяців) курсу лікування в порівнянні з відносно коротким (3 місяці) курсом терапії низькими дозами макролідів. Дані вказують на певну користь від більш тривалого курсу антибіотиків, але різниця між групою 1 (антибіотик 24 тижні) та групою 2 (антибіотик протягом 12 тижнів) не досягла статистичної значущості у більшості пацієнтів. Тим не менш, є деякі докази того, що більш тривалий курс лікування групи 1 (антибіотики 24 тижні) виявляється більш ефективним, ніж коротший курс, спостережуваний у групі 2 (антибіотики протягом 12 тижнів).
Результати КТ для групи 1 (антибіотики 24 тижні) становили 9.71 ± 2.21, що було значно нижче, ніж у групі 3 (контроль без антибіотиків), з показниками 16.66 ± 2.32 на кінцевому етапі. Різниця між групою 2 (антибіотики 12 тижнів) та групою 3 (контроль без антибіотиків) не досягла статистичної значущості (Таблиця 8). Існували значні відмінності в середніх рівнях ECP у групах
1 та 2 на кінцевому етапі, що непрямо підтверджує, що 6-місячний курс антибіотиків знижує еозинофільне запалення, тим самим запобігаючи ранньому рецидиву носових поліпів. Очевидно, що використання пероральних стероїдів, безумовно, вважається стандартом лікування в Сполучених Штатах та деяких інших західних країнах, особливо в умовах післяопераційного загострення еозинофільного запалення. Однак у таких країнах, як Росія, де системна терапія кортикостероїдами при CRSwNP є вкрай рідкісною, тривала терапія макролідами може бути альтернативним варіантом, оскільки вона має менший ризик системних побічних ефектів.
Ми не виявили збільшення культур бактерій, стійких до макролідів, з середнього носового ходу після тривалої терапії кларитроміцином у низькій дозі 250 мг/день, що узгоджується з попередніми дослідженнями, які також не виявили стійких мікроорганізмів після тривалої терапії азитроміцином та еритроміцином. Звичайно, ризик розвитку штамів бактерій, стійких до антибіотиків, викликаних тривалою терапією макролідами, завжди можливий.
Хоча в нашому протоколі не було передбачено плацебо-групу, і пацієнти не були сліпими під час отримання додаткової терапії, ми оцінили 6 різних об'єктивних методів у всіх 3 групах дослідження. Усі дослідники були сліпими під час оцінки та градації результатів назальної ендоскопії, КТ-сканувань та всіх інших тестів. У майбутньому буде необхідно провести рандомізоване подвійне сліпе плацебо-контрольоване дослідження з великою вибіркою, щоб визначити ефективність тривалої терапії макролідами, особливо в запобіганні рецидиву носових поліпів після FESS. Крім того, таке дослідження могло б, сподіваємося, передбачити, які пацієнти з CRSwNP отримають користь від тривалої антибіотикотерапії та чи збільшує це лікування ризик виникнення значної бактеріальної резистентності.
Висновок
Результати цього дослідження продемонстрували ефективність та відносну безпеку тривалої (6 місяців) низькодозової (250 мг/день) терапії макролідами (кларитроміцином) для запобігання ранньому рецидиву носових поліпів у пацієнтів з CRSwNP після FESS. Незважаючи на обмежені клінічні дані, наші докази свідчать про те, що пацієнти з рецидивуючою CRSwNP (хірургічні невдачі) заслуговують на спробу лікування кларитроміцином у низькій дозі (250 мг щодня протягом 3-6 місяців), яке може бути розпочато відразу після FESS разом з підтримуючою терапією за допомогою топічних назальних стероїдів.
Посилання
- Хедман Й., Капріо Й., Пусса Т., Ніємінен М.М. Поширеність астми, непереносимості аспірину, носових поліпів та хронічної обструктивної хвороби легень у популяційних дослідженнях. Int J Epidemiol. 1999;28:717–722.
- Сеттіпане Г. Епідеміологія носових поліпів. У: Сеттіпане Г., Лунд В.Й., Бернштейн Дж.М., Тос М., ред. Носові поліпи: епідеміологія, патогенез та лікування. Провіденс, РІ: Oceanside Publications; 1997:17–24.
- Огіно С., Харада Т., Окавачи І., Іріфуне М., Мацунага Т., Наґано Т. Аспірин-індукована астма та носові поліпи. Acta Otolaryngol Suppl. 1986;430:21–27.
- Фоккенс В., Лунд В., Муллол Дж. Європейська позиційна стаття з риносинуситу та носових поліпів. Європейська позиційна стаття з риносинуситу та носових поліпів 2007. Rhinol Suppl. 2007;(20):1–136.
- Десроазьє М.Й., Кілті С.Й. Альтернативи лікування хронічного риносинуситу, що триває після ESS: що робити, коли антибіотики, стероїди та хірургія не допомагають. Rhinology. 2008;46:3–14.
- Кудо С., Уетаке Т., Хагівара К. та ін. Клінічний ефект низькодозової, тривалої хіміотерапії еритроміцином при дифузному панбронхіоліті (англійський анотація). Jpn J Thorac Dis. 1984;25:632–642.
- Кудо С., Асуму А., Ямамото М., Ізумі Т., Андо М. Поліпшення виживаності у пацієнтів з дифузним панбронхіолітом, які отримували лікування низькодозовим еритроміцином. Am J Respir Crit Care Med. 1998;157:1829–1832.
- Цервін А., Уоллворк Б. Терапія макролідами при хронічному риносинуситі. Rhinology. 2007;45:259–267.
- Цервін А., Уоллворк Б., Макай-Сім А., Коман В.Б., Грейфф Л. Вплив тривалої терапії кларитроміцином на маркери запалення в рідині для промивання при хронічному риносинуситі. Clin Physiol Funct Imaging. 2009;29:136–142.
- Стьярне П., Оллсон П., Аленіус М. Використання мометазону фуроату для запобігання рецидиву поліпів після ендоскопічної синусової хірургії. Arch Otolaryngol Head Neck Surg. 2009;135:296–302.
- Піккірілло Дж., Мерітт М., Річардс М. Психометрична та клініметрична валідність 20-пунктового тесту результатів синусо-носової функції (SNOT-20). Otolaryngol Head Neck Surg. 2001;126:41–47.
- Гуммель Т., Кобаль Г., Гудзіол Х., Макай-Сім А. Нормативні дані для "Sniffin’ Sticks", включаючи тести на ідентифікацію запахів, дискримінацію запахів та пороги нюху: оновлення на основі групи з понад 3000 осіб. Eur Arch Otorhinolaryngol. 2007;264:237–243.
- Лунд В.Й., Макай І.С. Стадіювання при риносинуситі. Rhinology. 1993;31:183–184.
- Фоккенс В.Й., Лунд В.Й., Муллол Дж. та ін. Європейська позиційна стаття з риносинуситу та носових поліпів 2012.
- Rhinol Suppl. 2012;(23):3 с. перед змістом, 1–298.
- Уоллворк Б., Коман В., Макай-Сім А., Грейфф Л., Цервін А. Подвійне сліпе, рандомізоване, плацебо-контрольоване дослідження макроліда в лікуванні хронічного риносинуситу. Laryngoscope. 2006;116:189–193.
- Харуна С., Шімада Ч., Озава М., Фукамі С., Моріяма Х. Дослідження поганих відповідей на тривале, низькодозове введення макролідів при хронічному синуситі. Rhinology. 2009;47:66–71.
- Віделер В.Й., Бадія Л., Харві Р.Дж. та ін. Відсутність ефективності тривалої, низькодозової азитроміцину при хронічному риносинуситі: рандомізоване контрольоване дослідження. Allergy. 2011;66:1457–1468.
- Перич А., Войводич Д., Балетич Н., Перич А., Мільянович О. Вплив алергії на імуномодулюючі та клінічні ефекти тривалої низькодозової терапії макролідами при носовій поліпозі. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2010;154:327–334.
- Віделер В.Й., ван Хі С.М., Рейнартц Ц., Георгала Ф.В., Мейлен К., Фоккенс В.Й. Тривалі, низькодозові антибіотики при рецидивуючому хронічному риносинуситі: ретроспективний аналіз. Rhinology. 2012;50:45–55.
- Цервін А., Кальм О., Сандкулл П., Ліндберг С. Однорічне лікування низькодозовим еритроміцином при стійкому хронічному синуситі після синусової хірургії: клінічний результат та вплив на мукоциліарні параметри та назальний оксид азоту. Otolaryngol Head Neck Surg. 2002;126:481–489.
