Біоінженерні імплантати диска скронево-нижньощелепного суглоба: Протокол дослідження для двофазного експлораційного рандомізованого доклінічного пілотного випробування на 18 чорних меріно-овцах (TEMPOJIMS)
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Передумови: Преклінічні випробування є необхідними для тестування ефективних варіантів заміни диска скронево-нижньощелепного суглоба (СНЩС). Сучасна відсутність ідеального лікування для пацієнтів з важкими розладами СНЩС може бути пов'язана з труднощами, що стосуються відповідного дизайну дослідження для проведення преклінічних випробувань у сфері СНЩС. Ці труднощі можуть бути пов'язані з використанням гетерогенних моделей тварин, використанням контралатерального СНЩС як контролю, відсутністю строгих рандомізованих контрольованих преклінічних випробувань з закритими оцінювачами результатів та труднощами, що стосуються мультидисциплінарних команд.
Мета: Це дослідження має на меті розробити новий, відтворюваний та ефективний дизайн дослідження для преклінічних досліджень у сфері СНЩС, отримуючи строгі дані, пов'язані з (1) визначенням впливу двосторонньої дисектомії у чорних меріно, (2) визначенням впливу двосторонньої дископексії у чорних меріно, та (3) визначенням впливу трьох різних біоінженерних дисків СНЩС у чорних меріно.
Методи: Запропоновано двофазне експлораційне рандомізоване контрольоване доклінічне дослідження з закритими результатами. На першій фазі дев'ять овець рандомізують на три різні хірургічні двосторонні процедури: двостороння дисектомія, двостороння дископексія та імітаційна операція. На другій фазі дев'ять овець рандомізують для двостороннього тестування трьох різних біоінженерних імплантатів дисків для скронево-нижньощелепного суглоба (СНЩС). Основним результатом є гістологічна градація СНЩС. Вторинними результатами є зміни візуалізації, абсолютний жувальний час, час жування на цикл, кінетика жування, площа жування та вага овець.
Результати: Попередні доклінічні дослідження в цій галузі використовували контралатеральну неоперативну сторону як контроль, різні моделі тварин, починаючи з мишей і закінчуючи собачою моделлю, з нерендомізованими, незасліпленими та неконтрольованими дизайнами досліджень і обмеженими показниками результатів. Основною метою цього експлораційного доклінічного протоколу є встановлення нового стандарту для майбутніх доклінічних випробувань у оро-щелепно-лицевій хірургії, зокрема в галузі СНЩС, шляхом пропозиції суворого дизайну на чорних меріносових вівцях. Автори також мають намір перевірити здійсненість пілотних результатів. Автори очікують підвищити якість подальших досліджень у цій галузі та просунутися в майбутніх варіантах лікування для пацієнтів, які проходять хірургію з приводу заміни диска СНЩС.
Висновки: Дослідження розпочато, але ще зарано надавати результати чи висновки.
Вступ
Темпоромандибулярний суглоб (ТМС) є найчастіше використовуваним суглобом в людському тілі. ТМС відкривається і закривається 1500 до 2000 разів на день і є важливим для щоденних функцій рота, таких як жування, мова, ковтання, позіхання та хропіння, що вимагає особливої обов'язкової синергії обох суглобових сторін. Диск ТМС є важливим компонентом нормального ТМС і має такі функції: (1) розподіляє внутрішньосуглобове навантаження, (2) стабілізує суглоби під час трансляції, і (3) зменшує зношування суглобової поверхні. Більшість розладів ТМС (РТМС) успішно лікуються зворотними, консервативними та низькотехнологічними методами, такими як освіта та консультування, терапевтичні вправи, терапія шинами та фармакотерапія.
Коли диск скронево-нижньощелепного суглоба (СНЩС) зміщений, деформований або пошкоджений, це може викликати серйозні внутрішні патологічні процеси та/або остеоартрит. Наразі пацієнти, які страждають від важкого ТМД, мають обмежені перевірені варіанти лікування. Більшість хірургічних методів, таких як дисектомія СНЩС, не відновлюють структурні або біологічні властивості артикуляції та диска. Ця процедура може бути не ідеальною, оскільки СНЩС залишається без важливої функціональної структури. Різноманітні міжпозиційні матеріали використовувалися для заміни видалених дисків, включаючи синтетичні матеріали, виготовлені з силікону, тефлону, політетрафторетилену та біологічні міжпозиційні трансплантати, взяті з різних анатомічних ділянок. Ці міжпозиційні матеріали не враховують анатомію та біохімічні і біомеханічні характеристики природного диска СНЩС, і деякі з них були пов'язані з серйозними ускладненнями для пацієнтів. Наприкінці 1980-х років Proplast/Teflon СНЩС (синтетичний міжпозиційний імплант) виявилися шкідливими для багатьох пацієнтів. Розпад матеріалу, ймовірно, викликаний високими біомеханічними силами СНЩС, призвів до утворення фрагментованих частинок, що викликали імунну реакцію на чужорідне тіло, яка спричинила проблеми, що варіювали від важкої шкірної запальної реакції в передвушній та щічній областях до важкої дегенеративної хвороби суглоба з перфорацією в середню черепну ямку. Результатом стала драматична клінічна картина невдач для цих імплантів. У грудні 1991 року Бюлетень Управління з контролю за продуктами і ліками США рекомендував термінове видалення всіх попередніх імплантів Proplast/Teflon СНЩС через механічні збої, багато з яких призвели до прогресуючої деградації кістки. На семінарі 1992 року Американська академія стоматологічної та щелепно-лицевої хірургії наказала припинити використання Proplast/Teflon.
Відсутність ефективних варіантів заміни диска скронево-нижньощелепного суглоба може бути пов'язана з труднощами в трансляції даних з тварин до клінічної практики у людей. Ці обмеження, ймовірно, пов'язані з:
використанням гетерогенних тваринних моделей з суперечливими результатами, можливо, через змінну анатомію та навантаження в суглобі між видами;
використанням контралатерального ТМЖ як контролю, що може бути пов'язано з перевантаженням контралатеральної сторони;
біоматеріали, що використовуються для заміни диска, не враховують морфологічні та біомеханічні характеристики природного диска;
відсутність рандомізованих контрольованих випробувань з осліпленням оцінювачів результатів; та
брак мультидисциплінарних команд, залучених до проекту.
Доклінічні дослідження повинні сприяти ефективному перенесенню знань у практику. Раніше згадані аспекти можуть обмежувати ефективне перенесення якісних наукових знань у клінічну практику, і це може створювати потенційні проблеми для пацієнтів, клініцистів та наукового прогресу.
Сучасна відсутність успішних варіантів заміни диска скронево-нижньощелепного суглоба (ТМД) залишається серйозною проблемою для громадського здоров'я. За останнє десятиліття мало що змінилося в дизайнах досліджень для вивчення ТМД, а лікування пацієнтів з важкими ТМД залишається суперечливим. Основною метою дослідження матеріалів для міжсуглобового вставлення скронево-нижньощелепного суглоба (TEMPOJIMS) є розробка нового, відтворювального та ефективного дизайну дослідження для доклінічних досліджень у галузі ТМД. Другою метою є прогрес у біоінженерії та регенеративній медицині, оцінюючи переваги біоінженерного імплантату ТМД для заміни пошкодженого природного диска ТМД. Це доклінічне експлораційне дослідження поділено на дві фази. Фаза 1 цього дослідження є сліпим рандомізованим доклінічним випробуванням, яке має на меті дослідити, чи зазнає ТМД значної травми під час двосторонньої дисектомії, двосторонньої дископексії та імітаційної операції. Намір Фази 2 полягає в оцінці безпеки та ефективності трьох різних біоінженерних імплантатів ТМД, використовуючи той самий суворий метод, що й у фазі 1.
Методи
Дизайн дослідження
TEMPOJIMS - це двофазне експлораційне рандомізоване контрольоване доклінічне дослідження, заплановане для збору попередньої інформації для (1) оцінки нового дизайну дослідження для вивчення ТМЖ; (2) оцінки моделі тварин чорних меріносів для вивчення ТМЖ; (3) оцінки поведінки ТМЖ під час двостороннього хірургічного втручання (дискектомія та дископексія) з використанням гістологічного первинного результату (мікроскопічне оцінювання руйнівних змін у ТМЖ за допомогою модифікованої системи оцінювання Манкіна), вторинного зображувального результату (оцінювання зображення ТМЖ); (4) тестування застосовності пілотних вторинних результатів, переважно для кінетики жуйних; та (5) отримання базового рівня для інтерпретації результатів біоінженерних імплантатів диска ТМЖ. Фаза II спрямована на тестування безпеки та ефективності трьох різних двосторонніх біоінженерних імплантатів диска ТМЖ (Рисунок 1). Оцінювачі результатів та аналітики не знають про хірургічні оцінки.
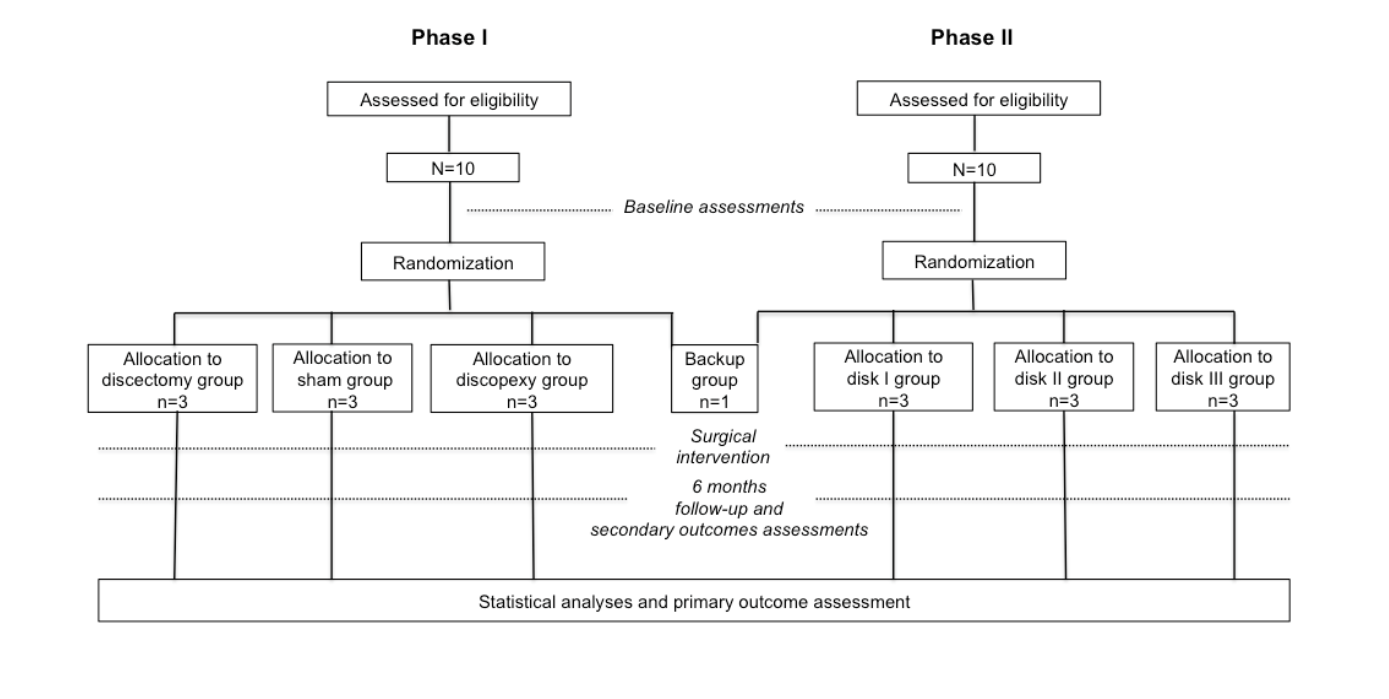
Основні установи, залучені до цього дослідження, це (1) Медичний факультет Лісабона для розробки дослідження, координації та статистичного аналізу; (2) Міждисциплінарний центр досліджень у галузі охорони здоров'я тварин на факультеті ветеринарної медицини для гістологічної підготовки та ветеринарної підтримки всіх тварин; (3) Центр швидкої та стійкої розробки продуктів для біоінженерних імплантатів-дисків (диски I та II); (4) Біоінженерія, хірургія, хімічна інженерія, механічна інженерія та матеріалознавство, Університет Піттсбурга, для біоінженерних імплантатів-дисків (диск III); (5) Кафедра оральної та щелепно-лицевої хірургії, Університетська лікарня Інфанта Крістіна, Бадахос, Іспанія, для хірургічної підтримки; (6) Інститут досліджень кісток і суглобів-Північний Сіднейський місцевий охорони здоров'я-Сіднейська медична школа Північного, Університет Сіднея, Австралія, для гістологічного аналізу; та (7) Відділ радіології лікарні Санта-Марія, Лісабон, Португалія, для аналізу зображень.
Модель тварини
Для досліджень TMJ використовували різноманітні штами/породи овець. Щоб зменшити біологічну варіативність, автори рекомендували чорних меріносових овець як модель тварини для проведення дослідження. Як рекомендовано, автори запропонували використовувати “скелетно зрілі вівці” віком ≥2 роки. Критерії включення: сертифіковані чорні меріносові вівці, дорослі (вік 2-5 років), самки та в доброму стані здоров'я (ветеринарний огляд проводиться на всіх тваринах). Щодо етичних міркувань стосовно тварин, дизайн дослідження був затверджений Португальською національною службою охорони здоров'я тварин з номером 026618. Дизайн та організація дослідження відповідають рекомендаціям Animal Research: Reporting of In Vivo Experiments (ARRIVE).
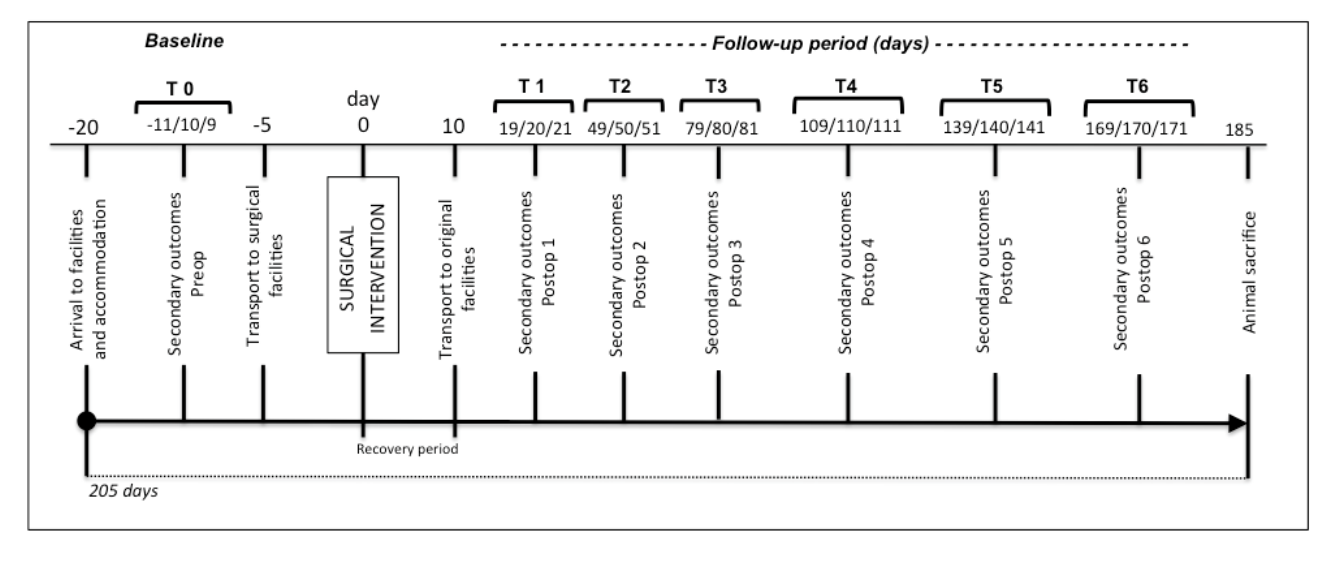
Оцінка базового рівня та подальшого спостереження
Оцінка базового рівня та подальшого спостереження викладена в певні часові моменти (Рисунок 2). Пілотні вторинні результати та вага вимірюються на 11, 10 та 9 дні до операції (деталі щодо вторинних результатів наведені в заходах результатів). Транспортування до хірургічних закладів проводиться за 5 днів до операції, щоб уникнути стресу у тварин та дозволити їм ознайомитися з тимчасовими умовами. Комп'ютерна томографія (КТ) голови проводиться в день операції, використовуючи переваги переданестезійного седативного лікування. Через десять днів після операції тварини транспортуються до основних приміщень TEMPOJIMS. На 19, 20 та 21 дні після операції починають фіксувати вторинні результати спостереження кожні 30 днів протягом 6 місяців (Рисунок 2). В кінці тварини жертвуються, і проводиться нова КТ для вимірювання результату зображення та початку гістологічної підготовки.
Рандомізація, Розподіл та Сліпота
Рандомізація проводиться статистичною групою, яка не бере участі в оцінці результатів, під керівництвом Лісабонського медичного факультету. Розподіл до кожної рандомізованої групи проводиться до операції за допомогою запечатаного конверта і окремо для фази 1 та фази 2 дослідження. Хірургічна команда не є сліпою до розподілу лікування через тип втручання; однак члени хірургічної команди не беруть участі в оцінці результатів. Усі оцінювачі результатів є сліпими до втручання. У фазі 1 10 овець розподіляються до групи втручання: група імітаційної операції (n=3), група дисектомії (n=3), група дископексії (n=3) та резервна група (n=1). Резервна вівця планується до використання у разі смерті через анестезію або іншу ускладнення, не пов'язане з хірургічним втручанням. У фазі 2 10 овець випадковим чином призначаються до групи диска I (n=3), групи диска II (n=3), групи диска III (n=3) та резервної групи (n=1) (Рисунок 1).
Інтервенційна фаза
Протокол анестезії
Голодання та обмеження води необхідні за 24 години до операції. Седація проводиться з використанням діазепаму (0.5 мг/кг в/в), після чого проводиться індукція анестезії з використанням кетаміну (5 мг/кг в/в). Виконується оральна інтубація, а анестезія підтримується ізофлураном (1.5% до 2%). Для забезпечення аналгезії тварини, мелоксикам (0.5 мг/кг в/в, двічі на день) вводиться в день операції та протягом 4 днів післяопераційного періоду. Антибіотикопрофілактика з амоксициліном та клавулановою кислотою застосовується протягом 5 днів.
Протокол хірургічного втручання для фаз 1 та 2
Фаза 1
Білатеральна дисектомія (n=3): під загальною анестезією хірургічна команда виконує розріз шкіри перед вухом та тупу дисекцію м'яких тканин, що покривають суглоб. Суглобова область відкривається, і суглобова капсула розрізається. Диск та його прикріплення ідентифікуються. Медіальні, передні, задні та бічні прикріплення диска відокремлюються, і виконується дисектомія. Рана закривається шарами.
Білатеральна дископексія (n=3): під загальною анестезією хірургічна команда виконує розріз шкіри перед вухом і тупу дисекцію м'яких тканин, що покривають суглоб. Область суглоба відкривається, і суглобова капсула розрізається. Диск та його прикріплення ідентифікуються. Латеральні та задні прикріплення диска відокремлюються і зашиваються полі- p-діоксаном (PDS) 3/0. Рана закривається шарами.
Шам-хірургія (n=3): під загальною анестезією хірургічна команда виконує розріз шкіри перед вухом і тупу дисекцію м'яких тканин, що покривають суглоб. Капсула не розрізається. Рана закривається шарами.
Фаза 2
Диск I (n=3): під загальною анестезією хірургічна команда виконує розріз шкіри перед вухом і тупу дисекцію м'яких тканин, що покривають суглоб. Область суглоба відкривається, і суглобова капсула розрізається. Диск та його прикріплення ідентифікуються. Медіальні, передні, задні та латеральні прикріплення диска відокремлюються, і виконується дисектомія. Диск I вводиться в суглобовий простір і зашивається в латеральних прикріпленнях. Рана закривається шарами. Диск I буде альтернативним біоматеріалом і з інтелектуальних причин не може бути розкритий у цій статті.
Диск II (n=3): під загальною анестезією хірургічна команда виконує розріз шкіри перед вушною раковиною та тупу дисекцію м'яких тканин, що покривають суглоб. Суглобова область відкривається, і суглобова капсула розрізається. Диск та його прикріплення ідентифікуються. Медіальні, передні, задні та бічні прикріплення диска відокремлюються, і виконується дисектомія. Диск II вводиться в суглобовий простір і зашивається в бічні прикріплення. Рана закривається шарами. Диск II буде пористим каркасом з полі(гліцерол-себакату) (PGS), зміцненим полікапролактоном (PCL).
Диск III (n=3): під загальною анестезією хірургічна команда виконує розріз шкіри перед вушною раковиною та тупу дисекцію м'яких тканин, що покривають суглоб. Суглобова область відкривається, і суглобова капсула розрізається. Диск та його прикріплення ідентифікуються. Медіальні, передні, задні та бічні прикріплення диска відокремлюються, і виконується дисектомія. Диск III вводиться в суглобовий простір і зашивається в бічне прикріплення. Рана закривається шарами. Диск III буде пористим каркасом PGS, підготовленим за модифікованим методом сольової фузії. Коротко кажучи, подрібнені частинки солі (150 мг) розміром від 25 до 32 мкм будуть поміщені в 3D-друковану форму. Форма буде перенесена в інкубатор при 37°C і 90% відносної вологості на 1 годину. Злиті шаблони частинок солі висихатимуть у вакуумній печі при 90°C і 100 міліторр (mTorr) протягом ночі, обережно видаляючи соляний залишок з форми перед подальшою обробкою. Свіжо приготовлений PGS, розчинений у тетрагідрофурані (THF; 20 мас.%, 380 мкл, сіль:PGS=2:1), додається до соляного залишку, і THF дозволяється повністю випаруватися в витяжному шафі протягом 30 хвилин. Соляний залишок переноситься в вакуумну піч і затверджується при 150°C і 100 mTorr протягом 24 годин. Отримані соляні шаблони, просочені PGS, замочуються в деіонізованій воді на 4 години, а потім замінюються водою на 4 години, з обміном води кожні 4 години протягом перших 12 годин. Після 12-годинної водяної ванни каркаси переносяться в деіонізовану воду ще на 24 години з обміном води кожні 8 годин. Отримані каркаси заморожуються при –80°C, після чого застосовується процес ліофілізації.
Передбачено десять днів для відновлення післяопераційного догляду за раною та медикаментозного лікування (див. Рисунок 2).
Показники результатів
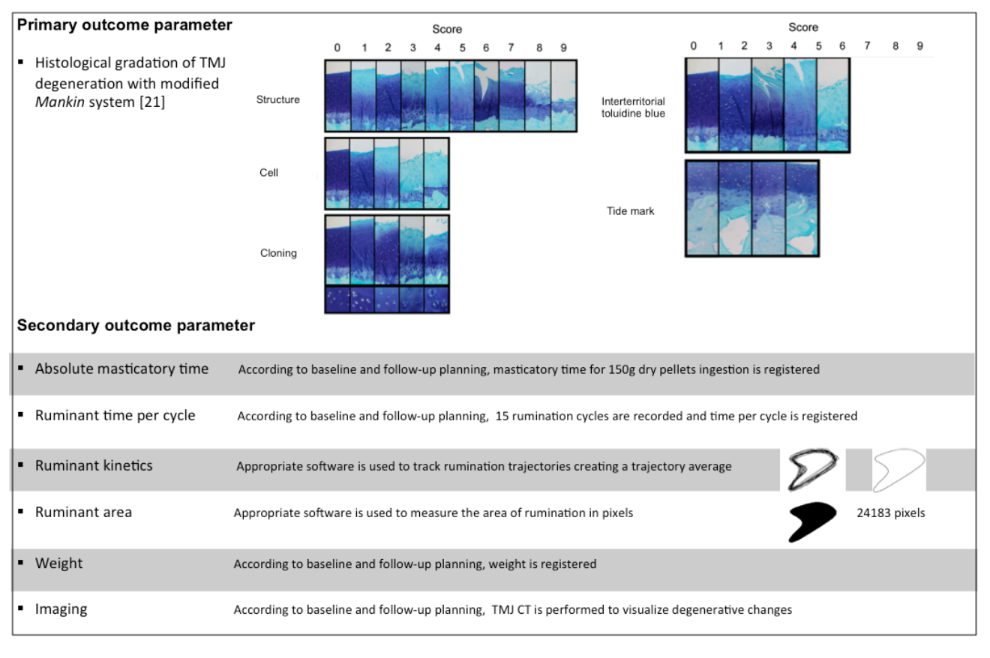
Основним показником є мікроскопічна оцінка руйнівних змін у СНЩС за допомогою модифікованої системи оцінки Манкіна. Вторинними показниками є оцінка зображень руйнівних змін у СНЩС, абсолютний жувальний час, час жування на цикл, кінетика жування, площа жування та вага овець. Основні та вторинні параметри результатів детально описані в Рисунку 3.
Первинний результат
Мета полягає в оцінці гістологічної градації руйнівних змін у скронево-нижньощелепному суглобі (СНС). Часовий момент - 6 місяців після хірургічного втручання.
Шість місяців після операції СНС видаляється за допомогою некропсійної кісткової осциляційної пилки відповідно до наступних анатомічних орієнтирів: краніальний (краніальний аспект короноідного відростка в зоні з'єднання з зигомасним відростком), каудальний (зовні акустичного проходу), дорсальний (орієнтир встановлюється на лускатій скроневій кістці) та вентральний (орієнтир фіксується на 2 см нижче акустичного проходу в зоні кута стилогіоїдного відростка). Суглоби фіксуються в 10% буферному формаліні протягом 24 годин і зберігаються в 70% етанолі. Декальцинація досягається шляхом занурення в 10% мурашиної кислоти в 5% формаліні протягом до 20 днів, після чого артикуляції розрізаються сагітально через весь кондил. Після декальцинації артикуляції СНС занурюються в три градуйовані суміші метилсаліцилату/парафіну та розрізаються сагітально через бічну частину до центральної частини СНС. Гістологічні зрізи надсилаються до Сіднейського інституту досліджень кісток і суглобів для гістологічного оцінювання за допомогою модифікованої системи оцінювання Манкіна. Цю оцінку виконують і класифікують незалежно два гістологи, які не будуть знати про втручання. Третій гістолог виступатиме в ролі арбітра у разі розбіжностей.
Вторинні результати
Оцінювані характеристики: аналіз зображень, абсолютний час жування, час жування за цикл, кінематика жування, площа жування та вага овець (див. Мультимедійні додатки 1 та 2). Часові точки - кожен місяць після хірургічного втручання протягом загалом 6 місяців.
Для вимірювання вторинних результатів була побудована спеціальна клітка (див. Рисунок 4) з фронтальним вікном і годівницею.
Аналіз зображень: передопераційна КТ проводиться на всіх овечках. Після жертвопринесення тварини блоки ТМЖ скануються за допомогою КТ, а оцінка зображень проводиться за критеріями та балами, описаними в Таблиці 1.
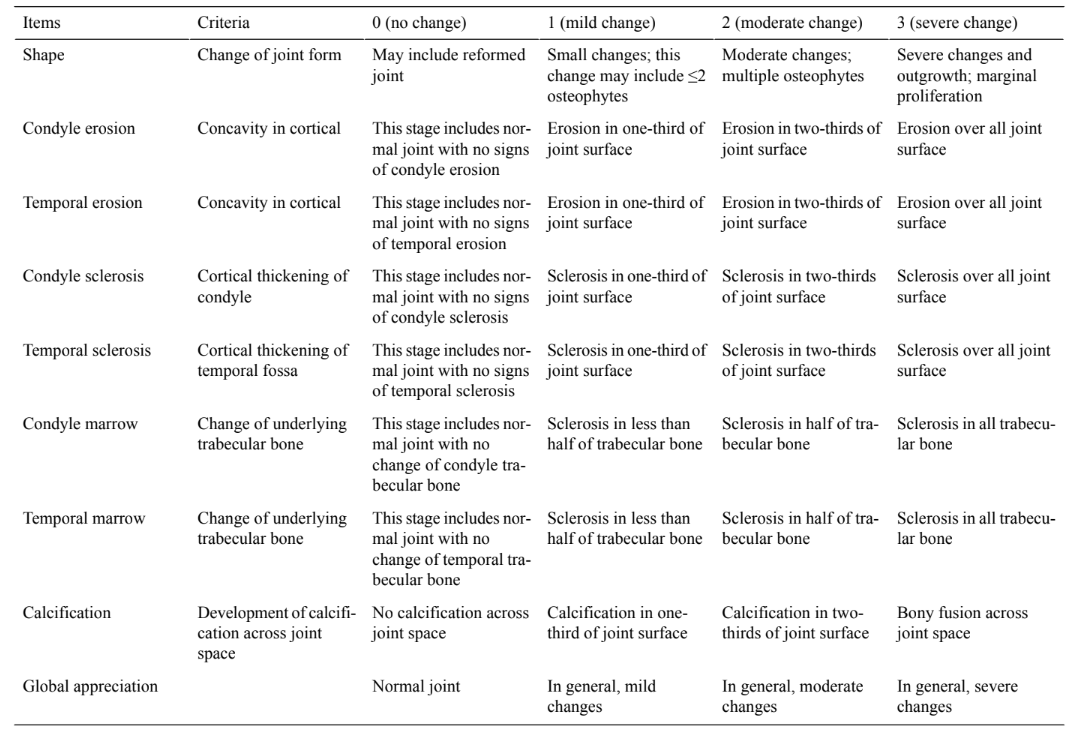

Цю оцінку виконують і класифікують незалежно двоє досвідчених радіологів, які не будуть знати про втручання. Третій радіолог виступатиме в ролі арбітра у разі розбіжностей.
Абсолютний жувальний час: відповідно до блок-схеми (Рисунок 2), о 9:00 ранку тварини поміщаються в індивідуальні клітки. Доза 150 грамів сухих гранул (Rico Gado A3) вводиться в годівницю, і час, поки вони з'їдять усі гранули, вимірюється хронометром (див. Мультимедійний додаток 1).
Час жування за цикл: відповідно до розкладу (Рисунок 2), ми фіксуємо 15 жувальних циклів приблизно через 4 години після годування 150 грамами. Ми використовуємо відеокамеру Canon 7D та зображення з 25 кадрами на секунду. Потім кількість кадрів за цикл ділиться на 25, щоб отримати час у секундах за цикл (див. Мультимедійний додаток 2).
Кінетика жуйних: ми використовуємо програмне забезпечення Foundry Nuke (2D трекінг) для виконання трекінгу жування та отримання середнього значення жувального циклу. За допомогою програмного забезпечення After Effects , ми перетворюємо 2-D трекінг у геометричну форму (див. Мультимедійний додаток 2).
Площа жуйних: ми визначаємо середнє значення 15 циклів і створюємо геометричну форму. Використовуючи програмне забезпечення Image J, ми проводимо кількісні вимірювання в пікселях середньої площі жуйних.
Вага: відповідно до розкладу, після годування 150 грамами сухих гранул вівці зважуються (див. Мультимедійний додаток 1).
Усі оцінки проводяться дослідниками, які не знають про хірургічне втручання.
Статистичні аналізи
Усі статистичні аналізи будуть виконані за допомогою SPSS версії 22 (IBM Corp, Армонк, Нью-Йорк, США). Буде проведено крос-секційний аналіз для порівняння змінних результатів на трьох рівнях незалежної змінної до і після випадкового призначення групи лікування. У крос-секційних аналізах буде виконано односторонній аналіз дисперсії (ANOVA) після перевірки всіх припущень. Для довгострокового аналізу буде виконано односторонній ANOVA з повторними вимірами, беручи до уваги спостереження після операції (місяці 1-6). Тест Фішера на найменшу значущу різницю буде виконано як пост-хок тести для перевірки значущих відмінностей для різних лікувань.
Повідомлення про небажані події
Небажані події, пов'язані з дослідженням, будуть розглянуті, включаючи (1) події анестезії: ідіопатична смерть, пневмоторакс, інші ускладнення, пов'язані з анестезією; (2) хірургічна техніка: масивна кровотеча, перелом головки, інші ускладнення, пов'язані з хірургічною технікою; та (3) післяопераційні події: інфекція ТМЖ, розходження шва, зниження апетиту, лицьовий параліч, зменшення жування, зниження ваги.
Обговорення
Це дослідження вивчає ефекти та побічні ефекти (1) двосторонньої дисектомії, (2) двосторонньої дископексії та (3) біоінженерних імплантатів дисків. Хоча це доклінічне дослідження в основному слугуватиме як пілотне дослідження, ми очікуємо отримати краще розуміння морфологічних та гістологічних змін у скронево-нижньощелепному суглобі (СНС) та їх наслідків у жувальній кінетиці.
Досі результати щодо дисектомії є суперечливими. Попередні доклінічні дослідження в цій галузі використовували контралатеральну неоперативну сторону як контроль та різні тваринні моделі, починаючи від мишей до собачої моделі. Використання контралатеральної сторони як контролю може бути недоречним, враховуючи вплив контралатерального навантаження. Теоретично, ми очікуємо зменшити цю упередженість, використовуючи двосторонній підхід. Варіабельність тварин у різних дослідженнях є попередженням про важливість використання однієї й тієї ж тваринної моделі в подальших дослідженнях щодо імплантатів СНС. Тому наша група провела попереднє дослідження, вважаючи чорних меріносових овець перспективною тваринною моделлю для досліджень щодо імплантатів дисків СНС, протезів СНС та моделі остеоартриту СНС. Щоб підвищити якість TEMPOJIMS, автори використовуватимуть контрольну групу з імітаційною операцією.
Ми очікуємо отримати цінну інформацію, пов'язану з групою дископексії фази 1, щодо того, чи сприяє хірургічний підхід внутрішньосуглобовому пошкодженню. Це може покращити майбутні висновки про приписування можливих пошкоджень самій інтервенції, а не імпланту СКС. Це питання є важливим, враховуючи, що для розміщення імплантів СКС у фазі 2 буде потрібен хірургічний підхід. Знову ж таки, використання двосторонньої інтервенції може зменшити можливий упередженість.
Більшість доклінічних досліджень зосереджувалися на грубих морфологічних/гістологічних оцінках і не були спроектовані для характеристики основного зміненого руху суглоба (кінетики) або функціональних наслідків. У цьому дослідженні ми включаємо пілотні вторинні результати для оцінки змін у кінетиці жуйних. Ми очікуємо корелювати первинні з вторинними результатами, щоб зрозуміти, чи можуть вони бути використані в майбутніх дослідженнях СКС. Може бути цікаво зрозуміти кілька пунктів:
- Чи є різниці в часі жування між групами дисків та дисектомією і дископексією?
- Чи є кореляція між гістологічними, образними та кінетичними результатами?
- Чи змінюється румінантна область та геометрія при виконанні різних втручань?
- Чи є різниця в румінантній кінетиці між групами дисків та дисектомією і дископексією?
- Чи прискорюють імплантати СНЩС остеоартрит?
Щодо фази 2, вибір біоматеріалу є критично важливим. Імплантат СНЩС буде підданий механічному, стресовому середовищу з обмеженим кровопостачанням, що може обмежити міграцію клітин та регенерацію in situ. Тестування трьох різних біоінженерних дисків in vivo та кореляція in vitro з поведінкою in vivo можуть серйозно покращити стратегії біоінженерії для досягнення безпечного та ефективного імплантату диска СНЩС для людей.
Основна перевага цього дослідження полягає в запропонованій тваринній моделі; описаних звичайних та пілотних результатах; дизайні дослідження з рандомізованою, сліпою та контрольованою плацебо групою; а також використанні двосторонніх хірургічних процедур. Потенційні обмеження дослідження включають відносно малий розмір вибірки. Якщо це дослідження підтвердить доцільність запропонованого протоколу та початкову ефективність запланованих імплантатів дисків ТМЖ, буде доцільно провести більше доклінічне дослідження для подальшого визначення ефективності цих дисків та сприяння трансляції доказів з тварин до клінічної практики у людей.
Автори: David Faustino Ângelo, Florencio Gil Monje, Raúl González-García, Christopher B Little, Lisete Mónico, Mário Pinho, Fábio Abade Santos, Belmira Carrapiço, Sandra Cavaco Gonçalves, Pedro Morouço, Nuno Alves, Carla Moura, Yadong Wang, Eric Jeffries, Jin Gao, Rita Sousa, Lia Lucas Neto, Daniel Caldeira, Francisco Salvado
Посилання
- Bae Y, Park Y. Вплив релаксаційних вправ для жувальних м'язів на дисфункцію скронево-нижньощелепного суглоба (TMD). J Phys Ther Sci 2013;25(5):583-586. [doi: 10.1589/jpts.25.583]
- Allen K, Athanasiou K. Тканинна інженерія диска СНС: огляд. Tissue Eng 2006;12(5):1183-1196. [doi: 10.1089/ten.2006.12.1183]
- Tanaka E, Sasaki A, Tahmina K, Yamaguchi K, Mori Y, Tanne K. Механічні властивості людського суглобового диска та їх вплив на навантаження СНС, вивчені методом скінченних елементів. J Oral Rehabil 2001 Mar;28(3):273-279. [Medline: 11394374]
- Martins-Júnior RL, Palma Antônio JC, Marquardt EJ, Gondin TM, Kerber FD. Дисфункції скронево-нижньощелепного суглоба: звіт про 124 пацієнтів. J Contemp Dent Pract 2010 Oct 14;11(5):71-78. [Medline: 20978727]
- Navrátil L, Navratil V, Hajkova S, Hlinakova P, Dostalova T, Vranová J. Комплексне лікування дисфункцій скронево-нижньощелепного суглоба. Cranio 2014 Jan;32(1):24-30. [doi: 10.1179/0886963413Z.0000000002] [Medline: 24660643]
- Mehra P, Wolford LM. Міні-якір Mitek для повторного розташування диска СНС: хірургічна техніка та результати. Int J Oral Maxillofac Surg 2001 Dec;30(6):497-503. [doi: 10.1054/ijom.2001.0163] [Medline: 11829231]
- Al-Baghdadi M, Durham J, Araujo-Soares V, Robalino S, Errington L, Steele J. Управління зміщенням диска СНС без редукції: систематичний огляд. J Dent Res 2014 Jul;93(7 Suppl):37S-51S [FREE Full text] [doi: 10.1177/0022034514528333] [Medline: 24659775]
- Estabrooks L, Fairbanks C, Collett R, Miller L. Ретроспективна оцінка 301 імплантату Proplast-Teflon для СНС. Oral Surg Oral Med Oral Pathol 1990 Sep;70(3):381-386. [Medline: 2216373]
- Henry CH, Wolford LM. Результати лікування реконструкції скронево-нижньощелепного суглоба після невдачі імплантату Proplast-Teflon. J Oral Maxillofac Surg 1993 Apr;51(4):352-358; discussion 359. [Medline: 8450350]
- Mercuri LG, Giobbie-Hurder A. Довгострокові результати після повної алопластичної реконструкції скронево-нижньощелепного суглоба після впливу невдалих матеріалів. J Oral Maxillofac Surg 2004 Sep;62(9):1088-1096. [Medline: 15346359]
- Morouço P, Ângelo D, Francisco L, Moura C, Alves N. Тканинна інженерія для ремонту та регенерації диска скронево-нижньощелепного суглоба: методологічна перспектива. Adv Cell Mol Otolaryngol 2017 Jan 17;4(1):33709. [doi: 10.3402/acmo.v4.33709]
- Lypka M, Yamashita DR. Надмірна реакція гігантських клітин на чужорідне тіло до імплантату teflon/proplast скронево-нижньощелепного суглоба: звіт про випадок. J Oral Maxillofac Surg 2007 Sep;65(9):1680-1684. [doi: 10.1016/j.joms.2006.09.030] [Medline: 17719383]
- Spagnoli D, Kent JN. Мультицентрова оцінка імплантату диска Proplast-Teflon для скронево-нижньощелепного суглоба. Oral Surg Oral Med Oral Pathol 1992 Oct;74(4):411-421. [Medline: 1408011]
- Fricton JR, Look JO, Schiffman E, Swift J. Довгострокове дослідження хірургії скронево-нижньощелепного суглоба з алопластичними імплантатами в порівнянні з нехірургічною реабілітацією для болісного зміщення диска скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 2002 Dec;60(12):1400-1411; discussion 1411. [doi: 10.1053/joms.2002.36091] [Medline: 12465000]
- Kulber DA, Davos I, Aronowitz JA. Важка шкірна реакція гігантських клітин на чужорідне тіло після реконструкції скронево-нижньощелепного суглоба з використанням Proplast-Teflon. J Oral Maxillofac Surg 1995 Jun;53(6):719-722; discussion 722. [Medline: 7776062]
- Chuong R, Piper MA. Протікання спинномозкової рідини, пов'язане з видаленням імплантату proplast зі скронево-нижньощелепного суглоба. Oral Surg Oral Med Oral Pathol 1992 Oct;74(4):422-425. [Medline: 1408012]
- Berarducci JP, Thompson DA, Scheffer RB. Перфорація в середню черепну ямку як наслідок використання імплантату Proplast-Teflon для реконструкції скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 1990 May;48(5):496-498. [Medline: 2329399]
- [Автори не вказані]. Рекомендації щодо управління пацієнтами з імплантатами скронево-нижньощелепного суглоба. Майстерня з хірургії імплантатів скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 1993 Oct;51(10):1164-1172. [Medline: 8410459]
- Herring S. Анатомія СНС та тваринні моделі. J Musculoskelet Neuronal Interact 2003 Dec;3(4):391-394; discussion 406 [FREE Full text] [Medline: 15758330]
- Angelo D, Morouço P, Alves N, Viana T, Santos F, González R. Вибір овець (Ovis aries) як тваринної моделі для дослідження скронево-нижньощелепного суглоба: морфологічна, гістологічна та біомеханічна характеристика суглобового диска. Morphologie 2016 Jul:223-233 [FREE Full text] [doi: 10.1016/j.morpho.2016.06.002] [Medline: 27450042]
- Leiggener CS, Erni S, Gallo LM. Новий підхід до вивчення кінематики щелепи в алопластичній реконструкції СНС. Int J Oral Maxillofac Surg 2012 Sep;41(9):1041-1045. [doi: 10.1016/j.ijom.2012.06.014] [Medline: 22819692]
- Little CB, Smith MM, Cake MA, Read RA, Murphy MJ, Barry FP. Ініціатива OARSI з гістопатології - рекомендації щодо гістологічних оцінок остеоартриту у овець та кіз. Osteoarthritis Cartilage 2010 Oct;18 Suppl 3:S80-S92 [FREE Full text] [doi: 10.1016/j.joca.2010.04.016] [Medline: 20864026]
- Cake MA, Appleyard RC, Read RA, Smith MM, Murrell GA, Ghosh P. Оваріектомія змінює структурні та біомеханічні властивості суглобового хряща овець і збільшує iNOS хряща. Osteoarthritis Cartilage 2005 Dec;13(12):1066-1075 [FREE Full text] [doi: 10.1016/j.joca.2005.07.001] [Medline: 16154775]
- Cohen W, Servais J, Polur I, Li Y, Xu L. Дегенерація суглобового хряща в контралатеральному неоперативному скронево-нижньощелепному суглобі у мишей з односторонньою частковою дисектомією. J Oral Pathol Med 2014 Feb;43(2):162-165. [doi: 10.1111/jop.12113] [Medline: 24044578]
- Ahtiainen K, Mauno J, Ellä V, Hagström J, Lindqvist C, Miettinen S та ін. Автологічні стовбурові клітини жирової тканини та полілактидні диски в заміні диска скронево-нижньощелепного суглоба кролика. J R Soc Interface 2013 Aug 06;10(85):20130287 [FREE Full text] [doi: 10.1098/rsif.2013.0287] [Medline: 23720535]
- Brown B, Chung W, Almarza A, Pavlick M, Reppas S, Ochs M. Індуктивний, заснований на каркасах, підхід до регенеративної медицини для реконструкції диска скронево-нижньощелепного суглоба. J Oral Maxillofac Surg 2012 Nov;70(11):2656-2668. [doi: 10.1016/j.joms.2011.12.030]
- Xu L, Polur I, Lim C, Servais J, Dobeck J, Li Y та ін. Остеоартрит, що розвивається на ранній стадії, у скронево-нижньощелепному суглобі миші, викликаний частковою дисектомією. Osteoarthritis Cartilage 2009 Jul;17(7):917-922. [doi: 10.1016/j.joca.2009.01.002] [Medline: 19230720]
- Lai WT, Tsai Y, Su S, Su C, Stockstill JW, Burch JG. Гістологічний аналіз регенерації дисків скронево-нижньощелепного суглоба у кроликів за допомогою реконструйованого колагенового шаблону. Int J Oral Maxillofac Surg 2005 May;34(3):311-320. [doi: 10.1016/j.ijom.2004.05.003] [Medline: 15741041]
- Sato S, Goto S, Koeda S, Motegi K. Зміни еластичної волокнистої мережі скронево-нижньощелепного суглоба кролика після дисектомії. J Oral Rehabil 2002 Sep;29(9):847-852. [Medline: 12366539]
- Sato S, Goto S, Motegi K. Зміни розташування колагенових волокон скронево-нижньощелепного суглоба кролика після дисектомії. J Craniomaxillofac Surg 2002 Jun;30(3):178-183. [Medline: 12220997]
- Bjørnland T, Haanaes HR. Дисектомія скронево-нижньощелепного суглоба: експериментальне дослідження на мавпах. J Craniomaxillofac Surg 1999 Apr;27(2):113-116. [Medline: 10342149]
- Ogi N, Kurita K, Ishimaru JI, Goss AN. Короткостроковий ефект використання замороженого алогенного диска для ремонту остеоартритного скронево-нижньощелепного суглоба у овець: попередній звіт. J Oral Maxillofac Surg1999 Feb;57(2):139-144; discussion 144. [Medline: 9973121]
- Hinton R, Stinson J. Вплив післяопераційної дієти на відповідь хряща кондилю на дисектомію. J Oral Maxillofac Surg 1997 Nov;55(11):1259-1264. [Medline: 9371117]
