Скловидні імплантати для дисків щелепно-лицевого суглоба на основі полі(ε-капролактону) та діакрилату поліетиленгліколю
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Темпоромандібулярний суглоб (ТМС), з'єднання між мандибулою та скроневою кісткою, ділиться на два відділи (верхній та нижній) фіброкартиляжним диском. Диск ТМС складається з аваскулярної та неінервованої тканини з візкоеластичними властивостями. Механічно диск ТМС піддається розтягуючим, стиснюючим та зсувним силам. Вивих або дегенерація диска ТМС можуть призвести до серйозних внутрішньосуглобових розладів темпоромандібулярного суглоба (ТМР). Незважаючи на велику кількість сучасних терапій/лікувань, існує обмежена кількість варіантів лікування для серйозних внутрішньосуглобових ТМР. Стратегією вирішення цієї проблеми може бути використання міжположеного матеріалу для заміни пошкодженого диска ТМС, який поступово деградує і сприяє утворенню нової тканини. У цій роботі було використано та протестовано три варіанти: один з термопластичного матеріалу, полі(ε-капролактону) (PCL), інший з фотополімеризованого гідрогелю, поліетиленгліколь діакрилат (PEGDA), і третій з комбінації цих двох матеріалів. Отримані результати продемонстрували, що комбінація різних матеріалів може представляти значну перевагу в тканинній інженерії диска ТМС та в тканинній інженерії хряща в цілому.
Вступ
Темпоромандибулярний суглоб (ТМС) є двостороннім з'єднанням між кондилярним відростком нижньої щелепи та нижньощелепною ямкою і суглобовим горбком скроневої кістки. Між кістковими структурами розташований фіброкартиляжний диск, який прикріплений до фіброзної капсули по краю, що розділяє суглоб на дві порожнини: верхню та нижню.
Диск ТМС складається з аваскулярної, неінервованої, фіброкартиляжної тканини з візкоеластичними властивостями. Диск має еліптичну форму, довшу в медіолатеральному напрямку, ніж в антеропостеріорному (19 і 13 мм відповідно, у людей). Анатомічно диск ТМС можна поділити на три області: передня смуга, проміжна зона та задня смуга. Проміжна зона значно тонша за смуги (≈1 мм, у людей), а задня смуга є найтовщою частиною диска (≈4 мм, у людей). Основна частка диска ТМС складається з води (≈73 %). Окрім води, диск ТМС складається з клітин (фібробластів, фіброцитів та клітин, подібних до хондроцитів, з округлою формою) та екстраклітинного матриксу (ЕКМ) з щільних колагенових волокон (≈80 % за сухою вагою), еластичних волокон (≈2 %) та глікозаміногліканів.
Ця біконкава форма підходить до анатомії кістки суглоба і є важливою для функцій скронево-нижньощелепного суглоба (СНС). Як і в інших суглобах, диск СНС зменшує тертя в суглобі та розподіляє навантаження всередині суглоба. Більше того, він допомагає у вирівнюванні та стабілізації суглоба під час обертання та переміщення завдяки певній гнучкості, яку забезпечує проміжна зона. Диск СНС має віскоеластичну поведінку і піддається розтягуванню, стисненню та зсувним силам. Повідомлені стиснені властивості диска СНС є дуже непослідовними, коливаючись від десятків до десятків тисяч кПа. Щодо різних зон, передні та задні смуги, здається, мають вищі стиснені властивості, ніж проміжна зона.
Дегенерація та зміщення диска СНС можуть призвести до розладів СНС (РСНС). За оцінками, 25% населення можуть відчувати симптоми РСНС, такі як: біль у суглобі та в навколишніх м'язах; клацання; дискомфорт при русі щелепи; скрегіт зубами. Більшість РСНС успішно лікуються неінвазивними методами (наприклад: фізіотерапія, оклюзійні шини/корекції та фармакологія), але в деяких випадках необхідно вдатися до хірургії (наприклад: артроцентез, артроскопія, дископексія, дисектомія та повна заміна суглоба).
Анатомія, еквівалентна людському скронево-нижньощелепному суглобу (СНЩС), була вивчена у різних тварин. Деякі з найпоширеніших моделей включають свиней, овець, кіз, корів, собак, щурів та кроликів. У цій роботі геометрія імплантатів диска СНЩС була отримана шляхом зворотного інженерування диска СНЩС чорних меріносових овець (Ovies aries).
Протягом останніх двох десятиліть галузь інженерії тканин диска СНЩС (TE) зростала як обнадійливе рішення для ТМД, спрямоване на ремонт і регенерацію диска. Різні підходи були розроблені, з використанням або без каркасів, різноманітних матеріалів та включенням деяких факторів росту.
Каркаси, що використовуються в інженерії тканин диска СНЩС, були виготовлені з поліаміду, полігліколевої кислоти (PGA), полі(gліцеролсебакату) (PGS), полімолочної кислоти (PLA), полі-L-молочної кислоти (PLLA), поліетилену тетрафториду (PTFE) та інших натуральних біоматеріалів, таких як колагенові гелі та з деклітинізованих дисків СНЩС свиней. В останні роки, через їх повільну швидкість деградації, каркаси та піни з полі(ɛ-капролактону) (PCL) були широко досліджені, враховуючи повільну швидкість регенерації фіброкартиляжу.
Ця робота зосереджена на розробці каркасу на основі PCL та PEGDA для біоінженерного імплантату диска щелепно-лицевого суглоба, з властивостями, близькими до природної тканини, виготовленого за допомогою технологій швидкого прототипування та з feasibly хірургічним підходом.
Матеріали та методи
Різні каркаси були виготовлені за допомогою зворотного інженерії та адитивних технологій, з метою заміни та сприяння регенерації ECM диска щелепно-лицевого суглоба. У цьому дослідженні було виготовлено три типи 3D матриць: i) гідрогель PEGDA через фотополімеризацію, ii) каркаси PCL за допомогою моделювання злиттям (FDM), iii) комбінація обох.
Виробництво каркасу полі (ɛ-капролактон)
Полі (ɛ-капролактон) (PCL) є біосумісним та біорозкладним поліестером (12-24 місяці), який показав здатність підтримувати широкий спектр типів клітин і є матеріалом, схваленим Управлінням з контролю за продуктами і ліками США (FDA). Процес екструзії або моделювання злиттям (FDM) полягає в екструзії (термо)пластику або воску, в даному випадку PCL (у вигляді ниток або гранул), через сопло, яке формує бажаний шар поетапно. Опірні нагрівачі, що покривають подаючий канал і сопло, використовуються для підтримання матеріалу трохи вище його температури плавлення (близько 60ºC для PCL). Це дозволяє матеріалу легко проходити через сопло, з'єднуючись з нижнім шаром і досягаючи швидкої затвердіння.
У першому експерименті було досліджено вплив температури сопла на механічну поведінку каркасів. Таким чином, каркаси PCL 6500 (Perstorp) (n=4) були виготовлені за допомогою машини BioExtruder (CDRSP, Лейрія, Португалія) з температурою сопла 80ºC (група T80) та 86ºC (група T60). Крім того, температури депозиту та системи подачі/гейту становили, відповідно, 80ºC та 100ºC, використане сопло мало діаметр 300 мкм, а швидкості депонування та поперечної головки становили 14.5 об/хв та 10 мм∙с-1, відповідно. Остаточні каркаси PCL, геометрія яких була отримана шляхом зворотного інженерування диска щелепно-лицевого суглоба вівці, мали основу 278 ± 2 мм2 та товщину зрізу 280 мкм.
Виробництво гелів PEGDA
Полі(етиленгліколь), PEG, є біосумісним, гідрофільним, нейтральним та високомобільним полімерним ланцюгом, який використовувався в тканинній інженерії кістки та хряща, серед інших біомедичних застосувань, таких як системи контрольованого вивільнення лікарських засобів. Полі(етиленгліколь) діакрилат, PEGDA, є одним з похідних PEG, який легко маніпулюється в гелі через фотополімеризацію з використанням біосумісних фотосенсибілізаторів, таких як DMPA (2,2-Диметокси-2-феніл-ацетофенон), та під впливом ультрафіолетового світла довгої хвилі, що викликає зшивання.
Гідрогелі PEGDA (Sigma-Aldrich) (n=4) були виготовлені з двома різними концентраціями, 20% (група H20) та 30%w/V (група H30), з буфером 2-[4-(2-гідроксиетил) піперазин-1-іл]етансульфонової кислоти (HEPES) (Sigma-Aldrich). Фотополімеризація була індукована за допомогою 0.1% w/V 2,2-диметокси-1,2-дифенілетанону (DMPA, Sigma-Aldrich) фотосенсибілізатора при впливі УФ-світла (365 нм). Правильна форма диска TMJ була отримана за допомогою інструменту для різання, створеного виключно для цієї мети.
Обробка поверхні
Для покращення гідрофільності каркасів PCL були виконані дві основні стратегії: i) 4 каркаси (з групи T86) були поміщені в розчин гідроксиду натрію (NaOH) 1M приблизно на 24 години (PNaOH); ii) інші 4 каркаси (з групи T80) були поміщені в розчин PEGDA перед фотополімеризацією (PH).
Механічні випробування
Механічна поведінка каркасів та гідрогелів оцінювалася за допомогою одновісних неконфінованих випробувань на стиснення з використанням універсальної випробувальної машини з швидкістю розширення 1 мм.хв-1. Перед механічними випробуваннями площа кожного каркаса була визначена за допомогою програмного забезпечення ImageJ2. Сила, F (Н) та деформація (мм) реєструвалися в будь-який момент під час випробувань, а значення стиснення та деформації були визначені для побудови графіків напруги-деформації. Таким чином, еластичний модуль стиснення був оцінений відповідно до нахилу початкової лінійної області побудованих кривих.
Статистичний аналіз
Одновимірна описова статистика (середнє значення та стандартне відхилення) механічної поведінки була визначена для кожної групи. Значущі відмінності між групами оцінювалися за допомогою одностороннього дисперсійного аналізу (ANOVA). Пост-хок тести (тест Тьюкі) були проведені для виявлення будь-яких значущих відмінностей (p<0.05) для різних температур сопел під час виробництва та для поверхневого оброблення, в каркасах, а також для різних концентрацій PEGDA у випадку гелів. Ці тести були виконані за допомогою GraphPad Prism 6 (GraphPad Software, Inc.) та Excel 2016 (Microsoft Corporation). ImageJ2 (публічна домен) був використаний для визначення площ каркасів та гелів.
Результати та обговорення
Використовуючи Bioextruder, ми змогли успішно виробляти відтворювані каркаси (максимум 26 x 13 x 4 мм) з запланованою геометрією, отриманою шляхом використання зворотного інженерії природного диска (Рис. 1).

Оцінка впливу температури сопла
Каркасні диски TMJ з PCL були успішно отримані за допомогою двох різних температур сопла. Результати, отримані внаслідок одновісного неконфінованого випробування на стиснення, вказують на значні відмінності між двома групами (p<0.05) (див. рис. 3). Групи T80 та T86 продемонстрували модуль стиснення 31.8 ± 1.5 МПа та 23.9 ± 1.8 МПа відповідно.
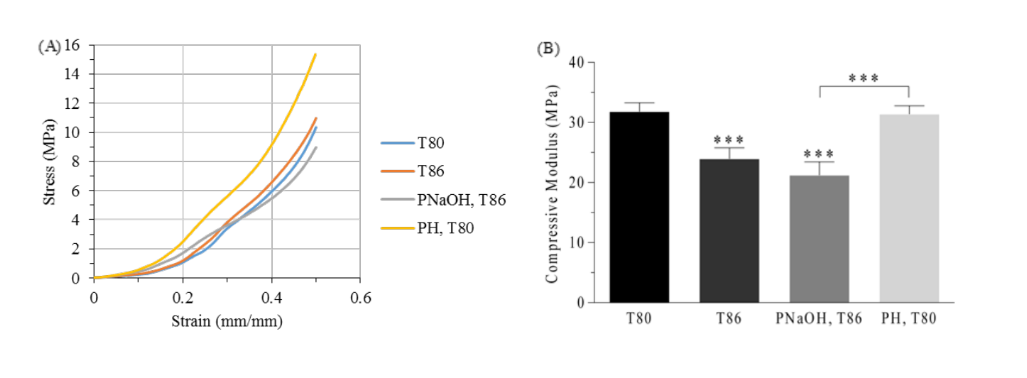
Згідно з літературою, температура безпосередньо впливає на ширину дороги, впливаючи на остаточну пористість (вища температура призводить до нижчої пористості) структур, а отже, і на їх механічну поведінку. Нижча температура дозволяє матеріалу швидше затвердіти, зменшуючи можливі зміни в геометрії каркасів. Ці зміни можуть відбуватися при вищих температурах виробництва, оскільки матеріал, перебуваючи в в'язкому стані, підлягає впливу сили тяжіння, і каркаси стають трохи плоскими. Цей експеримент відповідає очікуваному результату.
Оцінка впливу концентрації PEGDA на механічні властивості гелів
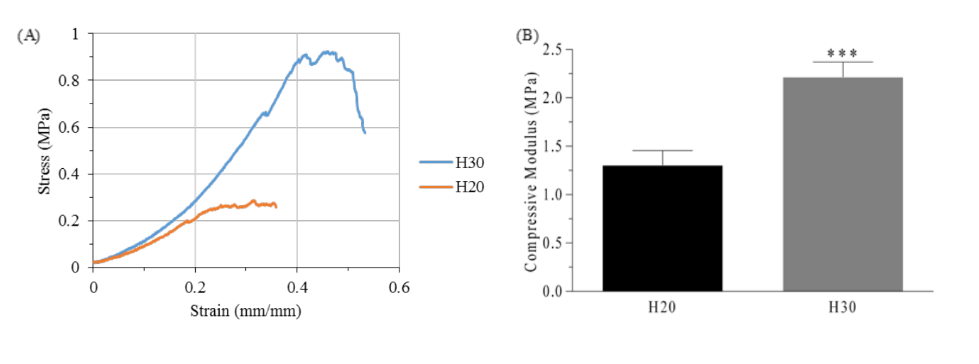
Як показано на малюнку 2, між двома групами гелів спостерігаються значні відмінності (p<0.05). Гелі, виготовлені з концентрацією PEGDA 20% w/V, продемонстрували майже вдвічі нижчий модуль стиснення та третину остаточної міцності (1.30 ± 0.15 МПа та 0.30 ± 0.03 МПа відповідно) у порівнянні з гелями, виготовленими з 30% w/V PEGDA (2.21 ± 0.16 МПа та 1.01 ± 0.11 МПа). Незважаючи на це, гелі групи H30 виявилися дуже крихкими при вигині або розтягуванні. Таким чином, для виготовлення каркасів групи PH використовувалися гелі, подібні до групи P20.
Вплив обробки поверхні
Обробка поверхні каркасів PCL не призвела до значних відмінностей у механічній поведінці каркасів. Компресійний модуль групи PNaOH (21.2 ± 2.2 МПа) трохи зменшився в порівнянні з контрольною групою (T86), але ці відмінності не були значними (p>0.05). Невелике зменшення механічних властивостей зумовлене деградацією поверхні, спричиненою розчином NaOH - зменшенням діаметра волокон, які стають нерівномірними вздовж волокна. Таким чином, каркаси втрачають масу, і їх пористість збільшується, що призводить до зменшення їх механічних властивостей при стисненні.
З іншого боку, додавання гідрогелю в групу PH не викликало значних відмінностей у компресійних еластичних модулях (31.4 ± 1.4 МПа) в порівнянні з контрольною групою (T80). Крім того, гідрогель, здається, значно підвищує змащення та гнучкість каркасів, і це може допомогти в клітинній адгезії завдяки збільшенню його гідрофільності.
Використання PCL у тканинній інженерії хряща, зокрема у фіброзно-хрящовій тканині диска СНЩС, є новим. Хоча початкова гідрофобність PCL, обробка поверхні NaOH може покращити його гідрофільність та клітинну адгезію завдяки нерівності поверхні. Більше того, включення гідрогелю PEGDA є авангардним підходом і може вказати правильний напрямок для успішного біоінженерного імплантату диска СНЩС. Комбінація двох різних біоматеріалів (та пов'язаних технологій виробництва) може призвести до значних переваг у тканинній інженерії диска СНЩС. У цьому підході PCL забезпечує необхідну механічну стійкість, а його повільна швидкість деградації сумісна з повільною швидкістю росту фіброзно-хрящової тканини, тоді як гідрогель PEGDA сприяє клітинній адгезії, підвищує змащення імплантату та дозволяє інтеграцію факторів росту. Хоча PCL має вищу жорсткість, ніж рідна тканина диска СНЩС, це може бути корисним під час хірургії, оскільки дозволяє легше розміщувати імплантат, скорочуючи час і дозволяючи менш інвазивну хірургію.
Висновок
Диск ТМЖ TE має на меті запропонувати альтернативу сучасним методам лікування ТМД через дегенерацію диска. Таким чином, поєднання різних матеріалів можливе для виробництва біоінженерного імплантату, який краще імітує властивості рідної тканини.
У цьому дослідженні ми успішно виготовили каркас на основі PCL та PEGDA для біоінженерного імплантату диска ТМЖ. Завдяки повільній швидкості деградації PCL, цей матеріал сумісний з повільною швидкістю росту тканини диска ТМЖ. Крім того, PCL забезпечує важливі механічні властивості каркасу, а його відносна жорсткість може бути перевагою під час хірургії. З іншого боку, гідрогель PEGDA сприяє клітинній адгезії та забезпечує змащення. Таким чином, функції диска ТМЖ забезпечені: i) змащення дозволяє зменшити тертя в суглобі; ii) розподіл внутрішньосуглобового навантаження забезпечується геометрією каркасу та механічними властивостями матеріалів; ii) геометрія імплантату дозволяє вирівнювання та стабілізацію суглоба.
У підсумку, ця робота продемонструвала, що комбінація різних матеріалів може представляти значний прогрес у тканинній інженерії диска скронево-нижньощелепного суглоба та в інженерії хряща в цілому.
Автори: Луїс Франциско, Карла Мура, Таня Віана, Давид Анджело, Педро Мороуко, Нуньо Алвеш
Посилання:
- VanPutte, C., Regan, J., Russo, A., Seeley, R., Stephens, T. та Tate, P., Анатомія та фізіологія Сіли, 10-е видання, Нью-Йорк, США, 2014
- Athanasiou, K. A., Almarza, A. A., Detamore, M. S. та Kalpakci, K. N., Тканинна інженерія хряща скронево-нижньощелепного суглоба, 2009
- Stankovic, S., Vlajkovic, S., Boskovic, M., Radenkovic, G., Antic, V. та Jevremovic, D., Морфологічні та біомеханічні особливості диска скронево-нижньощелепного суглоба: огляд останніх знахідок, Arch Oral Biol, 58 (2013) 1475-82
- Kalpakci, K. N., Willard, V. P., Wong, M. E. та Athanasiou, K. A., Міжвидове порівняння диска скронево-нижньощелепного суглоба, J Dent Res, 90 (2011) 193-8
- Matuska, A. M., Muller, S., Dolwick, M. F. та McFetridge, P. S., Біомеханічні та біохімічні результати деформації диска скронево-нижньощелепного суглоба свиней, Arch Oral Biol, 64 (2016) 72-9
- Fazaeli, S., Ghazanfari, S., Everts, V., Smit, T. H. та Koolstra, J. H., Внесок колагенових волокон у механічні стиснуті властивості диска скронево-нижньощелепного суглоба, Osteoarthritis Cartilage, 24 (2016) 1292-301
- Kuo, J., Zhang, L., Bacro, T. та Yao, H., Залежні від регіону біпараметричні в'язкоеластичні властивості дисків людського скронево-нижньощелепного суглоба під обмеженим стисненням, J Biomech, 43 (2010) 1316-21
- Tanaka, E. та Eijden, T. v., Біомеханічна поведінка диска скронево-нижньощелепного суглоба, Crit Rev Oral Biol Med, 14 (2003) 138-150
- Beek, M., Aarnts, M. P., Koolstra, J. H., Feilzer, A. J. та Eijden, T. M. G. J. v., Динамічні властивості диска людського скронево-нижньощелепного суглоба, J Dent Res, 80 (2001) 876-880
- Willard, V. P., Kalpakci, K. N., Reimer, A. J. та Athanasiou, K. A., Регіональний внесок глікозаміногліканів у стиснуті властивості диска скронево-нижньощелепного суглоба, J Biomech Eng, 134 (2012) 011011
- Ingawale, S. та Goswami, T., Скронево-нижньощелепний суглоб: розлади, лікування та біомеханіка, Ann Biomed Eng, 37 (2009) 976-96
- Murphy, M. K., MacBarb, R. F., Wong, M. E., A., K. та Athanasiou, K. A., Розлади скронево-нижньощелепного суглоба: огляд етіології, клінічного управління та стратегій тканинної інженерії, Int J Oral Maxillofac Implants, 28 (2013) e393–e414
- Herring, S. W., Анатомія ТМД та моделі тварин, J Musculoskelet Neuronal Interact, 3 (2003) 391
- Bermejo, A., González, O. та González, J. M., Свиня як модель для експериментів над скронево-нижньощелепним суглобом, Oral Surc Oral Med Oral Pathol, 75 (1993) 18-23
- Angelo, D. F., Morouco, P., Alves, N., Viana, T., Santos, F., Gonzalez, R., Monje, F., Macias, D., Carrapico, B., Sousa, R., Cavaco-Goncalves, S., Salvado, F., Peleteiro, C. та Pinho, M., Вибір овець (Ovis aries) як моделі тварини для дослідження скронево-нижньощелепного суглоба: морфологічна, гістологічна та біомеханічна характеристика диска суглоба, Morphologie, 100 (2016) 223-233
- Mehrotra, D., Біоінженерія ТМД: огляд, J Oral Biol Craniofac Res, 3 (2013) 140-5
- Hunter, C. J., Інженерія волокнистого хряща, у: J. A. Burdick та R. L. Mauck (ред.), Біоматеріали для застосувань у тканинній інженерії: огляд минулого та майбутніх тенденцій, Springer, Нью-Йорк, 2011, с. 363-389
- Allen, K. D. та Athanasiou, K. A., Вибір каркасів та факторів росту в інженерії диска скронево-нижньощелепного суглоба, J Dent Res, 87 (2008) 180-185
- Juran, C. M., Dolwick, M. F. та McFetridge, P. S., Інженерна мікропористість: підвищення раннього регенеративного потенціалу декліаризованих дисків скронево-нижньощелепного суглоба, Tissue Eng Part A, 21 (2015) 829-39
- Springer, I. N. G., Fleiner, B., Jepsen, S. та Açil, Y., Культура клітин, отриманих з хряща скронево-нижньощелепного суглоба на неабсорбованому каркасі, Biomaterials, 22 (2001) 2569–2577
- Hagandora, C. K., Gao, J., Wang, Y. та Almarza, A. J., Полі (гліцерол себакат): новий матеріал для каркасів інженерії диска скронево-нижньощелепного суглоба, Tissue Eng Part A, 19 (2013) 729-37
- Brown, B. N., Chung, W. L., Almarza, A. J., Pavlick, M. D., Reppas, S. N., Ochs, M. W., Russell, A. J. та Badylak, S. F., Індуктивний, каркасний, регенеративний підхід до реконструкції диска скронево-нижньощелепного суглоба, J Oral Maxillofac Surg, 70 (2012) 2656-68
- Kobayashi, E., Nakahara, T., Inoue, M., Shigeno, K., Tanaka, A. та Nakamura, T., Експериментальне дослідження in situ тканинної інженерії диска скронево-нижньощелепного суглоба з використанням аутохтонної кісткового мозку та колагенової губки, Journal of Hard Tissue Biology, 24 (2015) 211 -218
- Olubamiji, A. D., Izadifar, Z., Si, J. L., Cooper, D. M., Eames, B. F. та Chen, D. X., Модулювання механічної поведінки 3D-друкованих каркасів, що імітують хрящ: вплив молекулярної ваги та геометрії пори, Biofabrication, 8 (2016) 025020
- Legemate, K., Tarafder, S., Jun, Y. та Lee, C. H., Інженерія дисків людського ТМД з каркасами, що вивільняють білки, J Dent Res, 95 (2016) 800-7
- Ratner, B. D., Hofffman, A. S., Schoen, F. J. та Lemons, J. E., Наука про біоматеріали - Вступ до матеріалів у медицині, Сан-Дієго, Каліфорнія, 1996
- Ebnesajjad, S., Посібник з біополімерів та біорозкладних пластиков - Властивості, обробка та застосування, Великобританія, 2013
- Domingos, M., Chiellini, F., Gloria, A., Ambrosio, L., Bartolo, P. та Chiellini, E., Вплив параметрів процесу на морфологічні та механічні властивості 3D біоекструзійних каркасів полі(ε‐капролактону), Rapid Prototyping Journal, 18 (2012) 56-67
- Sun, H., Mei, L., Song, C., Cui, X. та Wang, P., Внутрішньоживотне розкладання, абсорбція та екскреція імплантату на основі PCL, Biomaterials, 27 (2006) 1735-40
