Порівняльна гістологічна оцінка біосумісності матеріалів, що використовуються в апікальній хірургії
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Оцінити біологічні властивості різних матеріалів, які можуть бути використані в апікальній хірургії.
Методологія: Для тестування наступних матеріалів: оксид цинку-евгенол (ZOE), мінеральний триоксидний агрегат (MTA) та світлозатверджувальна композитна смола Z-100, використовувалася техніка внутрішньокісткових імплантатів, рекомендована FDI (1980) та ADA (1982). Тридцять морських свинок, по 10 для кожного матеріалу, були розділені на експериментальні періоди тривалістю 4 та 12 тижнів, отримали по одному імплантату з кожного боку симфізу нижньої щелепи. Відповідь сполучної тканини вздовж бічної стінки зовні чаші слугувала негативним контролем для техніки. Наприкінці періодів спостереження тварини були вбиті, а зразки підготовлені для рутинного гістологічного дослідження з метою оцінки їх біосумісності.
Результати: Реакція тканини на матеріали зменшувалася з часом. Цемент ZOE був дуже токсичним протягом 4-тижневого експериментального періоду, але цей профіль суттєво змінився після 12 тижнів, коли він показав біосумісні характеристики. MTA та Z-100 продемонстрували біосумісність у цій тестовій моделі в обох часових періодах.
Висновки: MTA та композит Z-100 були біосумісними на 4 та 12 тижнях у цій експериментальній моделі.
Вступ
Успіх лікування кореневих каналів залежить від видалення інфікованого вмісту каналу, після чого слідує заповнення каналу матеріалом з адекватною сумісністю, щоб уникнути подразнення періапікальних тканин. Незважаючи на постійний розвиток концепцій, нові ендодонтичні техніки та розробку більш ефективних матеріалів і інструментів, вирішення періапікальної патології іноді досягається лише шляхом хірургічних процедур (Tassery та ін. 1999).
Однак апікальна хірургія повинна проводитися лише тоді, коли традиційне лікування кореневих каналів зазнало невдачі. Ідеальний матеріал для заповнення апікального кінця кореня повинен мати біосумісні характеристики, розмірну стабільність, адгезивність, низьку розчинність та здатність створювати герметичність апікальної третини каналу, щоб ізолювати систему кореневих каналів від періапікальної області (Gartner & Dorn 1992). Біосумісність була визнана одним з найважливіших факторів (Pascon та ін. 2001).
При розгляді біологічних властивостей ендодонтичних матеріалів існує широкий спектр характеристик, які слід враховувати. Методології для оцінки цих параметрів включають початкові тести, вторинні тести та дослідження використання. Початкова оцінка повинна включати базові in vitro методи оцінки біологічних властивостей. Вторинні оцінки повинні проводитися in vivo на лабораторних тваринах і можуть включати експерименти з імплантацією. Дослідження використання проводяться на приматах або людях (Spångberg 1969, Stanley 1985).
Велику кількість матеріалів було рекомендовано для заповнення апікального кореневого каналу. Метою цього дослідження було оцінити реакцію тканин різноманітних потенційно корисних матеріалів, що використовуються як заповнення кореневого каналу, використовуючи експериментальну модель, рекомендовану FDI (1980) та ADA (1982).
Матеріали та методи
Оцінюваними матеріалами були оксид цинку-евгенол (ZOE) (S.S.White, Ріо-де-Жанейро, Бразилія), мінеральний триоксидний агрегат (MTA) (ProRootTM MTA; Dentsply Endodontics, Талса, ОК, США) та світлокурна композитна смола Z-100 (3M, Сент-Пол, МН, США). Усі матеріали були підготовлені відповідно до рекомендацій виробника для їх клінічного використання та завантажені в носії з Тефлону® (Політетрафлуороетилен; DuPont, HABIA, Кнівста, Швеція), забезпечуючи, щоб повітря не було затримано.
Інтраосеальний імплантат у щелепі морської свинки (Spångberg 1969) та стандартизовані методи оцінки біологічних реакцій, рекомендовані FDI (1980) та ADA (1982), були використані. Тридцять морських свинок (вагою ~800 г) були обрані, і кожна тварина отримала два імплантати з одного й того ж матеріалу. Десять зразків були використані для кожного матеріалу та періоду спостереження (Таблиця 1). Крім того, відповідь сполучної тканини вздовж бічної стінки зовні чашки з Тефлону® слугувала негативним контролем для техніки.
Тварини були анестезовані інтраперитонеально 0.6 мл кетаміну (100 мг мл–1), що містив ацеPROMAZINE (0.5 мг мл–1). У мукобукальному складці області нижніх різців було введено 0.6 мл ксилокаїну 2% з епінефрином (1 : 100 000), щоб запобігти місцевому дискомфорту. Морських свинок поголили в підщелепній області, а шкіру дезінфікували 5% настоянкою йоду. Дистальну вентральну симфізарну область щелепи було хірургічно відкрито в асептичних умовах через розріз у шкірі та м'язовій тканині. Щелепна кістка з обох боків симфізу була оголена, і циліндричні отвори, розширені до діаметра 2 мм і глибини 2 мм, були підготовлені з використанням борів під стерильною фізіологічною сольовою промивкою. Стерилізовані циліндричні чашки з тефлону®, відкриті з одного кінця, і з їх зовнішніми поверхнями, нарізаними для забезпечення утримуючих канавок, були заповнені в стерильних умовах матеріалами та вставлені в кісткові порожнини таким чином, щоб заповнювальні матеріали контактували з кістковою тканиною. Циліндри були
Довжина 2,0 мм, внутрішній діаметр 1,3 мм і зовнішній діаметр 2,0 мм. Коли чашки були на місці, м'які тканини були замінені та зашиті незалежно за допомогою розсмоктувального матеріалу 3-0. Періоди спостереження становили 4 та 12 тижнів, коли морських свинок вбивали, нижня щелепа була виділена, а кістка, що прилягає до чашок in situ, була розрізана на блоки по 10 мм. Зразки були занурені в 10% буферний розчин формаліну та підготовлені для рутинного гістологічного дослідження. Серійні зрізи (товщиною 5 лм) були нарізані та забарвлені гематоксиліном-еозином (H & E) для клітинної ідентифікації.
Інтерфейс на відкритті чашки, між матеріалом і кісткою, був досліджений і оцінений за інтенсивністю запалення. Було використано десять гістологічних критеріїв для визначення рівнів запалення – наявність або відсутність нейтрофільних лейкоцитів, макрофагів, лімфоцитів, плазматичних клітин, гігантських клітин чужорідного тіла, розсіяного матеріалу, капсули, новоутвореної здорової кістки, некротичної тканини та резорбції.
Два незалежні спостерігачі були залучені для оцінки реакцій тканин. Загальний рівень реакції тканин був оцінений як відсутній до незначного, помірного та тяжкого відповідно до гістологічних критеріїв, визначених раніше. Вважалося біологічно прийнятним, що матеріал показав відсутню до незначної реакції на обох експериментальних періодах 4 та 12 тижнів, або помірну реакцію на 4 тижні, яка зменшилася на 12 тижні.
Результати
Кількість внутрішньокісткових імплантатів та інтенсивність запальної реакції представлені в Таблиці 2. Гістологічні оцінки матеріалів на 4 та 12 тижнях підсумовані в Таблиці 3.
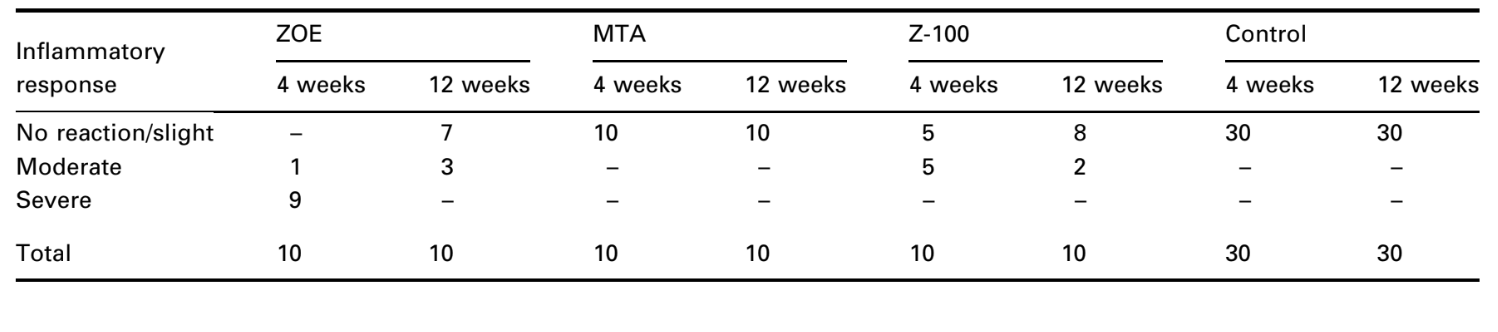
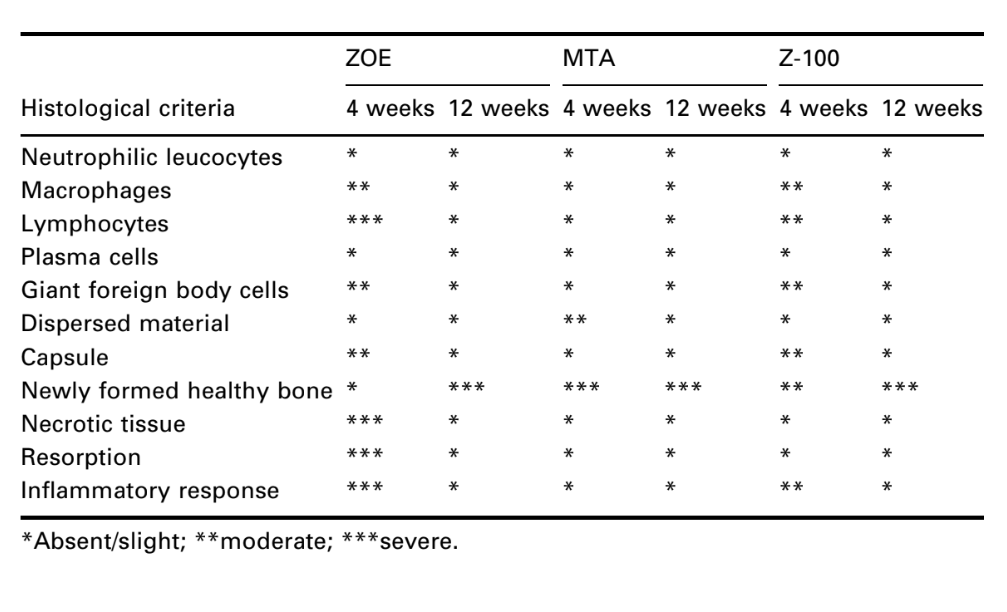
Чотиритижневі спостереження
Негативний контроль
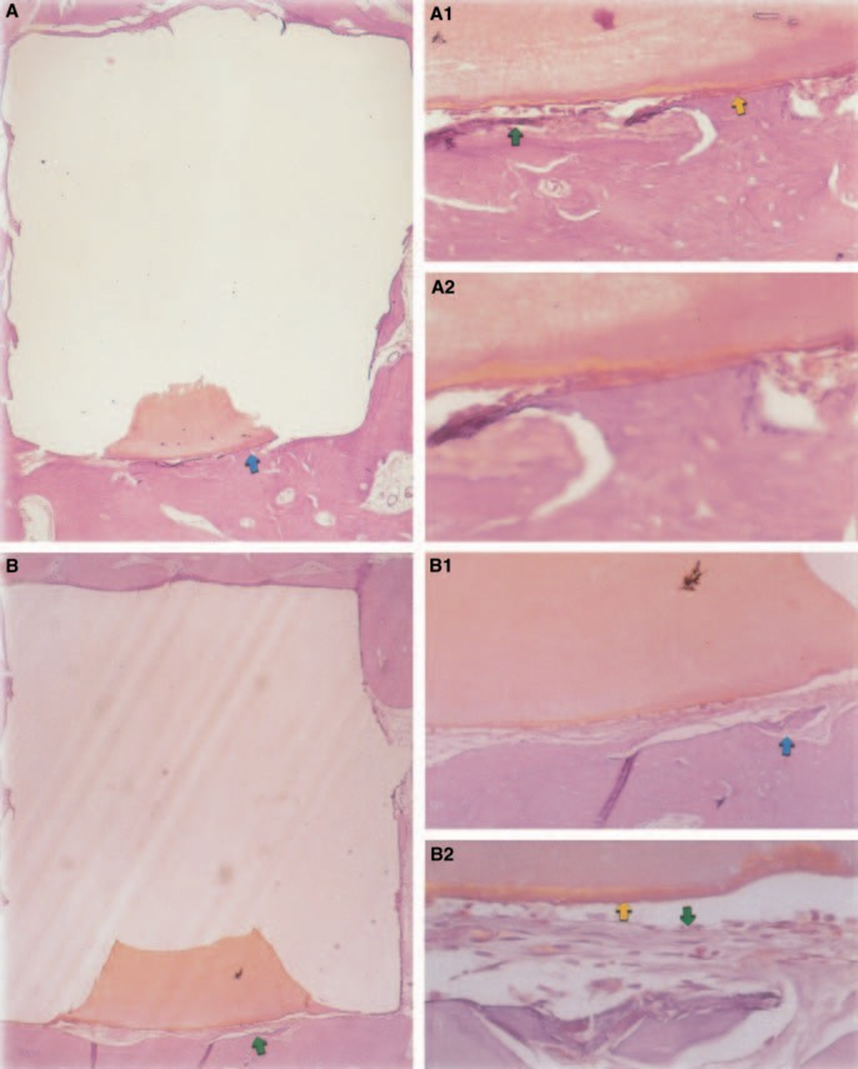
Відповідь сполучної тканини вздовж бічної стінки зовні чашок Teflon® всіх зразків слугувала негативним контролем для техніки. Борозни на зовнішній поверхні чашок були заповнені новою кістковою тканиною, і тонкі шари сполучної тканини без запальної реакції можна було спостерігати між чашкою та кісткою на всіх періодах спостереження у всіх зразках (Рис. 6A1,A2).
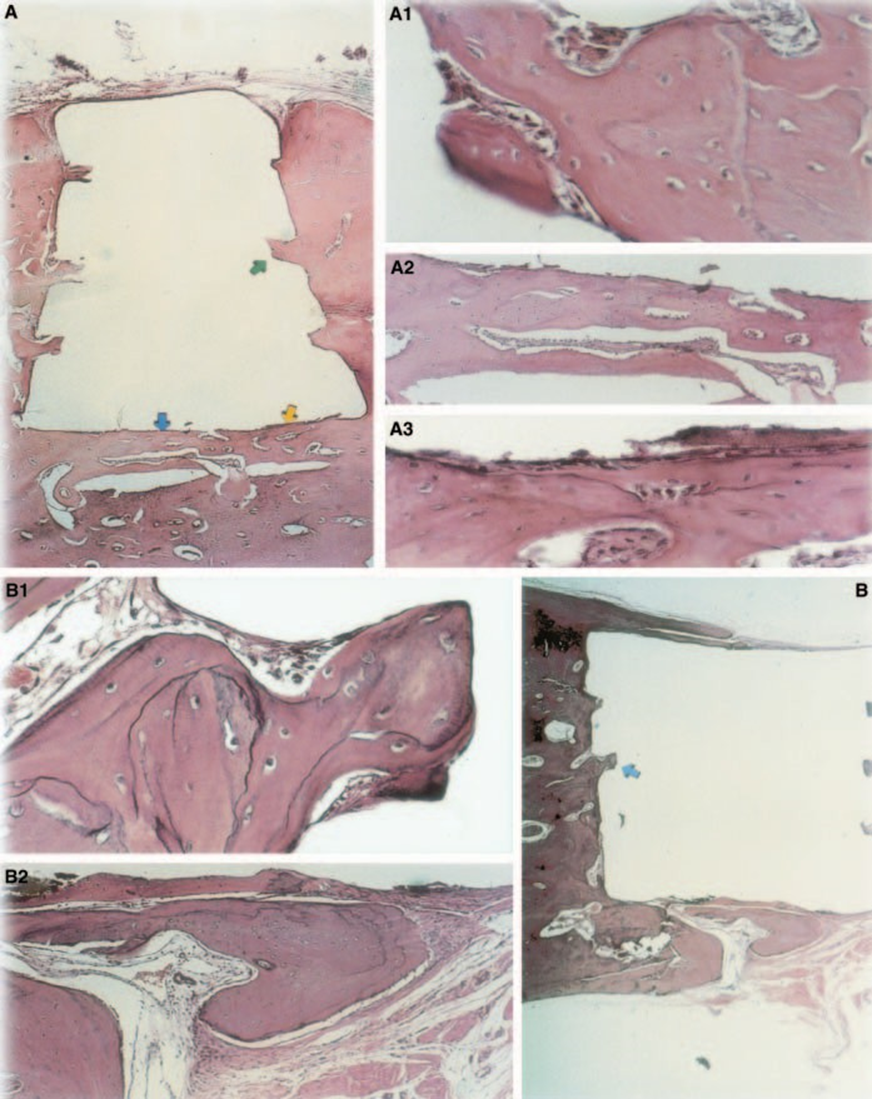
Оксид цинку-евгенол
Реакція була сильною з некрозом кістки, резорбцією, мононуклеарним запальним інфільтратом, що демонструється наявністю лімфоцитів, макрофагів та гігантських клітин чужорідного тіла (Рис. 1C). Наявність агломератів гігантських клітин чужорідного тіла, що містять матеріал у цитоплазмі, та некротичної тканини була поширеною (Рис. 1D). Було більше відкладення колагенових волокон ближче до кісткової тканини, ніж до матеріалу, і низька присутність запальних клітин (Рис. 1B).
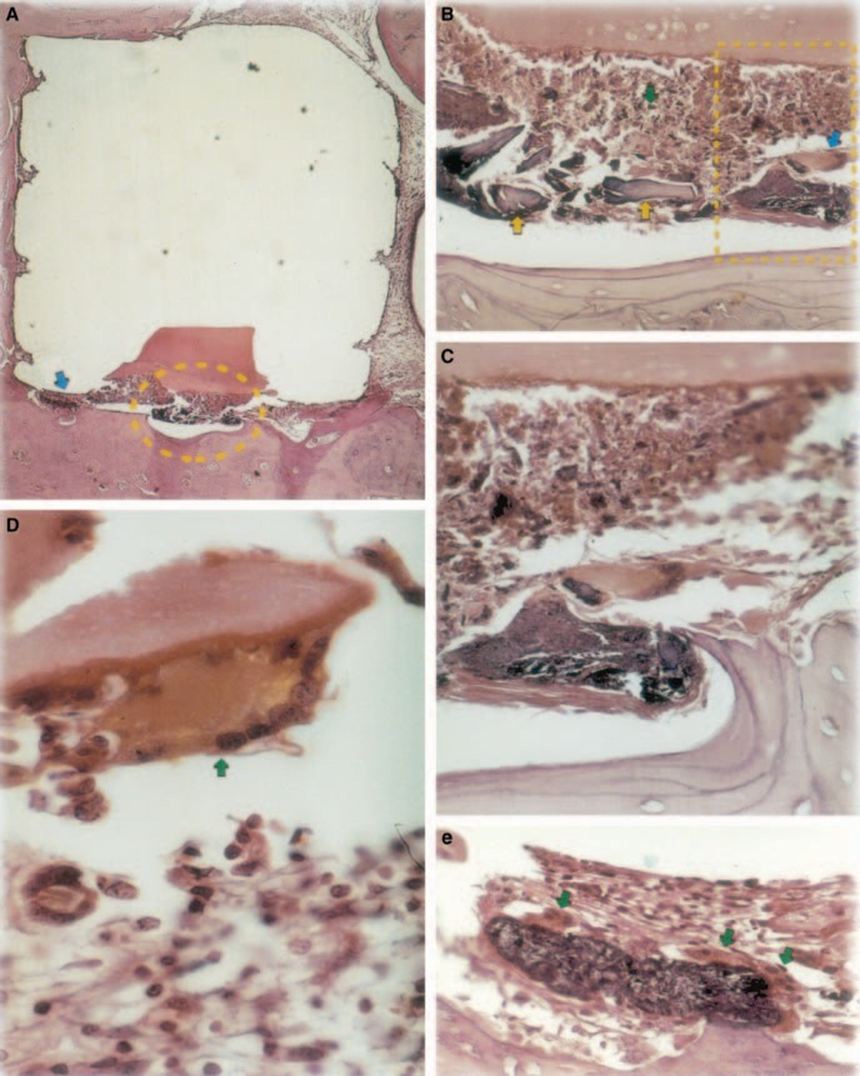
Мінеральний тріоксидний агрегат
Запальна реакція була класифікована як відсутня або незначна. Відбулося утворення здорової кістки в безпосередньому контакті з матеріалом (Рис. 3).
Z-100
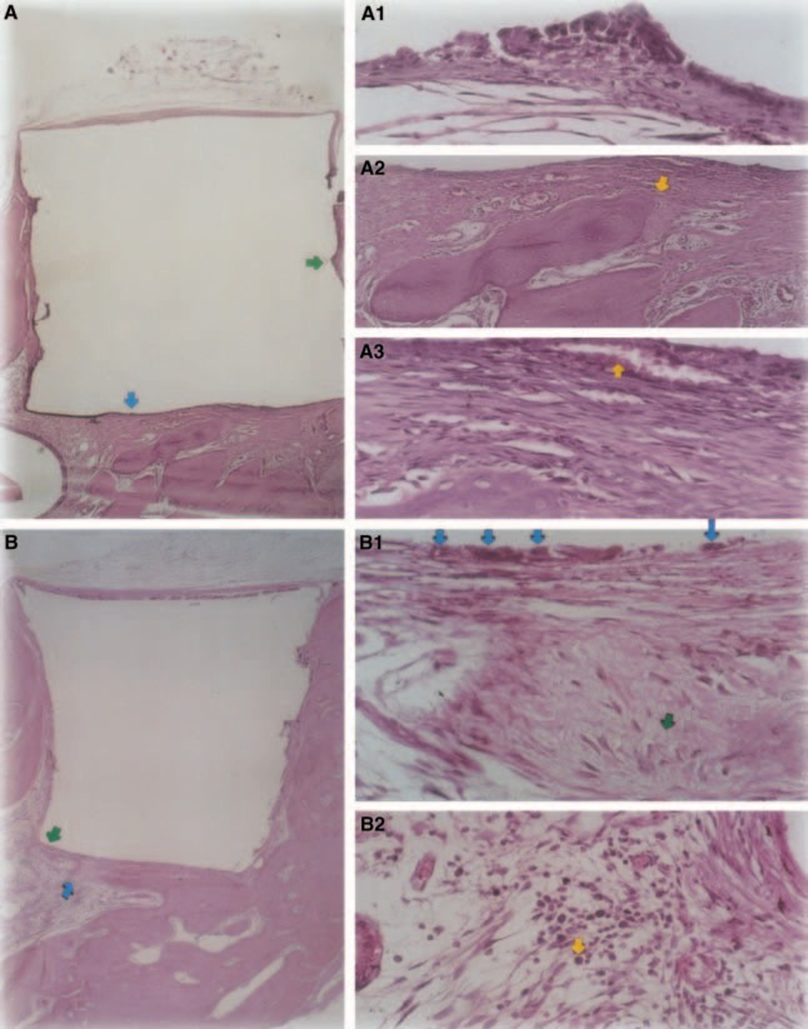
Спостерігалася легка до помірної запальна реакція з утворенням щільної сполучної тканини на межі матеріалу та кісткової тканини (Рис. 5A2,B1). Ця волокниста сполучна тканина була багата на фібробласти; судини, запального інфільтрату не спостерігалося, і було видно відкладення мінеральної тканини, що свідчить про утворення кістки (Рис. 5A3). Присутність макрофагів та гігантських клітин чужорідного тіла поблизу матеріалу була постійною знахідкою (Рис. 5A1,B1). Спостерігався помірний хронічний запальний інфільтрат поблизу матеріалу (Рис. 5B2).
Спостереження протягом дванадцяти тижнів
Негативний контроль
Відповідь сполучної тканини вздовж бічної стінки зовні чашок з тефлону® усіх зразків слугувала негативним контролем для техніки. Було можливим спостерігати, що борозни на зовнішній поверхні чашок були заповнені новою кістковою тканиною, і тонкий шар сполучної тканини без запальної реакції можна було побачити між чашкою та кісткою на всіх періодах спостереження у всіх зразках (Рис. 6A1,A2).
Оксид цинку-евгенол
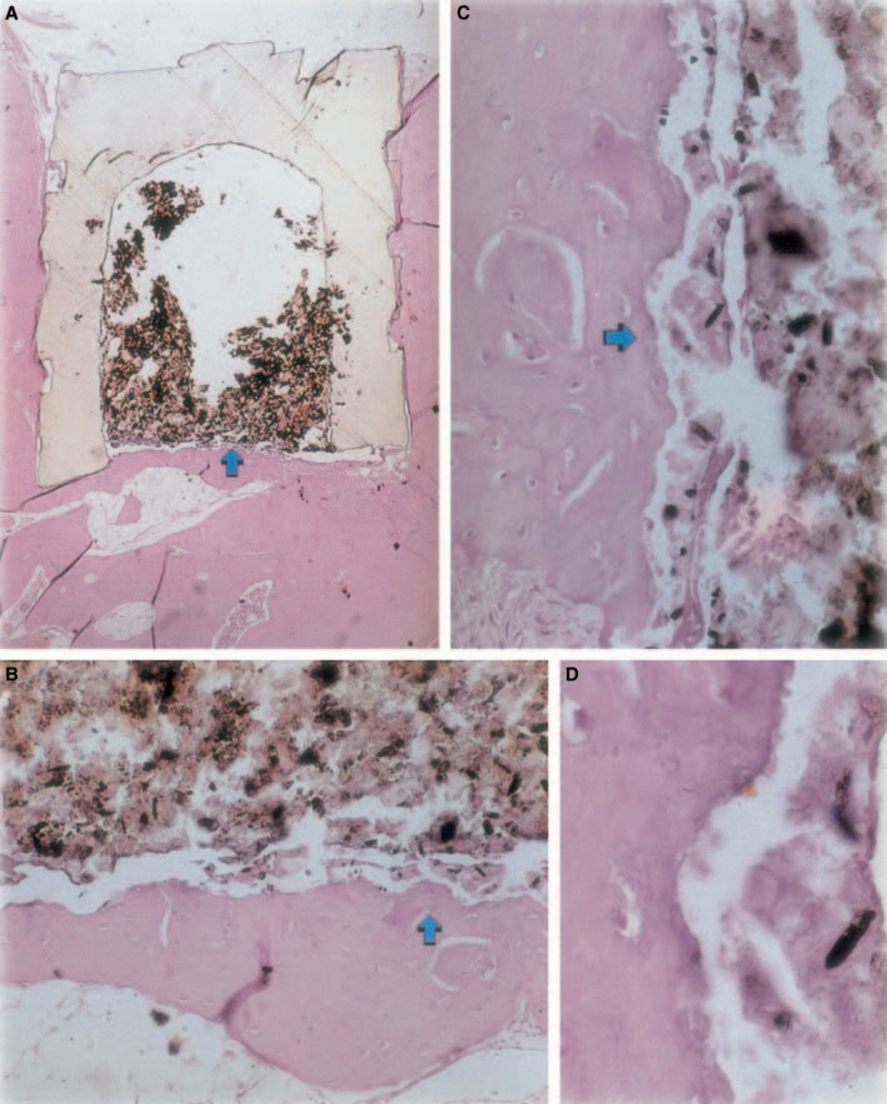
Запальна реакція варіювала від відсутньої до незначної протягом експериментального періоду. Відбувалося утворення кістки на інтерфейсі (Рис. 2A,B). Кістка навколо чашки була здоровою і повністю її покривала. У деяких випадках між імплантованим матеріалом та новою кістковою тканиною був вузький шар сполучної тканини (Рис. 2A1,A2,B1). Проте, деяка резорбція все ще була присутня (Рис. 2B2).
Мінеральний тріоксидний агрегат
Нова кісткова тканина утворилася на межі матеріал/тканина. Значної запальної реакції не спостерігалося, а коли вона була присутня, макрофаги та гігантські клітини чужорідних тіл знаходилися в периферійній зоні, в близькому контакті з чашкою з Тефлону®. Також спостерігалася здорова кістка, що містить остеобласти в близькому контакті з матеріалом (Рис. 4C).
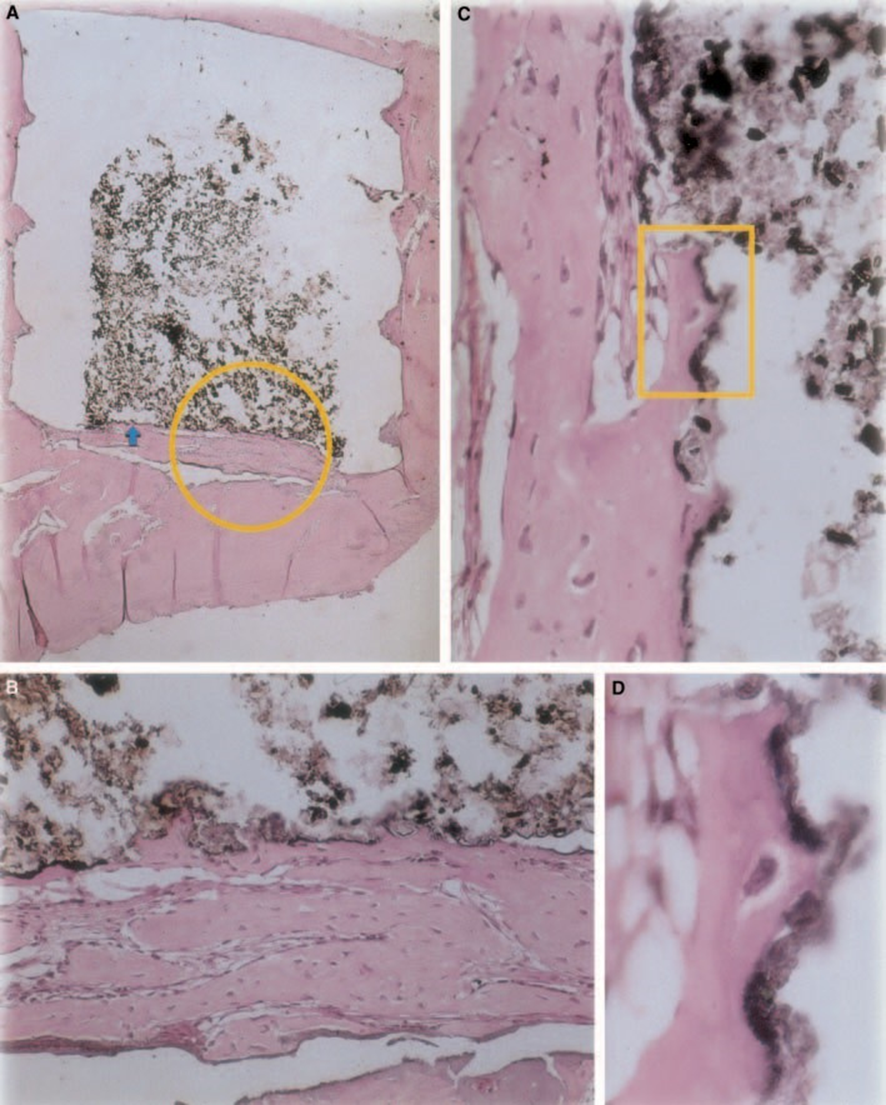
Z-100
Товщина сполучної тканини була значно зменшена на межі (Рис. 6A,B). Присутність запальних клітин була низькою, за винятком гігантських клітин чужорідного тіла (Рис. 6A3).
Обговорення
Біосумісність є однією з найважливіших властивостей матеріалу, що використовується для заповнення верхівки кореня, оскільки він постійно контактує з живими тканинами в періапікальному регіоні. Однією з цілей перірадикульної хірургії є створення бар'єру між періапікальним регіоном та будь-якими фізичними та/або бактеріальними агентами в системі кореневого каналу. Використання несумісного матеріалу для заповнення верхівки кореня заважатиме загоєнню в цій області. Матеріали, що використовуються для заповнення верхівки кореня, крім необхідних попередніх тестів, повинні мати досліджені характеристики біосумісності (Торабінеджад & Пітт Форд 1996).
Тест на імплантатах у кістковій тканині морської свинки, рекомендований FDI (1980), дозволяє тестувати матеріал у клінічному середовищі, підготовленому відповідно до рекомендацій виробника. Хоча результати не можуть бути безпосередньо екстрапольовані на людей, тест стандартизований і дозволяє безпосереднє порівняння між матеріалами. Література в цій галузі надає результати з різних лабораторій, що використовують однакові матеріали, щоб дані можна було порівнювати (Паскон та ін. 1987, Андреана та ін. 1989, Паскон & Лангеланд 1989, Барбоза та ін. 1993). Результати, отримані в цьому дослідженні, підтвердили висновки інших, що будь-який матеріал, що контактує з тканинами, викликає реакцію чужорідного тіла (Рис. 1D, 5B1 та 6A3).
Реакції вздовж зовнішньої периферії чашки з Тефлону® відображають травму, спричинену хірургічними процедурами, необхідними для введення Тефлону® та його вмісту. Сам Тефлон® викликає незначне подразнення в тканинах (Стенлі 1985) і використовувався як носій через свою біосумісність (Спонгберг 1969, ADA 1982). Це було підтверджено відсутністю запальних реакцій на бічній стінці носіїв на обох періодах спостереження.
Запальна реакція на ZOE була значно більшою, ніж на інші матеріали, на обох періодах спостереження (Рис. 1 та 2). Цю сильну реакцію на ZOE описано в літературі (Паскон & Лангеланд 1989, Гулаті та ін. 1991, Гійганд та ін. 1999). Також було продемонстровано, що будь-який матеріал, що містить еугенол, викликає сильну реакцію тканин через депресію клітинного дихання (Х'юм 1984). Серін та ін. (1988) виявили, що герметики ZOE активують комплементну систему і, таким чином, викликають запальну реакцію. Продовжена запальна реакція на ZOE відбувається через те, що реакція між матеріалом і тканинними рідинами врешті-решт вивільняє еугенол з матеріалу.
Представлені результати підтвердили висновки, повідомлені Торабінеджадом та ін. (1997, 1998) щодо запальної реакції на MTA (Рис. 3 та 4). Ці автори тестували цей матеріал у тибіях та щелепах морських свинок, а також як апікальне заповнення кореневого каналу у мавп, і повідомили про його біосумісність. Значної запальної реакції не спостерігалося.
Стабгольц та ін. (1985) представили композитні смоли як матеріали для апікального заповнення кореневого каналу та порівняли їх фізичні властивості з срібною амальгамою, Кавітом та фосфатом цинку. Однак у їхній роботі не було жодних занепокоєнь щодо реакції тканин. Коли смоли використовувалися як апікальні матеріали, результати варіювалися від сильної запалення (Брюс та ін. 1993) до високого ступеня загоєння (Руд та ін. 1991).
Результати цього дослідження подібні до результатів Руда та ін. (1991), які припустили, що композити мають обнадійливу біосумісність. Хоча це було звичайне спостереження, ріст кістки в безпосередньому контакті з Z-100 відбувався, ймовірно, внаслідок його низького ступеня токсичності (Рис. 6A2,B2).
Висновки
- Рівень токсичності протестованих матеріалів зменшувався з часом.
- Цемент на основі ZOE був дуже токсичним протягом 4-тижневого експериментального періоду, але цей профіль значно змінився після 12 тижнів, коли він показав біосумісні характеристики.
- Усі досліджені матеріали, за винятком ZOE, продемонстрували прийнятні рівні біосумісності в обох проаналізованих періодах.
- MTA продемонстрував відмінні біологічні якості з ростом кістки в безпосередньому контакті з матеріалом і без проміжної сполучної тканини.
- MTA та Z-100 вказали на біосумісність у цьому вторинному тесті.
Автори: C. J. A. Sousa, A. M. Loyola, M. A. Versiani, J. C. G. Biffi, R. P. Oliveira, E. A. Pascon
Посилання
- ADA (1982) Біологічна оцінка стоматологічних матеріалів. Американська стоматологічна асоціація, Нью-Йорк, Документ № 41.
- Andreana S, Pascon EA, Langeland K (1989) Реакція кісткової тканини на гемофібрини [Анотація]. Журнал стоматологічних досліджень 68, 381.
- Barbosa SV, Araki K, Spångberg LS (1993) Цитотоксичність деяких модифікованих герметиків для кореневих каналів та їх вивільнюваних компонентів. Оральна хірургія, оральна медицина та оральна патологія 75, 357–61.
- Bruce GR, McDonald NJ, Sydiskis RJ (1993) Цитотоксичність матеріалів для ретрофілінгу. Журнал ендодонтії 19, 288–92.
- FDI (1980) Рекомендовані стандартні практики для біологічної оцінки стоматологічних матеріалів. Міжнародна стоматологічна федерація, Лондон, Технічний звіт № 9.
- Gartner AH, Dorn, SO (1992) Досягнення в ендодонтичній хірургії. Стоматологічні клініки Північної Америки 36, 357–78.
- Guigand M, Pellen-Mussi P, LeGolff A, Vulcain J-M, Bonnaure-Mallet M (1999) Оцінка цитосумісності трьох ендодонтичних матеріалів. Журнал ендодонтії 25, 419–23.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M (1991) Цитотоксичність евгенолу в герметику, що містить оксид цинку. Ендодонтія та стоматологічна травматологія 7, 181–5.
- Hume WR (1984) Вплив евгенолу на дихання та поділ людської пульпи, фібробластів миші та клітин печінки in vitro. Журнал стоматологічних досліджень 63, 1262–5.
- Pascon EA, Langeland K (1989) Цитотоксичність нового ендодонтичного герметика [Анотація]. Журнал стоматологічних досліджень 68, 244.
- Pascon EA, Spångberg L, Langeland K (1987) Цитотоксичність ендодонтичних герметиків [Анотація]. Журнал стоматологічних досліджень 66, 200.
- Pascon EA, Sousa CJA, Langeland K (2001) Біосумісність ендодонтичних матеріалів: цитотоксичність поліуретанової смоли, отриманої з касторової олії. Бразильський журнал ендодонтії 5, 5–12.
- Rud J, Munksgaard EC, Andreasen JO, Rud V, Asmussen E (1991) Ретроґрадне заповнення кореня композитом та агентом для зв'язування дентину. Частина 1. Ендодонтія та стоматологічна травматологія 7, 118–25.
- Serene TP, Vesely J, Boackle RJ (1988) Активація комплементу як можливий in vitro показник запального потенціалу ендодонтичних матеріалів. Оральна хірургія, оральна медицина та оральна патологія 65, 354–7.
- Spångberg L (1969) Біологічні ефекти матеріалів для заповнення кореневих каналів. Частина 7. Реакція кісткової тканини на імплантований матеріал для заповнення кореневих каналів у морських свинках. Одонто логічний часопис 77, 133–59.
- Stabholz A, Friedman S, Abed J (1985) Краєва адаптація ретроґрадних заповнень та її кореляція з герметичністю. Журнал ендодонтії 11, 218–23.
- Stanley HR (1985) Тестування токсичності стоматологічних матеріалів, 1-е видання. Майамі, Флорида, США: CRC Press.
- Tassery H, Pertot WJ, Camps J, Proust JP, Déjou J (1999) Порівняння двох місць імплантації для тестування інтраосальної біосумісності. Журнал ендодонтії 25, 615–8.
- Torabinejad M, Pitt Ford TR (1996) Матеріали для заповнення кореня: огляд. Ендодонтія та стоматологічна травматологія 12, 161–78.
- Torabinejad M, Pitt Ford TR, McKendry DJ, Abedi HR, Miller DA, Kariyawasam SP (1997) Гістологічна оцінка мінерального триоксидного агрегату як заповнювача кореня у мавп. Журнал ендодонтії 23, 225–8.
- Torabinejad M, Pitt Ford TR, Abedi, HR, Kariyawasam SP, Tang HM (1998) Реакція тканин на імплантовані матеріали для заповнення кореня в тибії та щелепі морських свинок. Журнал ендодонтії 24, 468–71.
