Порівняння біосумісності двох герметиків для кореневих каналів, імплантованих у підшкірну сполучну тканину щурів, in vivo
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання).
Мета. Оцінити підшкірну біосумісність 2 герметиків для кореневих каналів.
Дизайн дослідження. Для тестування герметиків для кореневих каналів Endométhasone та EndoREZ використовувалася підшкірна імплантаційна техніка, рекомендована Міжнародною стоматологічною федерацією (FDI). Ці матеріали були поміщені в тефлонові трубки діаметром 1 мм і довжиною 10 мм та імплантовані в 2 кишені, створені на спині 40 Calomys callosus гризунів, по 20 для кожного матеріалу. Біопсії тканин були зібрані та гістологічно досліджені через 15, 30, 60 і 90 днів після процедури імплантації. Загальний рівень запальної реакції тканин оцінювався як відсутній, незначний, помірний або тяжкий на інтерфейсі герметика та сполучної тканини на відкритих кінцях трубок. Реакція сполучної тканини вздовж бічної стінки зовні кожної трубки слугувала негативним контролем.
Результати. Тканинна реакція на Endométhasone зменшувалася з часом. Герметик EndoREZ був високотоксичним протягом усіх експериментальних періодів.
Висновок. Ендометазоновий герметик для кореневих каналів продемонстрував біосумісність протягом проаналізованих періодів, тоді як EndoREZ не показав біосумісної поведінки і викликав пізню гіперчутливу реакцію. (Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:e88-e94)
Успішна ендодонтична терапія залежить від правильних діагнозів, ефективного очищення, усунення інфекції та адекватної обтурації кореневих каналів. Реакція періапікальної тканини після лікування кореневих каналів може бути під впливом різних факторів, залежно від хімічної природи ендодонтичного герметика. В даний час у клінічній практиці використовуються герметики на основі смол, оксиду цинку-евгенолу, склоіономерів, силікону та гідроксиду кальцію. Герметики на основі смол набирають все більшої популярності, але дослідження показали, що деякі з цих герметиків мають токсичність і мутагенність. Незважаючи на велику різноманітність доступних герметиків, герметик для кореневих каналів, який має всі бажані фізичні та біологічні властивості, ще не знайдено. Біосумісність є однією з найважливіших властивостей матеріалів для заповнення кореневих каналів8, оскільки вивільнення певних речовин герметиками може викликати різні реакції в періапікальних тканинах. Реакції тканин, викликані ендодонтичними матеріалами, зазвичай досліджуються гістологічними дослідженнями після імплантації матеріалу в тканини тварин. Ендометазон (Spécialities Septodont, Сен-Мор-де-Фосе, Франція) є герметиком на основі оксиду цинку-евгенолу, який раніше оцінювався в різних дослідженнях щодо його біологічних властивостей. Нещодавно був представлений новий ендодонтичний герметик на основі метакрилату, EndoREZ (Ultradent Products Inc., Південний Джордан, Юта, США), і його біологічні властивості були мало досліджені.
Метою цього дослідження було оцінити реакцію підшкірної сполучної тканини на герметики кореневих каналів EndoREZ та Endométhasone відповідно до вимог, рекомендованих FDI.
Методи
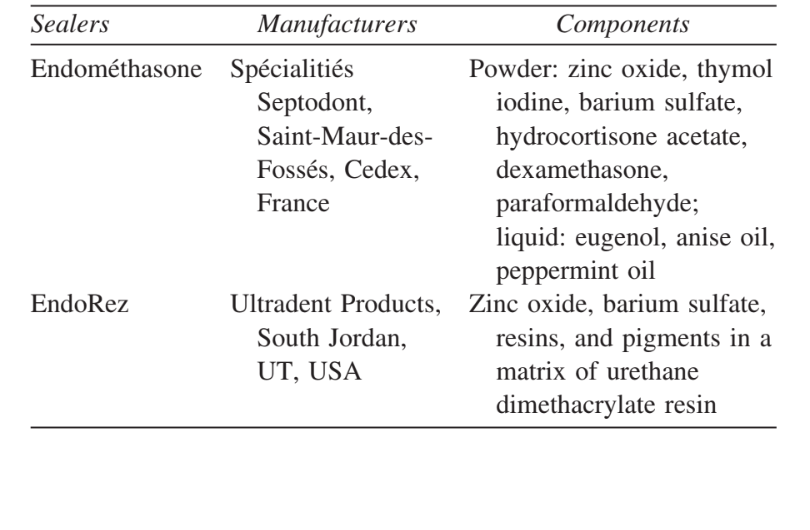
Протокол цього експерименту був затверджений Комітетом з етики досліджень Університету Уберландії, і експеримент проводився відповідно до Політики Служби охорони здоров'я США щодо гуманного догляду та використання лабораторних тварин. Було використано сорок самців Calomys callosus (Rodentia, Cricetidae), вагою від 150 до 200 г. Зразки були розділені на 2 групи по 20 тварин у кожній для герметиків Endométhasone та EndoREZ. Таблиця I показує матеріали, виробників та основні компоненти.
Всі матеріали були підготовлені відповідно до рекомендацій виробників для їх клінічного використання та завантажені в автоклавовані тефлонові носії (політетрафлуороетилен, Du-Pont, Habia, Knivsta, Швеція), довжиною 10 мм з одним просвітом і внутрішнім діаметром 1 мм, що забезпечувало відсутність повітря.
Тварини були анестезовані інтраперитонеально 0.2 мл кетаміну з додаванням ацеPROMAZINE у співвідношенні 1:1. Спина була поголена, дезінфікована 5% настоянкою йоду, і були зроблені невеликі розрізи, приблизно 15 мм завдовжки, з обох боків спини. Два окремі кишені були створені тупим дисекційним методом для імплантації трубок у підшкірну тканину на глибину ~15 мм. Трубки, що містили свіжозмішані герметики, були поміщені в праву та ліву кишені, підготовлені в кожній тварині. Було вжито заходів, щоб запобігти витоку матеріалів у тканину. Після імплантації рани були зашиті.
Тварини були вбиті групами по 5 після 15, 30, 60 та 90 днів шляхом задушення вуглекислим газом, що забезпечувало мінімальний дискомфорт і страждання. Трубки були видалені разом зі шкірою та сполучною тканиною навколо них. Зразки були занурені в 10% формалін у 0.1 моль/л фосфатно-буферному розчині на 24 години, дегідратовані в градуйованих етанолових розчинах при кімнатній температурі та вмонтовані в гліколевий метакрилат (Historesin; Leica Microsystems, Nussloch GmbH, Німеччина). Для перерізання блоки були орієнтовані паралельно до довгої осі трубки. Зрізи були нарізані товщиною 3 мкм і пофарбовані 1% толуїдиновим синім. Гістологічні зрізи були проаналізовані при різних збільшеннях під світловим мікроскопом, відзначаючи реакції тканин на інтерфейсі герметика та сполучної тканини на відкритих кінцях трубок. Реакція сполучної тканини вздовж бічної стінки зовні трубок слугувала негативним контролем.
Інтерфейс на відкритті чашки між матеріалом і кісткою був досліджений і оцінений за інтенсивністю запалення. Оцінка критеріїв Fédération Dentaire International (FDI) є виключно якісною, і жоден оцінювальний індекс не використовувався. Таким чином, загальний рівень реакції тканини оцінювався як відсутній, незначний, помірний або важкий, залежно від наявності або відсутності нейтрофільних лейкоцитів, макрофагів, лімфоцитів, плазматичних клітин, гігантських клітин чужорідного тіла, розсіяного матеріалу, капсули, новоутвореної здорової кістки, некротичної тканини та резорбції. Загальний рівень запальної реакції тканини оцінювався наступним чином: 1) відсутній/незначний: товщина зони реакції подібна до або лише трохи ширша за товщину вздовж бічної трубки, з відсутніми або кількома запальними клітинами; 2) помірний: збільшена зона реакції, в якій присутні макрофаги, плазматичні клітини або обидва; і 3) важкий: збільшена зона реакції, в якій присутні макрофаги і плазматичні клітини, а також випадкові вогнища нейтрофільних гранулоцитів, лімфоцитів або обидва.
Інтерпретація результатів ґрунтувалася на наступних критеріях FDI: відсутність або незначна реакція на 2 та 12 тижнях є прийнятною; відсутність або незначна реакція на 2 тижні, яка збільшується до помірної або важкої реакції на 12 тижні, є неприпустимою; помірна реакція на 2 та 12 тижнях є неприпустимою; помірна реакція на 2 тижні, яка зменшується на 12 тижні, є прийнятною; і важка реакція в будь-який період є неприпустимою.
Результати
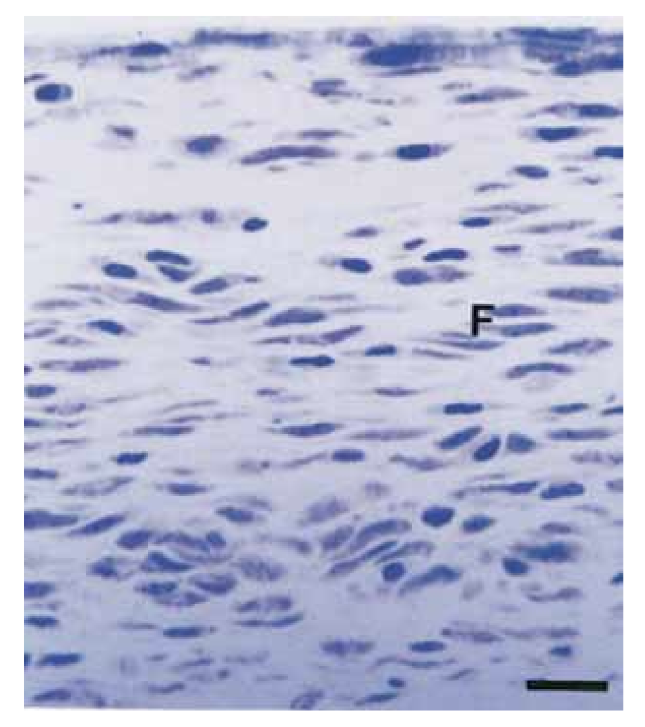
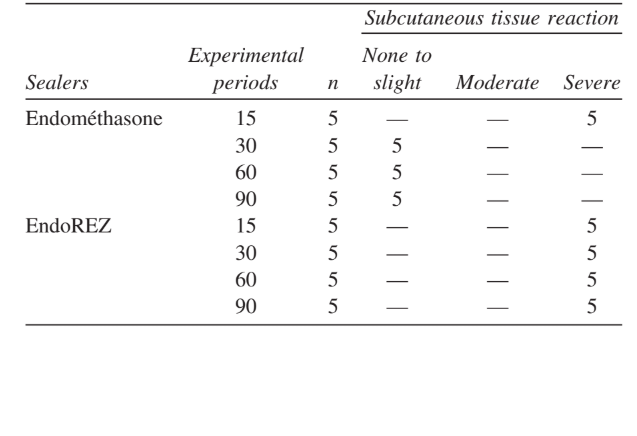
Інтенсивність запальної реакції в усіх експериментальних періодах обох герметиків була проаналізована. Реакція сполучної тканини вздовж бічної стінки зовні трубок Тефлону слугувала негативним контролем для техніки і не показала запальної реакції в усіх експериментальних періодах (Рис. 1). Кількість зразків у кожній запальній категорії в різні часові рамки для 2 типів герметиків представлені в Таблиці II.
Ендометазон
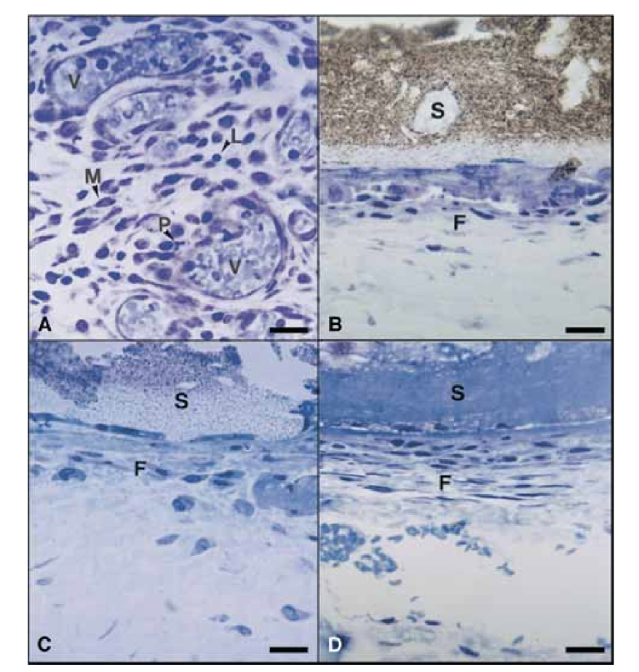
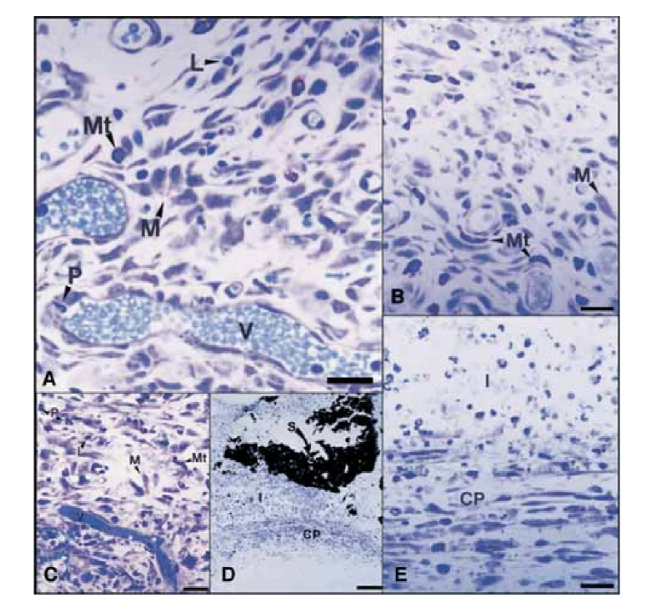
На 15-й день спостерігалася помірна до важкої запальна реакція. Тканина була інфільтрована переважно макрофагами та лімфоцитами. Також було виявлено наявність поліморфноядерних лейкоцитів, гіперемію та морфологічно змінену позаклітинну матрицю (Рис. 2, A). На 30-й, 60-й та 90-й дні сполучна тканина не показувала запальної реакції (Рис. 2, B, C та D).
EndoREZ
На 15-й день спостерігалася помірна до важкої запальна реакція. Тканина була інфільтрована переважно макрофагами, кількома поліморфноядерними лейкоцитами та лімфоцитами. Також спостерігалася гіперемія судин та зменшена і морфологічно змінена позаклітинна матриця (Рис. 3, A). З 30-го дня спостерігалася важка запальна реакція, і запальний інфільтрат, що складається переважно з поліморфноядерних лейкоцитів, лімфоцитів та макрофагів, почав вторгатися в просвіт тефлонових трубок. Крім того, на межі герметика та сполучної тканини спостерігалися кровоносні судини, оточені мастоцитами (Рис. 3, B). На 60-й день важка запальна реакція з макрофагами, лімфоцитами та поліморфноядерними лейкоцитами все ще зберігалася. На відкритті тефлонових трубок герметик був замінений запальним інфільтратом, в якому переважали макрофаги та лімфоцити. Спостерігалися конгестовані кровоносні судини, оточені мастоцитами (Рис. 3, C). Також було виявлено послідовну фібробластичну проліферацію, що оточує запальну тканину. На 90-й день спостерігався важкий запальний інфільтрат, що складається з макрофагів, лімфоцитів, поліморфноядерних лейкоцитів, червоних клітин та мертвих клітин, які інвагінували в просвіт тефлонових трубок, замінюючи герметик. На відкритому кінці трубок гранулематозна тканина була обмежена фіброзною капсулою (Рис. 3, D та E).
Обговорення
Коли новий матеріал вводиться на ринок або існуючий матеріал пропонується для іншого застосування, його властивості повинні бути досліджені, а результати порівняні з іншими авторами. У Сполучених Штатах відповідальність за оцінку та оцінювання біологічних ефектів усіх лікарських засобів, матеріалів і пристроїв, що використовуються у людях, включаючи більшість стоматологічних продуктів і пристроїв, несе Управління з контролю за продуктами і ліками (FDA). FDA також забезпечує визнання стандартів, встановлених приватними організаціями, такими як ANSI/ADA. Перегляд перших опублікованих Рекомендованих стандартних практик для біологічної оцінки стоматологічних матеріалів був затриманий, щоб включити основні положення рекомендацій FDA. Цей новий документ не мав на меті заважати промисловому розвитку нових і покращених стоматологічних продуктів, вимагаючи надмірності в біологічних тестах, але в цю епоху занепокоєння щодо хімічних небезпек слід розробити профіль токсичності для всіх нових і покращених матеріалів, щоб отримати відповідні дані про безпеку та ефективність. Хоча жодна кількість експериментальних досліджень не може гарантувати абсолютну безпеку для будь-якої речовини, токсикологічні дослідження надають дані, на основі яких можна зробити розумні прогнози та передбачення щодо умов, за яких агент може бути безпечно використаний.
Хоча багато тестів, таких як цитотоксичність, гемоліз, тест Аме, трансформація клітин Стайлса, підшкірні та кісткові імплантації, сенсибілізація та ендодонтичне використання, перераховані для різних рівнів тестування, не всі з них є обов'язковими для кожного продукту. Необхідно прийняти рішення щодо того, які тести є релевантними. Початкові тести мають на меті надати профіль токсичності в біологічній системі, щоб виробник мав загальне уявлення про те, де знаходиться продукт. Для FDA регульовані пристрої поділяються на 3 класи, однак більшість стоматологічних пристроїв та апаратів не підлягають встановленню стандартів для попереднього ринкового дозволу. Іншими словами, іноді навіть базове тестування безпеки не є обов'язковим перед тим, як продукти можуть бути просунуті для клінічного використання.
Біосумісність стоматологічних матеріалів є важливою вимогою, оскільки токсичні компоненти, що містяться в цих матеріалах, можуть викликати подразнення або навіть дегенерацію навколишніх тканин, особливо коли випадково виводяться в перірадикулярні тканини. Підшкірна імплантація сполучної тканини у тварин є одним з найнадійніших методів оцінки біосумісності стоматологічних матеріалів, оскільки запальні реакції є характерною ознакою для всіх сполучних тканин. Дослідний гризун, схожий на мишу, Calomys callosus, зазвичай використовується для дослідження експериментальної інфекції та гуморальної імунної відповіді і був використаний у даному дослідженні завдяки своїй відтворюваності як встановлена модель, широко прийнята в літературі.
Зразки були вмонтовані в гліколевий метакрилат завдяки його перевагам у порівнянні з парафіном, таким як менша деформація, забезпечення тонких зрізів, які пропонують хорошу клітинну визначеність, можливість підготовки зрізів без видалення трубок та фарбування з хорошою якістю і малою кількістю технічних артефактів, що сприяє більш точній оцінці запальної реакції.
У даному дослідженні сполучна тканина вздовж бічної стінки слугувала негативним контролем і не проявляла запальних реакцій (Рис. 1), демонструючи біосумісність Тефлону та те, що запальна реакція на відкритті трубки була пов'язана з досліджуваним матеріалом.
Біологічні властивості Ендометазону, герметика для кореневих каналів на основі оксиду цинку–евгенолу (ZOE), були раніше вивчені щодо антибактеріальної активності, цитотоксичності та біосумісності тканин. Евгенол (4-алліл-2-метоксифенол) є екстрактом гвоздикової олії, широко використовуваним у стоматології як терапевтичний засіб, найчастіше як компонент цементу на основі оксиду цинку–евгенолу, що застосовується як основа або тимчасова пов'язка на дентині або як герметик для кореневих каналів. Було проведено кілька досліджень щодо гістопатологічного впливу герметиків для кореневих каналів на основі ZOE на тканини. Евгенол, що витікає з герметиків для кореневих каналів на основі ZOE, може брати участь у розвитку періапікальної запалення або продовженні вже існуючої періапікальної ураження.
У даному дослідженні запальні реакції підшкірної тканини на Ендометазон зменшувалися з часом, подібно до результатів, отриманих Капланом та ін., ймовірно, завдяки нейтралізації евгенолу, що вивільняється на початку, та місцевому вивільненню кортикостероїдів, таких як дексаметазон і гідрокортизон. Багато дослідників припустили, що подразнююча здатність герметиків на основі ZOE може бути в основному пов'язана з евгенолом і вторинно з іонами цинку. Евгенол може інгібувати функцію макрофагів і може впливати на запальні реакції в періапікальних тканинах. Параформальдегід було показано, що викликає алергічну реакцію та некроз сполучної тканини. Однак, незважаючи на високу концентрацію параформальдегіду в герметику Ендометазон, у даному дослідженні такі результати не були зафіксовані.
Нещодавно був представлений новий ендодонтичний герметик на основі метакрилату як герметик для кореневих каналів. EndoREZ є гідрофільним, двокомпонентним, хімічно затверджуваним матеріалом, що містить оксид цинку, сульфат барію, смоли та пігменти в матриці смоли уретан-діметакрилату.
Біологічні властивості EndoREZ були раніше досліджені щодо його цитотоксичності та біосумісності з тканинами. Дослідження, що стосуються біосумісності смолистих герметиків, показали помірну до важкої запальну реакцію. У даному дослідженні EndoREZ викликав важку запальну реакцію на всіх експериментальних періодах. Оскільки середня тривалість життя нейтрофіла поза кровоносною судиною становить 7 днів, наявність поліморфноядерних клітин на всіх експериментальних періодах свідчить про токсичну поведінку цього матеріалу. Використовуючи культури клітин, було продемонстровано, що EndoREZ стає більш цитотоксичним з часом експозиції та має значні цитотоксичні ризики при свіжому змішуванні. Реакція сполучної тканини на силіконові трубки, заповнені EndoREZ, імплантовані в підшкірну тканину щурів, показала важку реакцію, яка значно змінила свій профіль після 30 днів, з помірною реакцією після 3 місяців і відсутністю запалення після 4 місяців. Тим не менш, також було повідомлено, що у деяких тварин запальна реакція зберігалася на всіх експериментальних періодах. Вважалося, що після підшкірної імплантації свіжого EndoREZ компоненти, такі як цинк і барій, були в прямому контакті з тканиною і викликали важку початкову реакцію. На відміну від результатів даного дослідження, Zmener та ін. продемонстрували задовільну реакцію кісткової тканини на 60-денний період спостереження EndoREZ, імплантованого в тибії щурів. Повільний розпад герметика EndoREZ, ілюстрований дисперсним матеріалом, та подальша ендоцитоз макрофагами могли бути причиною такої стійкої хронічної запалення. Крім того, терапія кореневих каналів, проведена з пізніше конденсованими конусами гутаперчі в поєднанні з EndoREZ, здається, демонструє хороший загальний відсоток успіху після 14-24 місяців оцінки.
Крім того, у даному дослідженні було виявлено наявність багатьох мастоцитів у сполучній тканині, переважно в навколишній області кровоносних судин, на 30-й, 60-й та 90-й дні, що свідчить про пізню гіперчутливу реакцію на компоненти EndoREZ. Хоча пізня гіперчутлива реакція на ендодонтичні матеріали не є частим явищем, ці небажані системні реакції, які виникають частіше, ніж зазначено в літературі, не повинні бути проігноровані. Згідно з Брателем та ін., ендодонтичні матеріали можуть викликати пізню гіперчутливу реакцію навіть у субтоксичних концентраціях.
Висновок
Згідно з критеріями FDI, результати, отримані в даному дослідженні, дозволили зробити висновок, що герметик кореневих каналів Endométhasone продемонстрував біосумісність у проаналізовані періоди, тоді як EndoREZ не показав біосумісної поведінки та вказував на можливу пізню гіперчутливу реакцію.
Автори: Еділсон Жозе Зафалон, Марко Ауреліо Версіяні, Касіо Жозе Алвес де Соуза, Каміла Крістіан Гомес Мура, Паула Дечічі
Посилання:
- Бернат М, Сабо Й. Реакція тканин, ініційована різними герметиками. Int Endod J 2003;36:256-61.
- Буййягує С, Ватаха Дж. К, Локвуд ПЕ, Гальгано К, Голай А, Крейчі І. Цитотоксичність та герметичні властивості чотирьох класів ендодонтичних герметиків, оцінені за активністю сукцинатдегідрогенази та конфокальною лазерною скануючою мікроскопією. Eur J Oral Sci 2004; 112:182-7.
- Каплан АЕ, Ормаехеа МФ, Пікка М, Канзобре МС, Убіос АМ. Реологічні властивості та біосумісність ендодонтичних герметиків. Int Endod J 2003;36:527-32.
- Хауман Ч, Лав РМ. Біосумісність стоматологічних матеріалів, що використовуються в сучасній ендодонтичній терапії: огляд. Частина 2. Матеріали для заповнення кореневих каналів. Int Endod J 2003;36:147-60.
- Генчоглу Н, Туркмен Ч, Ахіскалі Р. Новий герметик для кореневих каналів на основі силікону (Roekoseal-Automix). J Oral Rehabil 2003;30:753-7.
- Зменер О, Банегас Г, Памейєр Ч. Реакція кісткової тканини на ендодонтичний герметик на основі метакрилату: гістологічне та гістометричне дослідження. J Endod 2005;31:457-9.
- Хуан ТХ, Ян ДжД, Лі Х, Као ЦТ. Оцінка біосумісності герметиків для кореневих каналів на основі епоксидної смоли in vitro. Biomaterials 2002;23:77-83.
- Озбас Х, Ялтырік М, Бігліч Б, Іссевер Х. Реакції сполучної тканини на компомери, композити та амальгами для заповнення кореневих каналів. Int Endod J 2003;36:281-7.
- Хо Й-Ц, Хуан Ф-М, Чанг Й-Ц. Механізми цитотоксичності евгенолу в людських остеобластах in vitro. Int Endod J 2006;39:389-93.
- Хауман Ч, Лав РМ. Біосумісність стоматологічних матеріалів, що використовуються в сучасній ендодонтичній терапії: огляд. Частина 1. Інтраканальні препарати та речовини. Int Endod J 2003;36:75-85.
- Сауса ЧД, Лойола АМ, Версіяні МА, Біффі ДжК, Олівейра РП, Паскон ЕА. Порівняльна гістологічна оцінка біосумісності матеріалів, що використовуються в апікальній хірургії. Int Endod J 2004;37:738-48.
- Тепель Дж, Дарвіш ель Саваф М, Хоппе В. Реакція запаленої періапікальної тканини на інтраканальні медикаменти та герметики для кореневих каналів. Endod Dent Traumatol 1994;10:233-8.
- Джероса Р, Менегазі Дж, Борін М, Каваллері Дж. Оцінка цитотоксичності 6 герметиків для кореневих каналів. J Endod 1995;21:446-8.
- Ваджрабхая Л, Сітісарн П. Багатошарові та монолayers культури клітин у тесті цитотоксичності герметиків для кореневих каналів. Int Endod J 1997;30:141-4.
- Братель Дж, Йонтелл М, Дальгрен У, Бергенгольц Г. Вплив герметиків для кореневих каналів на імунокомпетентні клітини in vitro та in vivo. Int Endod J 1998;31:178-88.
- Серпер А, Учер О, Онур Р, Етікан І. Порівняльні нейротоксичні ефекти матеріалів для заповнення кореневих каналів на сідничний нерв щурів. J Endod 1998;24:592-4.
- Ерсев Х, Шмальц Г, Байирлі Г, Швайкл Х. Цитотоксичні та мутагенні потенції різних матеріалів для заповнення кореневих каналів у еукаріотичних та прокаріотичних клітинах in vitro. J Endod 1999;25:359-63.
- Теллі Ч, Серпер А, Доган АЛ, Гуч Д. Оцінка цитотоксичності герметиків для кореневих каналів на основі кальційфосфату за допомогою тесту MTT. J Endod 1999;25:811-3.
- Хуан ФМ, Тай КВ, Чоу МЙ, Чанг ЙЦ. Цитотоксичність герметиків для кореневих каналів на основі смоли, оксиду цинку-евгенолу та гідроксиду кальцію на клітинах періодонтальної зв'язки людини та постійних клітинах V79. Int Endod J 2002;35:153-8.
- Шварце Т, Фідлер І, Лейхаузен Г, Геуртсен В. Клітинна сумісність п'яти ендодонтичних герметиків під час періоду затвердіння. J Endod 2002;28:784-6.
- Шварце Т, Лейхаузен Г, Геуртсен В. Довгострокова цитосумісність різних ендодонтичних герметиків за допомогою нової моделі кореневого каналу. J Endod 2002;28:749-53.
- Гомес БП, Педросо ЯА, Жасінто РК, Віанна МЕ, Ферраз КК, Заїя АА та ін. Оцінка антимікробної активності 5 герметиків для кореневих каналів in vitro. Braz Dent J 2004;15:30-5.
- Перассі ФТ, Фільйо ІБ, Берберт ФЛ, Карлос ІЗ, де Толедо Леонардо Р. Секреція фактора некрозу пухлин-альфа макрофагами перитонею мишей у присутності стоматологічних герметиків, Sealapex та ендометазону. J Endod 2004;30:534-7.
- Піццо Г, Джіамманко ГМ, Кумбо Е, Ніколозі Г, Галліна Г. Антибактеріальна активність ендодонтичних герметиків in vitro. J Dent 2006; 34:35-40.
- Зменер О. Реакція тканин на новий герметик для кореневих каналів на основі метакрилату: попередні спостереження в підшкірній сполучній тканині щурів. J Endod 2004;30:348-51.
- Зменер О, Памейєр Ч. Клінічна та рентгенографічна оцінка герметика для кореневих каналів на основі смоли. Am J Dent 2004;17:19-22.
- Лоу НП, Памейєр Ч, Норвал Г. Гістопатологічна оцінка герметика для кореневих каналів у підлюдських приматів [анотація]. J Dent Res 2001;80:654.
- Міжнародна стоматологічна федерація, Комісія стоматологічних матеріалів, інструментів, обладнання та терапії. Рекомендовані стандартні практики для біологічної оцінки стоматологічних матеріалів. Int Dent J 1980;30:140-88.
- Національні інститути здоров'я. Політика Служби охорони здоров'я США щодо гуманного догляду та використання лабораторних тварин, 2006. Доступно за адресою: http://grants.nih.gov/grants/olaw/references/phspol.htm.
- Національні інститути здоров'я. Політика Служби охорони здоров'я США щодо гуманного догляду та використання лабораторних тварин, уточнення щодо використання вуглекислого газу для евтаназії малих лабораторних тварин, 2006. Доступно за адресою: http://grants.nih.gov/grants/olaw/ Compilation_of_Guidance.doc.
- Стенлі ХР. Тестування токсичності стоматологічних матеріалів. 1-е вид. Майамі: CRC Press; 1985.
- Сауса ЧД, Монтес КРМ, Паскон ЕА, Лойола АМ, Версіяні МА. Порівняння біосумісності AH Plus, Endo-REZ та Epiphany герметиків для кореневих каналів. J Endod 2006;32:656-62.
- Хуан ФМ, Цай ЧХ, Ян СФ, Чанг ЙЦ. Індукція експресії генів інтерлейкіну-6 та інтерлейкіну-8 герметиками для кореневих каналів у людських остеобластах. J Endod 2005;31:679-83.
- Олссон Б, Слівковскі А, Ланґеланд К. Підшкірна імплантація для біологічної оцінки ендодонтичних матеріалів. J Endod 1981;7:355-67.
- де Олівейра Л, Боржес ММ, Леал РК, Ассреуй Дж, Клоетцель ДжК. Участь оксиду азоту в експериментальному Trypanosoma cruzi інфекції у Calomys callosus та швейцарських мишах. Parasitol Res 1997;83:762-770.
- Танісакі М, Огава К, Лапа СРЦ, Да Сілва ПМЦ, Ватанабе І. Морфометричне та високо роздільне скануюче електронне мікроскопічне дослідження Calomys callosus основного піднебінного нерва. Int J Morphol 2005;23:13-8.
- Дост КК, Сарайва Дж, Зентграф У, Монеці Н, Енгельс В, Албукерке С. Чи бере участь оксид азоту в толерантності Calomys callosus як резервуарного господаря до Trypanosoma cruzi інфекції? J Infect 2006;52:49-55.
- Таніваки НН, Андреолі ВК, Калабрезе КС, да Сілва С, Мортара РА. Порушення міофібрилярних білків у серцевому м'язі Calomys callosus, хронічно інфікованому Trypanosoma cruzi та лікуваному імуносупресивним агентом. Parasitol Res 2005;97:323-31.
- Мартінез М, Мілтон ФА, де Олівейра СА, де Ліма НФ, Сегателлі ТМ, Пінейро ПФ та ін. Ультраструктурні зміни на твердій піднебінній слизовій Calomys callosus після 120 днів експериментального хронічного алкоголізму. J Submicrosc Cytol Pathol 2005;37:59-65.
- Керролл ДС, Міллс ДжН, Монтгомері ДжМ, Бауш ДГ, Блейр ПД, Буранас ДжП та ін. Синдром легеневої хантавірусу в центральній Болівії: взаємозв'язки між резервуарними господарями, середовищем проживання та вірусними генотипами. Am J Trop Med Hyg 2005;72:42-6.
- Гомес-Фільйо ДжЕ, Гомес БП, Заїя АА, Новаес ПД, Соузу-Фільйо ФД. Гліколевий метакрилат: альтернативний метод для вбудовування підшкірних імплантатів. J Endod 2001;27:266-8.
- Паскон ЕА, Леонардо МР, Сафаві К, Ланґеланд К. Реакція тканин на ендодонтичні матеріали: методи, критерії, оцінка та спостереження. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1991;72:222-37.
- Голланд Р, Отобоні Фільйо ДжА, Бернабе ПФ, Нері МДж, де Соуза В, Берберт А. Вплив стану кореневого каналу на загоєння періодонту після хірургічної травми у собак. Endod Dent Traumatol 1994;10:77-82.
- Х'юме ВР. Вплив евгенолу на дихання та поділ клітин людської пульпи, фібробластів миші та клітин печінки in vitro. J Dent Res 1984;63:1262-5.
- Гулати Н, Чандра С, Агарвал ПК, Джайсвал ДжН, Сінгх М. Цитотоксичність евгенолу в герметику, що містить оксид цинку. Endod Dent Traumatol 1991;7:181-5.
- Нефф Т, Лейман Д, Джансонн BG. Оцінка цитотоксичності ендодонтичних герметиків, які піддавалися нагріванню перед тестом. J Endod 2002;28:811-4.
- Іоанніс К, Ніколаос Е. Порівняння біосумісності 2 герметиків для кореневих каналів, імплантованих у підшкірну сполучну тканину щурів. J Endod 1998;24:82-5.
- Ніколаос Е, Іоанніс К. Експериментальне дослідження біосумісності чотирьох герметиків для кореневих каналів та їх вплив на вміст цинку та кальцію в кількох тканинах. J Endod 1995;21:122-7.
- Сегура ДжД, Хіменес-Рубіо А. Вплив евгенолу на адгезію макрофагів in vivo до пластикових поверхонь. Endod Dent Traumatol 1998;14:72-4.
- де Олівейра Мендес СТ, Рібейро Собріньо АП, де Карвалью АТ, де Соуза Кортес МІ, Віейра ЛК. Оцінка цитотоксичності двох герметиків для кореневих каналів на активність макрофагів in vitro. J Endod 2003;29:95-9.
- Ді Феліче Р, Ломбарді Т. Некроз ясен та щелепної кістки, викликаний пастою, що містить параформальдегід. Endod Dent Traumatol 1998;14:196-198.
- Котран РС, Кумар В, Роббінс СЛ. Патологічна основа хвороби: клітинні події. 5-е вид. Філадельфія: Saunders; 1994.
- ель Сайед Ф, Сейт-Беллеза Д, Санс Б, Байле-Лебе П, Маргюері МС, Базекс Ж. Контактна кропив'янка від формальдегіду в стоматологічній пасті для кореневих каналів. Contact Dermatitis 1995;33:353.
- Ебнер Х, Крафт Д. Анафілактична реакція, викликана формальдегідом, після стоматологічного лікування? Contact Dermatitis 1991;24:307-9.

/social-network-service/media/default/6758/89a8282e.png)