Кореляційний бактеріологічний та мікрокомп'ютерний томографічний аналіз мезіальних каналів нижніх молярів, оброблених саморегульованими файлами, рециркуляційними та скрученими системами файлів
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Вступ: Це ex vivo дослідження оцінювало дезінфікуючу та формуючу здатність 3 протоколів, що використовуються для підготовки мезіальних кореневих каналів нижніх молярів за допомогою кореляційного бактеріологічного та мікро-комп'ютерного томографічного (мКТ) аналізу.
Методи: Мезіальні канали видалених нижніх молярів були забруднені Enterococcus faecalis протягом 30 днів і розподілені на 3 групи залежно від їх анатомічної конфігурації, визначеної за допомогою мКТ аналізу відповідно до техніки підготовки (Self-Adjusting File [ReDent-Nova, Ra’anana, Israel], Reciproc [VDW, Munich, Germany] та Twisted File [SybronEndo, Orange, CA]). У всіх групах використовувався 2.5% NaOCl як іригант. Зразки каналів були взяті до (S1) та після інструментування (S2), і бактеріальну кількість було визначено за допомогою культури. Далі мезіальні корені піддавалися додатковому мКТ аналізу для оцінки формування каналів.
Результати: Усі протоколи інструментування сприяли значному зменшенню внутрішньоканальних бактерій (P< .001). Порівняння міжгрупових кількісних та якісних показників не виявило значних відмінностей між групами (P> .05). Щодо формування, статистично значущої різниці між техніками щодо середнього відсотка збільшення об'єму, збільшення площі поверхні, незробленої площі поверхні та відносної незробленої площі поверхні не спостерігалося (P> .05). Кореляційний аналіз не показав статистично значущого зв'язку між зменшенням бактерій та середнім відсотком збільшення проаналізованих параметрів (P> .05).
Висновки: Три системи інструментування мають подібну ефективність дезінфекції та формування під час підготовки мезіальних каналів нижніх молярів. (J Endod 2013;39:1044–1050)
Основними цілями хіміомеханічної підготовки є очищення та формування кореневого каналу. Хоча ці цілі відрізняються, вони досягаються одночасно під час підготовки за допомогою інструментів та іригантів. У заражених кореневих каналах також потрібна дезінфекція, і найкращий результат лікування зазвичай досягається, коли інфекцію в кореневому каналі ліквідовано або знижено до рівнів, сумісних з перірадикулярним загоєнням. Враховуючи, що залишкова інфекція є важливим фактором ризику для постлікувальної апікальної періодонтиту, хіміомеханічна підготовка відіграє ключову роль у лікуванні, оскільки вона діє механічно та хімічно на бактеріальні спільноти, що колонізують головний канал.
Кілька досліджень показали, що, незалежно від техніки інструментування та використаних інструментів/іригантів, хіміомеханічні процедури не здатні забезпечити ретельне очищення, дезінфекцію та формування кореневого каналу, особливо в вигнутіх каналах або випадках з незвичайною анатомією. Хоча головний канал та незначні анатомічні нерівності зазвичай враховуються під час підготовки, залишки тканин та бактерії, що присутні в інших областях, таких як істмуси, бічні канали та апікальні розгалуження, зазвичай залишаються неушкодженими під час підготовки через вроджені фізичні обмеження інструментів та короткий час перебування іригантів у кореневому каналі. Крім того, навіть області головного кореневого каналу виявилися незачепленими інструментами.
Щоб обійти такі обмеження та зробити очищення, дезінфекцію та формування більш передбачуваними, були розроблені модифікації інструментів і технік. Саморегульований файл (SAF) (ReDent-Nova, Раанана, Ізраїль) є прикладом модифікованого інструмента, який був розроблений для адаптації до основної анатомії кореневого каналу. Дослідження показали, що SAF сприяє підвищенню очищення, дезінфекції та формування в порівнянні з традиційними ендодонтичними інструментами. Рекомендується використовувати SAF як техніку з одним інструментом, і в цьому ж напрямку були представлені інші системи, такі як Reciproc (VDW, Мюнхен, Німеччина). На відміну від SAF, ці інструменти мають гвинтовий вал і не є суттєво відмінними від традиційних ротаційних інструментів, але пропонується їх використовувати в реверсивному русі. Дослідження показали, що техніки інструментування з одним файлом, що використовують ці гвинтові інструменти, можуть сприяти очищенню та формуванню, які порівнянні з інструментуванням повною серією ротаційних інструментів. Існує не так багато досліджень, які оцінюють дезінфікуючу здатність систем з одним файлом, але одне з недавніх досліджень не показало значних відмінностей у зменшенні внутрішньоканальних бактерій, викликаних Reciproc та повною серією інструментів, за умови, що об'єм іригаційних розчинів та час іригації залишалися подібними.
Мікро-комп'ютерна томографія (мКТ) широко використовується для оцінки ex vivo здатності інструментів і технік до формування. МКТ-обстеження пропонує неінвазивну відтворювальну техніку для 3-розмірної (3D) оцінки системи кореневих каналів до і після підготовки, і може бути застосоване як кількісно, так і якісно. Використовуючи цю методологію, було показано, що велика площа стінок основного кореневого каналу залишається неушкодженою після підготовки, незалежно від техніки інструментування або використаного інструменту. Внаслідок цього, бактеріальні біоплівки, що прилипли до стінок, можуть залишатися неушкодженими в цих регіонах. Для оцінки дезінфікуючої здатності інструментів, технік і іригантів широко використовувалася модель дезінфекції каналів ex vivo, яка використовувала видалені зуби з каналами, забрудненими Enterococcus faecalis. Хоча це дуже корисно для порівняння різних протоколів, ця експериментальна модель надає інформацію про бактеріальну стійкість, але місце постійної інфекції не може бути визначене. Мікроскопія могла б бути додана для цього аналізу, але її руйнівна природа виключає аналіз кореневого каналу до інструментування. Більше того, оскільки вона не надає 3D зображення, якість підготовки не може бути оцінена. Метою цього ex vivo дослідження було оцінити дезінфікуючу та формуючу здатність 3 протоколів інструментування, що використовуються для підготовки мезіальних кореневих каналів видалених нижніх молярів за допомогою кореляційного бактеріологічного та мКТ аналізу.
Матеріали та методи
Вибір та підготовка зразків
У цьому дослідженні використовувалися прямі або злегка вигнуті мезіальні корені нижніх молярів, видалених з причин, не пов'язаних з цим дослідженням. Схвалення протоколу дослідження було отримано від Етичного комітету Університету Естасіо де Са, Ріо-де-Жанейро, RJ, Бразилія. Зуби спочатку відбиралися на основі рентгенограм, зроблених у бічно-язиковому та мезіодистальному напрямках. У дослідження були включені лише зуби з 2 мезіальними каналами та без значних кальцифікацій. Підготовлені доступи, а також гемірезекція молярів виконувалася за допомогою алмазних дисків. Мезіальна секція (корінь і коронка) використовувалася в дослідженні. Куспід зменшувалися, поки всі зразки не досягли приблизно 13 мм в довжину. Мезіальні кореневі канали досліджувалися за допомогою файлів типу K розміру 08 і 10, і лише ті корені, які мали 2 незалежні апікальні отвори, були залишені в дослідженні.
Усі кореневі канали були оброблені на 1 мм за межами апікального отвору до файлу типу K розміру 20 у чергувальних обертових рухах під безперервним зрошенням водою. Це було виконано для стандартизації початкового діаметра кореневого каналу та створення місця для подальшого забруднення каналів. Шар змиву був видалений за допомогою 17% EDTA та 2,5% натрію гіпохлориту (NaOCl) для зрошення. NaOCl був інактивований 10% натрію тіосульфатом.
mCT аналіз кореневих каналів
Морфометрична оцінка кореневого каналу була проведена за допомогою mCT зображень. З початкової вибірки було випадковим чином обрано 18 зразків, висушено, закріплено на спеціальному кріпленні та відскановано за допомогою mCT сканера (SkyScan 1174v2; Bruker-microCT, Контіх, Бельгія) з ізотропним розділенням 16.7 мм. Сканування проводилося шляхом обертання на 180° навколо вертикальної осі з кроком обертання 1.0, використовуючи алюмінієвий фільтр товщиною 0.5 мм. Зображення кожного зразка були реконструйовані за допомогою спеціалізованого програмного забезпечення (NRecon v.1.6.3, Bruker-microCT), яке надавало аксіальні зрізи внутрішньої структури зразків. Програмне забезпечення CTAn v.1.12 (Bruker-microCT) використовувалося для 3D оцінки кореневого каналу щодо об'єму та площі поверхні. Об'єм був розрахований як об'єм бінаризованих об'єктів у межах об'єму інтересу. Для вимірювання площі поверхні використовувалися 2 компоненти поверхні: (1) периметри бінаризованих об'єктів на кожному зрізі та (2) вертикальні поверхні, які відкриваються через різницю пікселів між сусідніми зрізами. Програмне забезпечення CTVol v.2.2.1 (Bruker-microCT) використовувалося для візуалізації та якісної оцінки конфігурації системи кореневих каналів.
Зразки були підібрані трійками на основі анатомічної конфігурації кореневого каналу, оціненої за допомогою мКТ-іміджінгу. Один зразок з кожної трійки був випадковим чином призначений до однієї з трьох експериментальних груп. Після перевірки на нормальність (тест Шапіро-Уілка) було оцінено ступінь однорідності (базовий рівень) трьох груп щодо вищезазначених 3D параметрів за допомогою одностороннього аналізу дисперсії з рівнем довіри, встановленим на 5%. Потім для визначення, яка група зубів буде оброблена кожною з наступних технік підготовки кореневого каналу: SAF, Reciproc або Twisted File (TF; SybronEndo, Orange, CA), було використано підкидання монети.
Бактеріальне забруднення
18 мезіальних коренів, обраних за допомогою мКТ-скринінгу, були використані в кореляційному бактеріологічному/мКТ аналізі. Щоб зміцнити статистичну потужність бактеріологічного аналізу, також було включено ще 18 зразків, обраних на основі рентгенограм. Обидва мезіальні канали були використані в експерименті, в загальному 36 коренів (72 канали) для бактеріологічного аналізу (24 канали на експериментальну групу). П'ять мезіальних коренів були використані як контрольні: 3 для бактеріологічного експерименту та 2 для скануючої електронної мікроскопії.
Кореневі канали були заповнені свіжоприготованим бульйоном триптикази сої (Difco, Детройт, Мічиган), занурені в той же бульйон і піддані ультразвуковій обробці протягом 1 хвилини, щоб вивільнити затримане повітря та дозволити проникнення культурного середовища в нерівності кореневого каналу. Потім зразки зубів були стерилізовані в автоклаві. E. faecalis штам Американської колекції типових культур 29212 використовувався для забруднення кореневого каналу протягом 30 днів при 37°C під легким струшуванням, при цьому культурне середовище оновлювалося щотижня. Після періоду забруднення з усіх зубів стікало надлишкове культурне середовище, а їх зовнішня коренева поверхня витиралася стерильною марлею. Два зуби були зафіксовані в 10% буферному формаліні та оброблені для скануючої електронної мікроскопії, щоб підтвердити бактеріальну колонізацію кореневого каналу, як було описано раніше. Шість забруднених, але неінструментованих мезіальних каналів, які були промиті тими ж речовинами та обсягами, що й експериментальні групи, слугували позитивною контрольною групою.
Апікальні отвори кожного мезіального кореня були запечатані швидкотвердіючою епоксидною смолою, щоб запобігти апікальному бактеріальному витоку та створити закритий канал, який виробляє ефект парового замка. Зуби були встановлені вертикально до шийки в блоках, виготовлених з силіконового імпресійного матеріалу (President Jet; Coltène AG, Cuyahoga Falls, OH). Коронка зуба, включаючи стінки пульпної камери, та силіконова поверхня були дезінфіковані 2.5% NaOCl, після чого ця речовина була інактивована 10% натрію тіосульфатом. Далі робоча довжина (WL) була визначена шляхом введення файлу типу K розміру 10 в канал до досягнення апікального отвору, і початкові бактеріологічні зразки (S1) були взяті з усіх каналів перед підготовкою наступним чином. Кореневий канал був промитий 1 мл стерильного 0.85% розчину фізіологічного розчину для видалення неприкріплених клітин, і початковий зразок був взятий за допомогою послідовного використання 3-5 паперових точок, розміщених до робочої довжини.
Кожна паперова точка залишалася в каналі протягом 1 хвилини. Паперові точки були перенесені в трубки, що містять 1 мл стерильного фізіологічного розчину, і відразу ж оброблені для культурного аналізу.
Перед інструментуванням усі кореневі канали отримали початкову іригацію 2 мл 2,5% NaOCl, після чого було проведено корональне розширення за допомогою файлу RaCe розміру 25, конусність 0,08 мм/мм (BR0; FKG Dentaire, La Chaux-de-Fonds, Швейцарія). Далі кореневі канали знову іригуються 2 мл 2,5% NaOCl, і файл типу K розміру 15 був використаний до робочої довжини (WL) для підтвердження прохідності. Наступні етапи відрізнялися в залежності від кожної експериментальної групи.
Група SAF
Канали були інструментовані до WL за допомогою файлу RaCe розміру 25, конусність 0,04 мм/мм (FKG Dentaire). Після іригації 2 мл 2,5% NaOCl інструмент SAF був введений у канал і працював з рухом вгору-вниз до WL протягом загалом 3 хвилин. Використовувався SAF діаметром 1,5 мм у вібруючому ручному інструменті (GENTLEpower; KaVo, Біберах-ан-дер-Ріс, Німеччина), поєднаному з головкою RDT3 (ReDent-Nova) на частоті 5000 рухів на хвилину та амплітуді 0,4 мм. Протягом процедури проводилася безперервна іригація 2,5% NaOCl з швидкістю потоку 2 мл/хв (всього = 6 мл на канал) за допомогою спеціального іригаційного апарату (VATEA, ReDent-Nova).
Група Reciproc
Інструмент Reciproc R25 працював у реверсивному русі, який приводився в дію електричним мотором з обмеженням крутного моменту (VDW Silver) з використанням попередньо встановлених налаштувань. Інструмент вводився в канал до відчуття опору, після чого активувався. Він переміщувався в апікальному напрямку з рухами вгору-вниз з амплітудою близько 3 мм з легким апікальним тиском. Після 3 рухів інструмент був видалений і очищений, а канал був промитий 2 мл NaOCl. Прохідність каналу перевіряли, використовуючи файл типу K розміру 15 до робочої довжини (WL). Цей протокол повторювався до досягнення робочої довжини інструментом R25. Поливання проводилося за допомогою одноразових шприців та голок NaviTip 30-G (Ultradent, South Jordan, UT), які вводилися на 4 мм коротше робочої довжини.
Група TF
У цій групі кореневі канали готувалися за допомогою наступної послідовності інструментів TF: 25/0.08, 25/0.06 та 25/0.04 у методі "корона-вниз", працюючи на 500 об/хв, у безперервному обертовому русі за годинниковою стрілкою з мотором VDW Silver. Кожен інструмент вводився в канал під час обертання, поки не контактував з дентином. Потім його витягували, а канал промивали 2 мл NaOCl і перевіряли на апікальну прохідність за допомогою файлу типу K розміру 15. Поливання проводилося так само, як у групі Reciproc. Підготовка закінчувалася роботою з TF 25/0.06 на робочій довжині, а канал промивали 2 мл NaOCl.
Після завершення підготовки, шар забруднень був видалений шляхом промивання каналу 2 мл 17% EDTA протягом 1 хвилини, після чого використовували 2 мл 2.5% NaOCl. NaOCl був інактивований шляхом промивання каналу 1 мл 10% натрію тіосульфату, який залишався в каналі протягом 5 хвилин. Після ще одного промивання 1 мл натрію тіосульфату, був взятий бактеріологічний зразок після підготовки (S2), як описано для S1. У всіх групах загальний об'єм 14 мл 2.5% NaOCl використовувався на канал.
Кількісне визначення бактерій
Зразки були 10-кратне серійно розведені в фізіологічному розчині (до 10—5 в S1 та 10—3 в S2). Після цього, аліквоти по 100 мл були висіяні на агарні пластини Mitis-Salivarius (Difco) та інкубовані при 37°C протягом 48 годин. Кількість утворених колоній була підрахована, і було проведено видоспецифічну полімеразну ланцюгову реакцію для підтвердження ідентифікації E. faecalis у всіх позитивних зразках.
mCT аналіз підготовки кореневого каналу
Після хіміомеханічної підготовки та взяття S2, 18 зразків, відсканованих у першій частині цього дослідження, були автоклавовані, висушені та піддані новому mCT-скануванню з використанням тих самих параметрів. Накладення зображень до та після підготовки кореневих каналів було виконано за допомогою раніше валідаційного програмного забезпечення для реєстрації (Mosaic 0.05; Інститут комунікаційних та комп'ютерних систем, Афіни, Греція). Моделі кореневих каналів з кольоровим кодуванням (зелений вказує на передопераційні, а червоний - післяопераційні поверхні каналів) дозволили якісно порівняти відповідні кореневі канали до та після формування за допомогою програмного забезпечення CTVol v.2.2.1 (Bruker-microCT). Для аналізу об'єму та площі поверхні використовувався CTAn v.1.12 (Bruker-microCT).
Середній відсотковий приріст (%D) кожного проаналізованого параметра розраховувався наступним чином: ([Pa — Pb]/Pb)*100, де Pb та Pa — це загальний об'єм або площа поверхні кореневого каналу до та після підготовки відповідно. Просторово зареєстровані поверхневі моделі коренів, до та після підготовки, порівнювалися для оцінки відсотка залишкової непідготовленої площі поверхні. Ця змінна розраховувалася за допомогою відстаней між поверхнею кореневих каналів до та після підготовки, які були визначені в кожній точці поверхні.
Коли був присутній істмус, його відносний об'єм та площа оцінювалися. У цьому дослідженні істмус визначався як стрічкоподібна або тонка структура між 2 мезіальними кореневими каналами після підготовки. Його внесок у загальний об'єм та площу поверхні кореневого каналу визначався як відносний відсотковий об'єм (%RV) та відносна відсоткова площа поверхні (%RA) істмуса. %RV розраховувався наступним чином: ([Va — RV]/Vb)*100, де Vb та Va — це загальний об'єм кореневого каналу до та після підготовки відповідно, а RV (відносний об'єм) — це об'єм після підготовки без істмуса. %RA розраховувався за формулою (A — RA/A)*100, де A — це загальна площа поверхні кореневого каналу після підготовки, а RA — це площа поверхні підготовлених кореневих каналів без істмуса.
Статистичний аналіз
Для порівняння внутрішньогрупового зменшення кількості бактерій з S1 до S2 використовувався тест пар Уілкоксона. Крім того, міжгрупове порівняння було здійснено за допомогою тесту Крускала-Уолліса. Для цього було розраховано пропорцію S2/S1 для кожного каналу та використано для порівняння між групами. Розрахунок розміру вибірки показав, що 21 зразка на групу буде достатньо, щоб продемонструвати 5% різницю в пропорціях S2/S1 з потужністю 90%. Кожну експериментальну групу порівнювали з контрольною групою, використовуючи тест Манна-Уітні U . Для внутрішньогрупового та міжгрупового парного аналізу якісних даних (наявність/відсутність) використовувався точний тест Фішера.
У аналізі mCT, оскільки нормальність не могла бути перевірена (тест Шапіро-Уілка, P < .05), середній відсоток збільшення об'єму, збільшення площі поверхні, незготовленої площі поверхні, RV та RA порівнювалися між групами за допомогою тесту Крускала-Уолліса та всередині груп за допомогою парного t-тесту. Для перевірки зв'язків між зменшенням бактерій та середнім відсотком збільшення параметрів, проаналізованих за допомогою зображень mCT, використовувався кореляційний аналіз Пірсона. Статистичні аналізи проводилися за допомогою STATISTICA версії 8 (StatSoft, Талса, ОК) та SPSS версії 17.0 (SPSS Inc, Чикаго, ІЛ) з рівнем довіри, встановленим на 5%.
Результати
Аналіз за допомогою скануючої електронної мікроскопії показав, що E. faecalis колонізував стінки кореневих каналів, зазвичай формуючи структури, схожі на біоплівку (дані не показані). Колонізація кореневого каналу була додатково підтверджена позитивними результатами культури для зразків S1 з усіх зубів, використаних у експерименті з дезінфекцією каналу.
Таблиця 1 ілюструє середнє, медіану та діапазон кількостей колонієутворюючих одиниць (кількісні дані), спостережуваних для 3 тестових груп і контрольної групи. Експериментальні дані представлені для 18 зубів (36 каналів), які підлягали як бактеріологічному, так і мікрокомп'ютерному томографічному аналізу, а також для загалом 36 зубів (72 канали), які були бактеріологічно досліджені. З 18 зубів, які підлягали кореляційному аналізу, лише 7 (39%) показали негативну культуру для обох мезіальних каналів, незалежно від техніки (2 зуби з групи Reciproc, 2 з групи SAF і 3 з групи TF). Загалом, частота позитивних культур у S2 становила 6 з 24 (25%) для файлу Reciproc, 7 з 24 (29%) для SAF і 9 з 24 (37,5%) для TF. Внутрішньогруповий кількісний аналіз, що оцінює зменшення бактерій з S1 до S2 у всіх групах, показав, що хімічно-механічна підготовка за допомогою 3 систем інструментування сприяла значному зменшенню бактерій (P < .001). Значних відмінностей між групами не спостерігалося ні для кількісного, ні для якісного аналізу (P > .05). Усі техніки були значно кращими, ніж контрольна група (зрошення без інструментування) у зменшенні рівнів бактерій (P < .001).
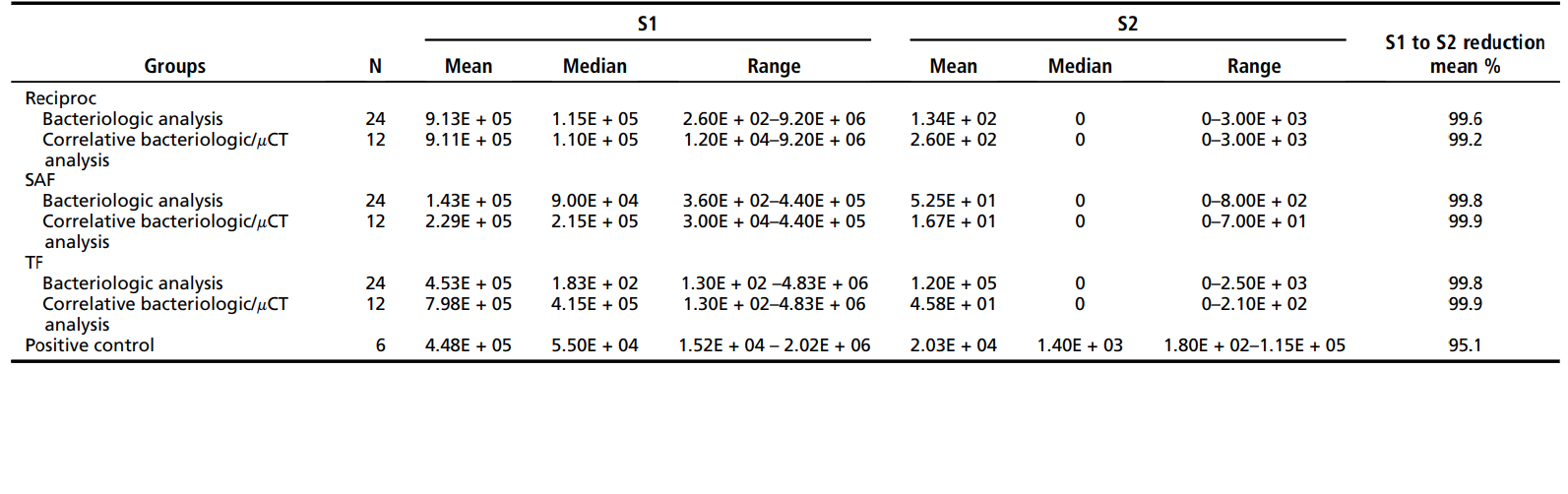
Таблиця 2 показує дані з аналізу mCT. Статистично значущої різниці між інструментами Reciproc, SAF та TF щодо середнього відсотка збільшення об'єму, збільшення площі поверхні та незробленої площі поверхні (P > .05) не спостерігалося. Внутрішньогруповий аналіз виявив статистично значущу різницю щодо об'єму та площі поверхні до і після підготовки кореневих каналів (P < .05). %RV та %RA перешийка в групах Reciproc, SAF та TF становили 22.9 ± 15.2 та 23.9 ± 16.2, 16.9 ± 16.51 та 17.5 ± 13.3, і 23.7 ± 16.3 та 23.7 ± 12.8 відповідно, без значущої статистичної різниці між групами (P > .05).
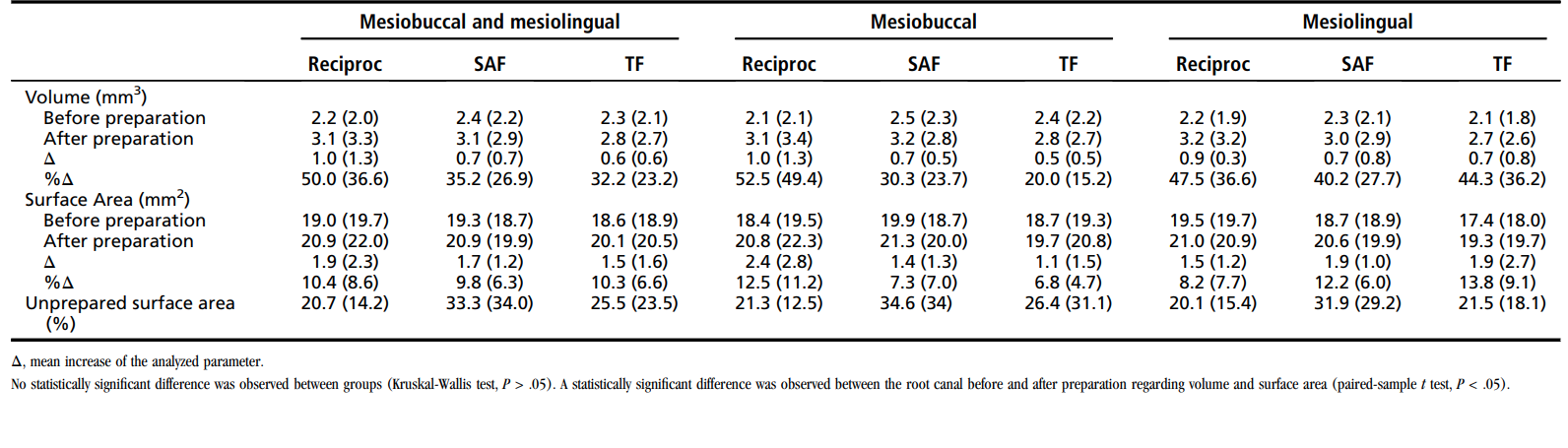
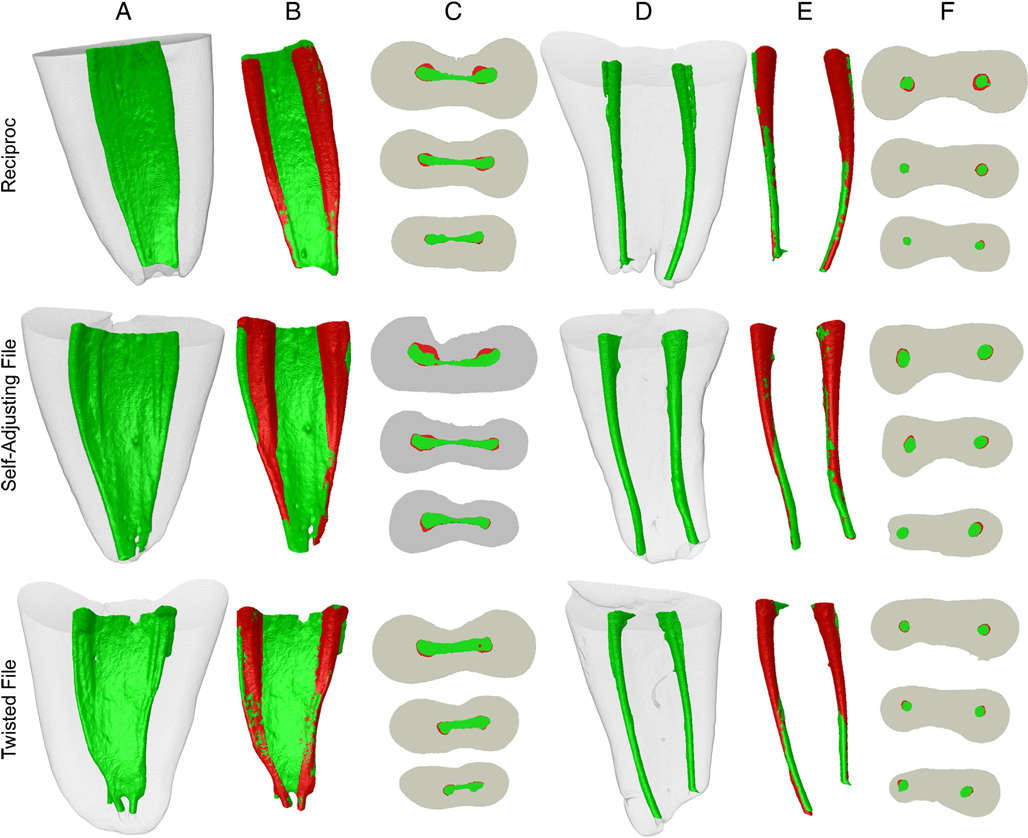
Рисунок 1A через F показує репрезентативні приклади накладених кореневих каналів до і після інструментування каналу в кожній групі. Зміни в формі каналу показані як накладення непідготовлених (зелених) і підготовлених (червоних) ділянок. Червоний показує накладені ділянки. У всіх групах було більше неушкоджених ділянок, головним чином на істмі і апікальній третині каналу. Жодна з систем інструментування не змогла підготувати всі поверхневі ділянки кореневого каналу. Кореляційний аналіз не показав статистично значущого зв'язку між зменшенням бактерій і середнім відсотковим збільшенням проаналізованих параметрів (P > .05).
Обговорення
Протокол даного дослідження був розроблений для проведення порівняльного аналізу здатності трьох технік інструментування у формуванні та дезінфекції мезіальних кореневих каналів нижніх молярів. Для цього здатність формування оцінювалася за допомогою mCT-аналізу тих самих зубів, які підлягали бактеріологічному аналізу.
Інновацією даного дослідження стало використання mCT-скринінгу для адекватного відбору зубів для ex vivo тесту дезінфекції каналів. Попередні дослідження відбирали зуби на основі зовнішньої анатомії та рентгенограм, зроблених у мезіодистальному та буколінгвальному напрямках. Вибираючи зуби на основі внутрішньої анатомії, що виявляється за допомогою mCT-скринінгу, очікується кращий розподіл зразків серед груп, що усуває потенційно значні упередження, які можуть вплинути на результати. Вимірювання об'єму та площі поверхні кореневого каналу не використовувалися в цьому дослідженні для відбору зубів та розподілу серед груп і були б цікавими додатковими даними для майбутніх досліджень. Однак ці фактори не виявилися такими, що впливають на результати, як показано статистично.
Бактеріологічний аналіз показав, що хемомеханічна підготовка з трьома різними системами була статистично однаково ефективною у сприянні значному зменшенню кількості бактерій у каналі. Однак у багатьох випадках після інструментації все ще були виявлені бактерії. Частота позитивних культур у зразках S2 (якісний аналіз) коливалася від 25% (група Reciproc) до 37,5% (група TF), що узгоджується з попередніми ex vivo та in vivo дослідженнями. Варто зазначити, що більшість попередніх досліджень базувалися на каналах однокореневих зубів, тоді як у даному дослідженні використовувалися мезіальні корені нижніх молярів, які, як очікується, мають вищу анатомічну складність. Поточні результати підтверджують, що хоча хемомеханічна підготовка може вважатися основним етапом у контролі інфекцій, цього може бути недостатньо для передбачуваного дезінфікування кореневих каналів, незалежно від використаних інструментів. Залишкові бактерії, ймовірно, знаходяться в непідготовлених ділянках і западинах основного каналу, а також в істмусах і інших нерівностях системи каналу. Основним терапевтичним викликом є досягти і знищити їх у цих місцях.
Техніки однофайлового підходу нещодавно були рекомендовані для підготовки кореневих каналів, а нові інструменти були запущені переважно на основі думки та зручності, а не доведеної ефективності. Однак було показано, що формування та дезінфекційні можливості цих систем порівнянні з традиційними, що використовують повний спектр інструментів. Ці висновки були підтверджені в даному дослідженні як для дезінфекції, так і для формування.
Система SAF також є підходом з використанням одного інструмента, але дизайн інструмента та принцип дії абсолютно відрізняються. Інструмент розроблений для адаптації до морфології кореневого каналу в перетині. Відповідно, результати SAF у плані очищення, формування та дезінфекції каналів, які є вигнутими та/або нерегулярними в перетині, виявилися кращими, ніж у традиційних інструментів. Проте результати даного дослідження в мезіальних каналах молярів не показали кращих результатів для SAF ані в здатності формування, ані в антибактеріальній ефективності. Слід зазначити, що SAF працював протягом 3 хвилин у каналі. Хоча попереднє дослідження повідомляло, що система SAF сприяла значному зменшенню бактеріальних популяцій в овальних каналах різців та премолярів навіть після лише 2 хвилин роботи, найвражаючі результати були отримані після 6 хвилин. Чи покращаться ефекти SAF у мезіальних каналах після тривалішого часу роботи, ще потрібно дослідити.
Мезіальний корінь нижніх молярів має високий ступінь складності, що ускладнює досягнення оптимальних результатів у плані антибактеріальної та формуючої здатності. Багато ділянок основного кореневого каналу залишилися непідготовленими, незалежно від використаної техніки інструментування, в середньому від 20% до 35% (зони ізтмусу не враховуються). Можна з упевненістю припустити, що більші апікальні підготовки могли призвести до збільшення підготовленої поверхні та покращення дезінфекції, і це варто додатково дослідити, використовуючи цей кореляційний підхід. Коли вони були присутні, ізтмуси не піддавалися механічному впливу інструментування і, можливо, навіть не піддавалися впливу іригантів. Останні не могли бути оцінені за допомогою mCT аналізу, а обмеження процедур відбору з використанням паперових точок заважають бактеріологічному аналізу оцінити постійність бактерій в ізтмусах.
Незважаючи на різні дизайни та конуси інструментів, були зроблені зусилля для стандартизації розміру підготовок якомога більше. Розміри файлів, що використовуються для фінальної апікальної підготовки, були такими: TF розмір 25 з конусом 0.06 мм/мм вздовж гвинтового стержня інструмента, Reciproc R25 з конусом 0.08 вздовж останніх 3 мм від кінчика, і SAF, що використовувався протягом 3 хвилин після підготовки глід-паті звичайним ротаційним файлом розміром 25/0.04. Ці підходи призвели до підготовок без значних відмінностей у фінальному обсязі та підготовленій поверхні, як показав mCT аналіз. Оскільки загальний обсяг іригантів був однаковим, ця відсутність значної різниці також відобразилася на антибактеріальній ефективності трьох підходів до інструментування, які не відрізнялися навіть при подальшому збільшенні розміру вибірки.
Очікувалося, що канали, які показують позитивні результати на наявність бактерій після інструментування, матимуть більшу непідготовлену поверхню. Проте, хоча всі зразки, що показали наявність бактерій у S2, мали непідготовлені ділянки, також були зразки з великими непідготовленими ділянками, які показали негативні культури. Кореляційний аналіз не виявив статистично значущих зв'язків між елімінацією бактерій та середнім відсотковим збільшенням проаналізованих параметрів у мCT-іміджінгу. Розумно припустити, що в деяких зразках основні канали, які не були торкнуті інструментами, могли не бути колонізовані бактеріями, оскільки колонізація зазвичай не є рівномірною вздовж стінок каналу. Інша можливість полягає в тому, що непідготовлені ділянки були успішно дезінфіковані NaOCl, який має сильні антибактеріальні та антибіофільмні властивості.
Хоча це дослідження є інноваційним у тому сенсі, що поєднує дані з 2 підходів, що дозволяє провести кореляційний аналіз, воно не позбавлене обмежень. Відсутність кореляції між 2 аналізами може бути пов'язана з факторами, обговореними раніше, або може бути наслідком обмежень процедур відбору зразків за допомогою паперових точок, які можуть не забезпечити хорошу репрезентативну вибірку з системи кореневих каналів, особливо з нерівностей, заглиблень та ділянок, віддалених від основного каналу. Майбутні дослідження, що використовують або гістобактеріологічний аналіз, або кріоподрібнення кореневих зразків, повинні обійти ці обмеження. Проте ці підходи також мають свої обмеження, оскільки обидва є руйнівними і не дозволяють оцінювати зразки до та після інструментування. Більше того, гістобактеріологічний аналіз надає 2-вимірну (2D) інформацію про вибрані ділянки і не дає інформації про життєздатність, тоді як кріоподрібнення не вказує на місце розташування залишкових бактерій. Майбутні дослідження повинні розглянути можливість додавання одного з цих підходів до тих, що використовувалися в даному дослідженні для більш комплексного аналізу. Подальші дослідження, що використовують цей кореляційний підхід, можуть дослідити потенційний вплив змінних іригантів (наприклад, патерни потоку, концентрація, час експозиції та температура), а також різні анатомічні конфігурації та системи підготовки на результат.
На завершення, це дослідження показало, що 3 техніки інструментування мають подібну дезінфікуючу та формуючу ефективність при підготовці мезіальних каналів нижніх молярів. Подальші вдосконалення кореляційного аналізу, використаного в цьому дослідженні, мають потенціал сприяти методу, який може всебічно оцінити ефективність інструментів та технік інструментування.
Автори: Хосе Ф. Сікейра-молодший, Флавіо Р.Ф. Алвес, Марко А. Версіяні, Ізабела Н. Рокас, Бернардо М. Алмейда, Моніка А.С. Невес, Мануел Д. Соуза-Нето
Посилання:
- Сікейра ХФ молодший, Лопес ХП. Хімомеханічна підготовка. У: Сікейра ХФ молодший, ред. Лікування ендодонтичних інфекцій. Лондон: Квінтесенс Паблішинг; 2011:236–84.
- Сйогрен У, Фігдор Д, Перссон С та ін. Вплив інфекції в момент заповнення кореня на результати ендодонтичного лікування зубів з апікальним періодонтитом. Int Endod J 1997;30:297–306.
- Сікейра ХФ молодший, Рокас ІН. Клінічні наслідки та мікробіологія бактеріальної стійкості після лікувальних процедур. J Endod 2008;34:1291–13013.
- Барбізам ЖВ, Фарініук ЛФ, Марчесан МА та ін. Ефективність ручних та ротаційних технік інструментування для очищення сплюснених кореневих каналів. J Endod 2002;28: 365–6.
- Усман Н, Баумгартнер ДжК, Маршалл ДжГ. Вплив розміру інструменту на дебридмент кореневого каналу. J Endod 2004;30:110–2.
- Сікейра ХФ молодший, Араухо МС, Гарсія ПФ та ін. Гістологічна оцінка ефективності п’яти технік інструментування для очищення апікальної третини кореневих каналів. J Endod 1997;23:499–502.
- Петерс ОА, Шоненбергер К, Лаіб А. Вплив чотирьох технік підготовки Ni-Ti на геометрію кореневого каналу, оцінений за допомогою мікрокомп’ютерної томографії. Int Endod J 2001;34: 221–30.
- Вера Дж, Сікейра ХФ молодший, Річуччі Д та ін. Лікування зубів з апікальним періодонтитом за одну або дві відвідування: гістобактеріологічне дослідження. J Endod 2012;38: 1040–52.
- Найр ПН, Генрі С, Канос В та ін. Мікробіологічний статус апікальної системи кореневого каналу людських нижніх перших молярів з первинним апікальним періодонтитом після «одного візиту» ендодонтичного лікування. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99:231–52.
- Метцгер З, Теперович Е, Зарі Р та ін. Саморегульований файл (SAF). Частина 1: повага до анатомії кореневого каналу — нова концепція ендодонтичних файлів та її впровадження. J Endod 2010;36:679–90.
- Метцгер З, Теперович Е, Коен Р та ін. Саморегульований файл (SAF). Частина 3: видалення залишків та шлакової плівки — дослідження за допомогою скануючого електронного мікроскопа. J Endod 2010;36:697–702.
- Де-Деус Г, Соузи ЕМ, Баріно Б та ін. Саморегульований файл оптимізує якість дебридменту в овальних кореневих каналах. J Endod 2011;37:701–5.
- Рібейро МВМ, Сілва-Соуса ЙТ, Версіяні МА та ін. Порівняння ефективності очищення саморегульованого файлу та ротаційних систем в апікальній третині овальних каналів. J Endod 2013;39:398–401.
- Сікейра ХФ молодший, Алвес ФР, Алмейда БМ та ін. Здатність хімомеханічної підготовки з використанням ротаційних інструментів або саморегульованого файлу дезінфікувати овальні кореневі канали. J Endod 2010;36:1860–5.
- Версіяні МА, Пекора ДжД, де Соуза-Нето МД. Підготовка плоско-овальних кореневих каналів з використанням інструменту саморегульованого файлу: дослідження за допомогою мікрокомп’ютерної томографії. J Endod 2011;37:1002–7.
- Паке Ф, Петерс ОА. Підготовка кореневих каналів верхніх молярів з використанням саморегульованого файлу: дослідження за допомогою мікрокомп’ютерної томографії. J Endod 2011;37:53–7.
- Марктварт М, Дарванн ТА, Ларсен П та ін. Мікро-КТ аналізи апікального розширення та складності кореневих каналів молярів. Int Endod J 2012;45:273–81.
- Соломонов М, Паке Ф, Фан Б та ін. Виклик систем кореневих каналів у формі C: порівняльне дослідження саморегульованого файлу та ProTaper. J Endod 2012;38: 209–14.
- Паке Ф, Бальмер М, Аттін Т та ін. Підготовка овальних кореневих каналів у нижніх молярах з використанням ротаційних інструментів з нікель-титаном: дослідження за допомогою мікрокомп’ютерної томографії. J Endod 2010;36:703–7.
- Паке Ф, Ганаль Д, Петерс ОА. Вплив підготовки кореневого каналу на апікальну геометрію, оцінений за допомогою мікрокомп’ютерної томографії. J Endod 2009;35:1056–9.
- Алвес ФР, Алмейда БМ, Невес МА та ін. Часозалежні антибактеріальні ефекти саморегульованого файлу, використаного з двома концентраціями натрію гіпохлориту. J Endod 2011; 37:1451–5.
- Сікейра ХФ молодший, Рокас ІН. Аналіз мікроорганізмів, пов’язаних з невдалим ендодонтичним лікуванням, на основі полімеразної ланцюгової реакції. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004;97:85–94.
- Тассані С, Мацопулос ГК, Баруффальді Ф. 3D ідентифікація зони перелому трабекулярної кістки за допомогою автоматичної схеми реєстрації зображень: дослідження валідації. J Biomech 2012;45:2035–40.
- Паіва СС, Сікейра ХФ молодший, Рокас ІН та ін. Доповнення антибактеріальних ефектів хімомеханічного дебридменту або пасивним ультразвуковим зрошенням, або фінальним промиванням хлоргексидином: клінічне дослідження. J Endod 2012;38:1202–6.
- Річуччі Д, Логін С, Сікейра ХФ молодший. Екзуберантна інфекція біоплівки в бічному каналі як причина короткочасної невдачі ендодонтичного лікування: звіт про випадок. J Endod 2013;39:712–8.
- Ракман ДжЕ, Уіттен Б, Седжлі КМ та ін. Порівняння саморегульованого файлу з ротаційним та ручним інструментуванням в довгих овальних кореневих каналах. J Endod 2013;39: 92–5.
- Сікейра ХФ молодший, Ліма КК, Магальяєш ФА та ін. Механічне зменшення бактеріальної популяції в кореневому каналі трьома техніками інструментування. J Endod 1999;25: 332–5.
- Сікейра ХФ молодший, Рокас ІН, Лопес ХП. Патерни мікробної колонізації в первинних інфекціях кореневих каналів. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002; 93:174–8.
- Ординола-Запата Р, Браманте КМ, Кавенагу Б та ін. Антимікробна дія ендодонтичних розчинів, використаних як фінальні зрошувачі, на моделі біоплівки з дентину. Int Endod J 2012;45:162–8.
- Алвес ФР, Сікейра ХФ молодший, Кармо ФЛ та ін. Профілювання бактеріальної спільноти з криогенічно подрібнених зразків з апікальних та корональних сегментів коренів зубів з апікальним періодонтитом. J Endod 2009;35:486–92.
