Оцінка фізико-хімічних властивостей чотирьох герметиків для кореневих каналів
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Оцінити фізико-хімічні властивості та поверхневу морфологію кореневих герметиків AH Plus, GuttaFlow, RoekoSeal та Activ GP.
Методологія: П’ять зразків кожного матеріалу були оцінені за часом затвердіння, зміною розмірів, розчинністю та радіопрозорістю відповідно до специфікації ANSI/ADA 57. Загалом було використано 50 мл деіонізованої дистильованої води з тестів на розчинність для вимірювання розчинності металів за допомогою атомно-абсорбційної спектрометрії. Морфології зовнішньої поверхні та перетину зразків були проаналізовані за допомогою скануючого електронного мікроскопа (SEM). Статистичний аналіз був проведений за допомогою одностороннього ANOVA та пост hoc тестів Тьюкі-Крамера з нульовою гіпотезою, встановленою на рівні 5%.
Результати: AH Plus мав найдовший час затвердіння (580.6 ± 3.05 хв) (P< 0.05). Activ GP не мав середнього значення за тестами на радіопрозорість та розчинність (1.31 ± 0.35 мм та 11.8 ± 0.43% відповідно) відповідно до ANSI/ADA, суттєво відрізняючись від інших матеріалів (P< 0.05), які мали середні значення для цих тестів відповідно до вимог ADA. GuttaFlow був єдиним герметиком, який відповідав специфікації 57 щодо тесту на зміну розмірів (0.44 ± 0.16%) (P< 0.05). Тест спектрометрії виявив значне вивільнення іонів Ca2+, K+, Zn2+ з герметика Activ GP (32.57 ± 5.0, 1.57 ± 0.22 та 8.20 ± 1.74 мкг мЛ–1 відповідно). У аналізі SEM втрата матриці була очевидною, а частинки заповнювача були більш чітко розрізнені в усіх групах.
Висновки: Час затвердіння всіх герметиків відповідав вимогам ANSI/ADA. Activ GP не відповідав протоколам ANSI/ADA щодо радіопрозорості, зміни розмірів та розчинності. Gutta-Flow був єдиним герметиком, який відповідав Специфікації 57 у всіх тестах. SEM-аналіз показав, що поверхні всіх герметиків зазнали мікроморфологічних змін після тесту на розчинність.
Вступ
У лікуванні кореневих каналів повне герметичне закриття системи кореневих каналів після очищення та формування є критично важливим для запобігання колонізації оральними патогенами та повторному інфікуванню кореневих і періапікальних тканин. Хоча гутаперча все ще є найпоширенішим матеріалом для заповнення кореневих каналів, було розроблено ряд нових технік і матеріалів з різними фізико-хімічними властивостями (Ørstavik 2005, Versiani та ін. 2006, Resende та ін. 2009).
Під час процедур заповнення каналу ендодонтичний герметик виконує кілька функцій, включаючи заповнення нерівностей стінки кореневого каналу, таких як апікальні розгалуження та дельти, а також простори, де гутаперча не змогла адаптуватися (Kontakiotis та ін. 2007). Оскільки традиційні матеріали для заповнення не ефективно герметизують простір кореневого каналу, були розроблені нові ендодонтичні герметики (Bouillaguet та ін. 2008).
Хоча AH Plus має адекватну довгострокову розмірну стабільність, його здатність до герметизації залишається суперечливою частково тому, що AH Plus не з'єднується з гутаперчею (Ørstavik та ін. 2001). RoekoSeal Automix (Coltène Whaledent, Лангенау, Німеччина) - це герметик, що містить диметилполісилоксан з обмеженими даними про його фізико-хімічні властивості (Gençoglu та ін. 2003). Незважаючи на обнадійливі клінічні та лабораторні дані, що повідомляються для герметика на основі силікону, RoekoSeal був протестований у різних дослідженнях з суперечливими результатами (De-Deus та ін. 2007). GuttaFlow (Coltène Whaledent, Алстеттен, Швейцарія) - це герметик на основі поліметилсилоксану, який був представлений з наміром зменшити недоліки теплих технік гутаперчі (Eldeniz & Ørstavik 2009). Стверджується, що GuttaFlow може покращити герметизацію завдяки підвищеній текучості та тому, що матеріал трохи розширюється при затвердінні (Bouillaguet та ін. 2008, Eldeniz & Ørstavik 2009, Roggendorf та ін. 2010).
Стоматологічні застосування склоіономерних герметиків використовують їх зв'язок з дентином, вивільнення фтору, антимікробну активність та біосумісність (Ørstavik 2005). Однак деякі лабораторні випробування вказали на схильність до витоків і розпаду (Carvalho-Júnior et al. 2003, Schäfer & Zandbiglari 2003). Нещодавно система точного заповнення Activ GP Precision Obturation System (Brasseler USA, Savannah, GA, USA) була представлена як моноблочна система для заповнення кореневих каналів, використовуючи звичайні конуси гутаперчі, які покриті склоіономерними заповнювачами (Roggendorf et al. 2010). Виробник стверджує, що продукт є кращим за попередні системи на основі склоіономеру з точки зору характеристик обробки, часу роботи, радіopacity (Fransen et al. 2008) та герметичності, завдяки підвищеній текучості та тому, що матеріал трохи розширюється при затвердінні (Kontakiotis et al. 2007).
Хоча було запропоновано різні види ендодонтичних герметиків як інноваційні заповнювальні матеріали, ідеальний герметик для кореневих каналів ще не знайдено (Ørstavik 1983, 2005, Ørstavik et al. 2001, Versiani et al. 2006, Resende et al. 2009). Тому метою цього лабораторного дослідження було порівняти час затвердіння, радіopacity, зміни розмірів та розчинність герметиків на основі силікону (GuttaFlow та RoekoSeal) та герметика на основі іономеру (Activ GP) з добре відомим герметиком на основі епоксидної смоли (AH Plus) відповідно до стандартів ANSI/ADA (2000).
Матеріали та методи
Час затвердіння, радіопрозорість, зміни розмірів та розчинність після затвердіння для герметиків кореневих каналів AH Plus (група I), GuttaFlow (група II), RoekoSeal (група III) та Activ GP (група IV) були виміряні відповідно до стандартів ANSI/ADA (2000) для матеріалів для герметизації кореневих каналів. Випробувані матеріали (Таблиця 1) були оброблені відповідно до інструкцій виробника. Аналізи проводив один експерт, який не знав про експериментальні матеріали. Для стандартизації та гомогенізації кількості матеріалу 0,3 г герметика було відміряно на змішувальній підкладці та спатульовано протягом 15 секунд для кожного випробуваного зразка. Для фізико-хімічних тестів було зафіксовано арифметичне середнє значення п'яти повторів для кожного герметика та вважалося результатом тесту.
Час затвердіння
Було підготовлено п’ять гіпсових кілець, що мають внутрішній діаметр 10 мм і товщину 2 мм. Зовнішні краї форм були закріплені воском на скляній пластині (75 x 25 x 1 мм). Формочки були заповнені матеріалом і перенесені в камеру з відносною вологістю 95% (RH) і температурою 37 °C. Через 150 ± 10 с після початку змішування герметика, голка типу Гілмора з масою 100 ± 0.5 г з плоским кінцем діаметром 2.0 ± 0.1 мм була обережно опущена вертикально на горизонтальну поверхню кожного зразка. Кінець голки був очищений, і дослідження повторювалося, поки вм’ятини не перестали бути видимими. Якщо результати відрізнялися більше ніж на ±5%, тест повторювався.
Тест на радіопрозорість
Було підготовлено п’ять акрилових пластин (2.2 см x 4.5 см x 1 мм), що містять чотири ямки глибиною 1 мм і діаметром 5 мм, які були розміщені на скляній пластині, покритій целофановим аркушем. Кожна ямка була заповнена одним з герметиків, відповідно до послідовності за часом затвердіння матеріалу, від найдовшого до найкоротшого, щоб зразки були готові до рентгенівської оцінки після остаточного затвердіння всіх матеріалів. Щоб уникнути утворення бульбашок, свіжозмішаний герметик вводили в ямки за допомогою шприца. Інша скляна пластина, покрита целофаном, була розміщена зверху до повного затвердіння, і будь-який надлишок герметика був видалений. Кожна пластина зберігалася в інкубаторі (37°C, 95% RH) протягом періоду, що відповідає трьом часам затвердіння.
Кожна з акрилових пластин, що містять герметики, була розташована під час рентгенівського обстеження поряд з іншою акриловою пластиною (1,3 см x 4,5 см x 1 мм), що містила алюмінієву сходинку, виготовлену з сплаву 1100, з товщиною, що варіює від 1 до 10 мм, в рівномірних кроках по 1 мм (Margraf Dental MFG Inc., Jenkintown, PA, USA). Цей набір акрилових пластин був розміщений перед фосфорної пластини, поряд з алюмінієвою сходинкою, і було зроблено цифровий рентгенівський знімок (система Digora™; Soredex Orion Corporation, Гельсінкі, Фінляндія). Рентгенівські зображення були отримані за допомогою рентгенівського апарату Spectro 70X (Dabi Atlante, Рібейран-Прето, SP, Бразилія) при 70 кВп і 8 мА. Відстань від об'єкта до фокуса становила 30 см, а час експозиції - 0,2 с. Експоновані зображувальні пластини тестових зразків були негайно відскановані після експозиції (сканер Digora™) і проаналізовані за допомогою програмного забезпечення Digora™ для Windows 5.1.
Зміна розмірів
П'ять форм Тефлону® (політетрафторетилен, DuPont, HABIA, Кнівста, Швеція), підготовлених для виробництва циліндричних тестових тіл висотою 3,58 мм і діаметром 3 мм, були розміщені на скляній пластині, обгорнутій тонкою целофановою плівкою. Форми були заповнені невеликою надлишком свіжозмішаних герметиків, і на верхню поверхню форми була притиснута мікроскопічна слайд, також обгорнута в целофан. Зібрана група була надійно закріплена за допомогою С-подібного затискача і перенесена в інкубатор (37 °C, 95% ВР), де залишалася на період, що відповідає трьом часам затвердіння. Після цього періоду плоскі кінці форм, що містять зразки, були відшліфовані наждачним папером з зернистістю 600. Зразки були вилучені з форми, виміряні цифровим штангенциркулем, зберігалися в посуді об'ємом 50 мл, що містив 2,24 мл демінералізованої дистильованої води, і зберігалися в інкубаторі (37 °C, 95% ВР) протягом 30 днів. Потім зразок був вилучений з контейнера, висушений на абсорбційній папері і знову виміряний на довжину. Відсоток зміни розмірів був розрахований за формулою:
((L30 — L )/ L) x 100
де L30 — це довжина зразка після 30 днів зберігання, а L — початкова довжина зразка.
Розчинність
Циліндрична форма з Тефлону® товщиною 1.5 мм і внутрішнім діаметром 7.75 мм була заповнена свіжозмішаним герметиком. Форма підтримувалася більшою скляною пластинкою і накривалася целофановим листом. Непроникна нейлонова нитка була поміщена всередину матеріалу, а інша скляна пластинка, також накрита целофановою плівкою, була розташована на формі і вручну притиснута так, щоб пластинки торкалися всієї форми рівномірно. Збірка була поміщена в інкубатор (37 °C, 95% ВР) і залишена на період, що відповідає трьом часам затвердіння. Як тільки зразки були вилучені з форми, їх зважили тричі (HM-200, A & D Engineering, Inc., Bradford, MA, USA), і середнє значення було зафіксовано. Зразки були підвішені на нейлоновій нитці і поміщені парами в пластиковий посуд з широким отвором, що містив 7.5 мл деіонізованої дистильованої води, дбаючи про те, щоб уникнути будь-якого контакту між ними та внутрішньою поверхнею контейнера. Контейнери були герметично закриті і залишені на 7 днів в інкубаторі (37 °C, 95% ВР). Після цього періоду зразки були вилучені з контейнерів, промиті деіонізованою дистильованою водою, висушені абсорбційним папером і поміщені в осушувач на 24 години. Після цього їх зважили знову. Втрата ваги кожного зразка (початкова маса мінус кінцева маса), виражена у відсотках від початкової маси (m% = mi – mf), була прийнята за розчинність герметика.
Об'єм 7,5 мл дистильованої води з кожного зразка був вилитий у очищений і висушений порцеляновий тигель. Кожен тигель був поміщений у муфельну піч і спалений при 550 °C. Попіл був розчинений у 10 мл концентрованої нітратної кислоти (Merck KGaA, Дармштадт, Німеччина) за допомогою скляної палички. Після цього зразки були поміщені в 50 мл мірні колби, а об'єм доведений до необхідного з ультрачистою деіонізованою водою (MilliQ, Millipore, Біллеріка, Массачусетс, США). Отримані розчини були розпилені в атомно-абсорбційний спектрофотометр (Perkin Elmer, Уберлінген, Німеччина) для перевірки наявності іонів Ca2+, K+, Zn2+ та Ag+. Арифметичне середнє трьох повторів для кожного зразка було зафіксовано і вважалося результатом, вираженим у μg mL–1.
Дослідження за допомогою скануючої електронної мікроскопії
Для дослідження за допомогою скануючої електронної мікроскопії (SEM) циліндричні тиглі з тефлону® (3 x 4 мм) були заповнені свіжозмішаними герметиками. Тиглі підтримувалися скляною пластинкою, покритою целофановим листом, і поміщалися в камеру (37 °C, 95% ВР) на період, що відповідає трьом часам затвердіння. Після цього зразки були розрізані за допомогою одноразового хірургічного скальпеля номер 15, закріплені на металевому стержні (10 x 5 мм) і покриті золото-паладієвим сплавом (Bal-Tec AG, Балцерс, Німеччина) при 20 мА. Морфології зовнішньої поверхні та перерізу зразків були якісно проаналізовані під полевим емісійним SEM (Jeol JSM 5410; Jeol Technic Co., Токіо, Японія) при прискорювальному напрузі 15 кВ, робочій відстані від 6 до 10 мм та при різних збільшеннях.
Статистичний аналіз
Було протестовано п’ять зразків з кожної групи, і середні значення були статистично порівняні. Тест Колмогорова–Смірнова показав, що результати відповідають кривій нормального розподілу, отже, була можливість проведення параметричного статистичного аналізу (односторонній ANOVA та пост хоку тест Тьюкі–Крамера), а нульова гіпотеза була встановлена на рівні 5% (SPSS 17.0 для Windows; SPSS Inc., Чикаго, IL, США).
Результати
Час затвердіння
Специфікація ANSI/ADA (2000) вимагає, щоб час затвердіння герметика був у межах 10% від зазначеного виробниками. Згідно з ними, часи затвердіння AH Plus, RSA RoekoSeal та Gutta-Flow становлять 480, 50 та 30 хвилин відповідно. У свою чергу, виробник Activ GP не надає цю інформацію і лише зазначає, що він був сформульований з розширеним робочим часом 15 хвилин.
Статистично значуща різниця була виявлена між групами AH Plus (580.6 ± 3.05 хв), GuttaFlow (24.0 ± 2.0 хв), RoekoSeal (40.0 ± 1.58 хв) та Activ GP (15.2 ± 1.30 хв) (P< 0.05). Однак середні значення показали відповідність стандартам ANSI/ADA (Таблиця 2).
Тест на радіопрозорість
AH Plus (6.0 ± 0.12 mmAl), GuttaFlow (3.0 ± 0.04 mmAl) та RoekoSeal (4.17 ± 0.45 mmAl) мали радіопрозорість вище 3 мм алюмінію, як рекомендовано специфікацією ANSI/ADA 57, в той час як Activ GP (1.31 ± 0.35 mmAl) не відповідав цій вимозі. Статистичний аналіз показав різницю між експериментальними групами (P < 0.05) (Таблиця 2).
Зміна розмірів
Стандартизація ANSI/ADA (2000) зазначає, що середнє лінійне усадження герметика не повинно перевищувати 1% або 0.1% в розширенні. За винятком GuttaFlow (0.44 ± 0.16%), жоден герметик не відповідав Специфікації 57 (ANSI/ADA 2000). Усі групи продемонстрували розширення після затвердіння, за винятком RoekoSeal, який показав усадження при затвердінні (-1.33 ± 0.12%). Статистичний аналіз виявив значну різницю між експериментальними групами (P < 0.05) (Таблиця 2).
Розчинність
Специфікація ANSI/ADA 57 (2000) зазначає, що герметик для кореневих каналів не повинен перевищувати 3% за масою, коли тестується розчинність затверділого матеріалу. За винятком Activ GP (11.8 ± 0.43%), всі герметики відповідали стандартам ANSI/ADA (P < 0.05) (Таблиця 2). Деіонізована дистильована вода, використана для тесту на розчинність і піддана атомно-абсорбційній спектрометрії, показала значний рівень вивільнення іонів Ca2+, K+ та Zn2+ в групі Activ GP у порівнянні з AH Plus, Gutta-Flow та RoekoSeal (P < 0.05). Значні рівні вивільнення Ag+ не спостерігалися в жодній групі (Таблиця 3).

Дослідження SEM
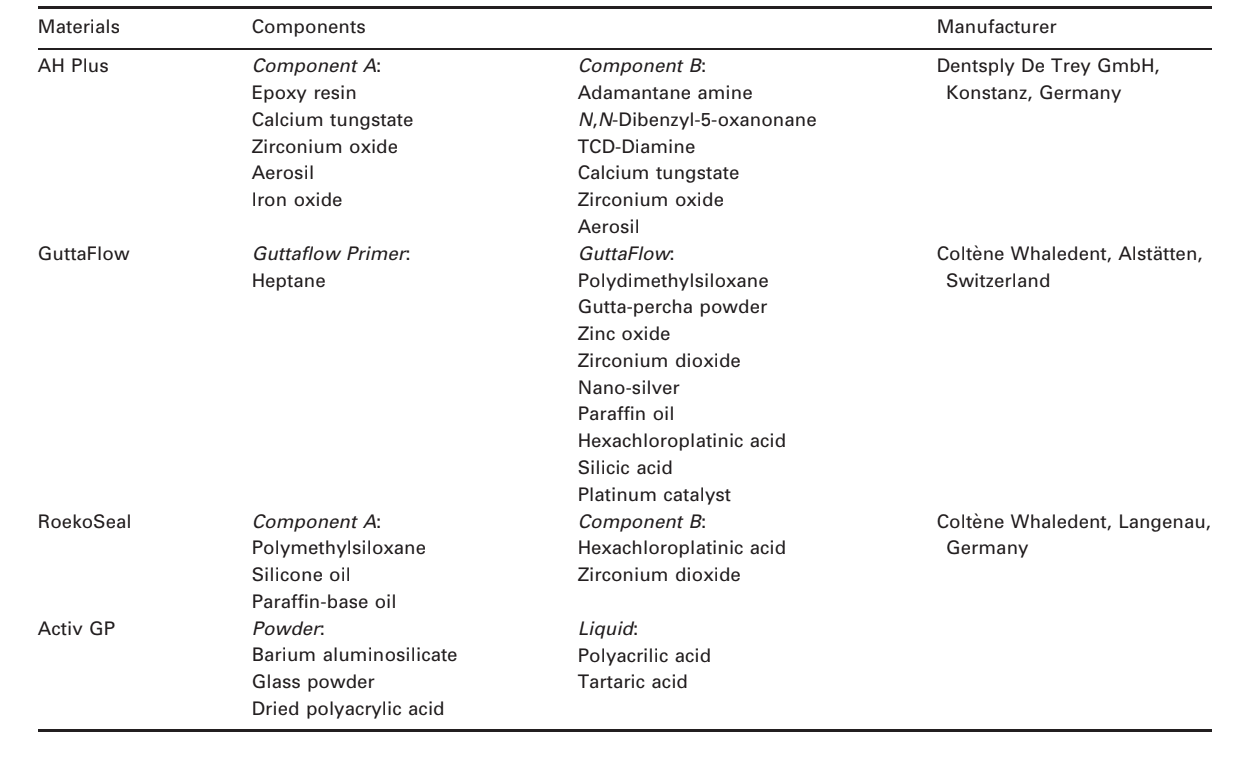
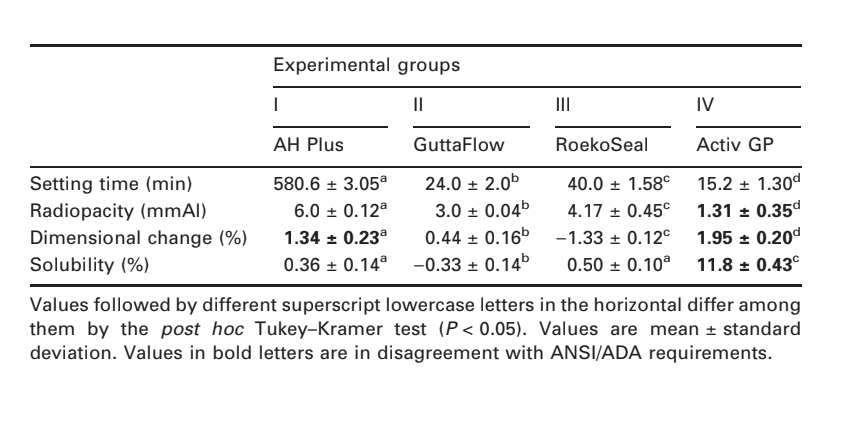
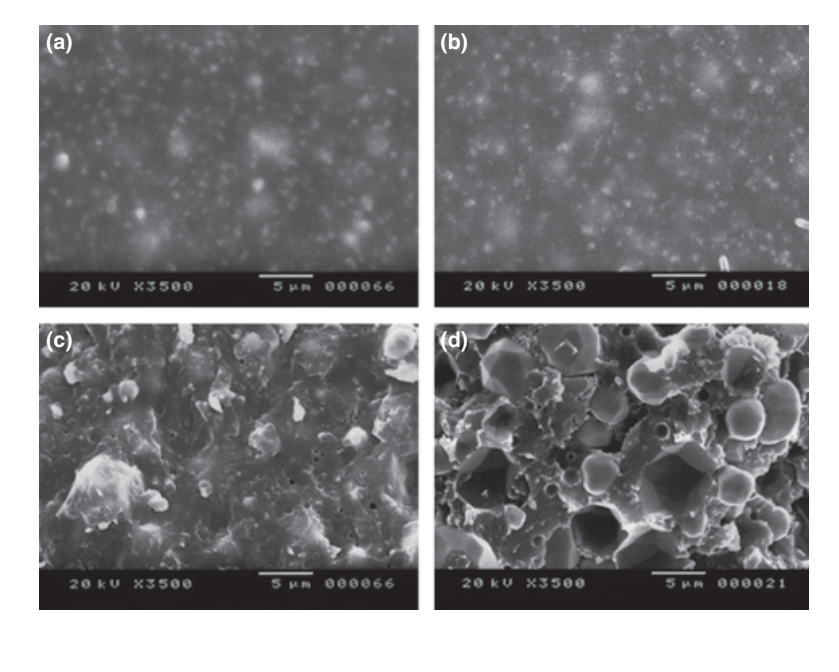
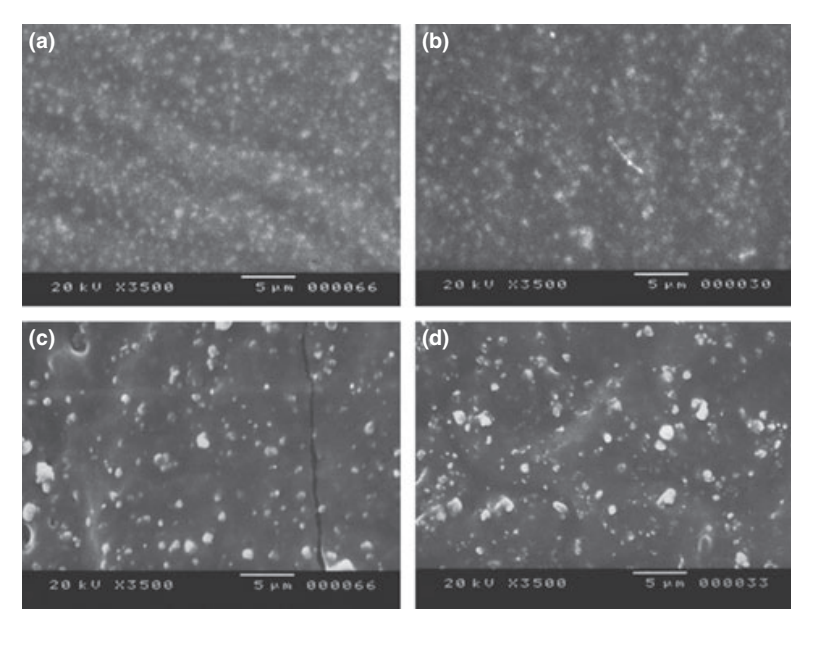
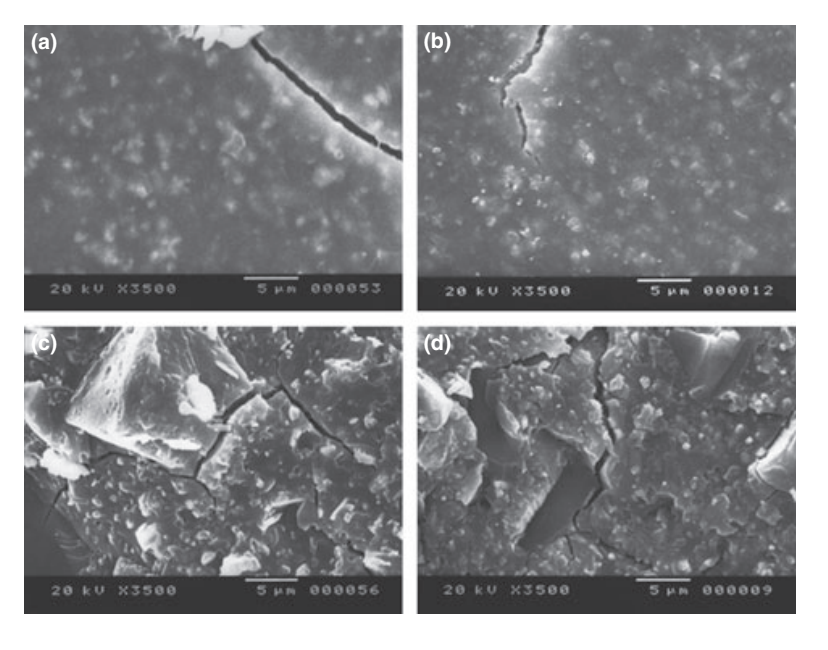
Вибрані фотомікрографії полімеризованих зразків, отриманих до та після зберігання у воді протягом 7 днів, представлені на рис. 1–4. Загалом, було відзначено, що всі поверхні зазнали мікроморфологічних змін після тесту на розчинність. Втрата матриці була очевидною, а частинки наповнювача стали більш помітними. Групи AH Plus (рис. 1a,b), GuttaFlow (рис. 2a,b) та RoekoSeal (рис. 3a,b) мали зовнішню поверхню, яка виглядала в основному як однорідні шорсткі поверхні, що зменшуються в шорсткості після тесту на розчинність з подальшим загрубінням поверхні. Тріщини не спостерігалися в зразках, за винятком групи Activ GP. Поверхня зразків Activ GP була відносно шорсткішою в порівнянні з іншими групами, і матеріал поверхні виглядав більш пошкодженим після тесту на розчинність (рис. 4a,b).
Скануюча електронна мікроскопія перетину зразків виявила наявність сферичних полімерів різних розмірів, які були нерівномірно розподілені. Після тесту на розчинність внутрішня поверхня зразків AH Plus (Рис. 1c,d), GuttaFlow (Рис. 2c,d) та Activ GP (Рис. 4c,d) виявилася значно більш нерівною та шорсткою. У групі Activ GP перед тестом на розчинність та після нього спостерігалися кілька мікротріщин на межах заповнювача та полімерної матриці (Рис. 4c,d). З іншого боку, група RoekoSeal мала більш однорідний та компактний шар, що складався зі сферичних полімерів з більшою кількістю смолистої матриці (Рис. 3c,d).

Обговорення
Час затвердіння є, в першу чергу, контрольним тестом на стабільну поведінку продукту і залежить від складових компонентів, їх розміру частинок, температури навколишнього середовища та відносної вологості (Ørstavik 1983, 2005, Ørstavik та ін. 2001). У даному дослідженні всі результати відповідали специфікаціям ANSI/ADA. Найдовший час затвердіння AH Plus можна пояснити тим, що цей герметик є двокомпонентним пастоподібним матеріалом, заснованим на повільній полімеризаційній реакції амінів епоксидної смоли з високою молекулярною масою (Бісфенол А та Бісфенол F), де перетворення мономерів у полімери відбувається поступово (Lin-Gibson та ін. 2006, Resende та ін. 2009). Ці результати узгоджуються з попередніми дослідженнями (Versiani та ін. 2006, Resende та ін. 2009), однак, Garrido та ін. (2010) повідомили про час затвердіння AH Plus у 13 годин, що перевищує допустиму 10% варіацію, передбачену Специфікацією номер 57 ADA.
Стандарти ANSI/ADA (2000) для радіощільності матеріалів для герметизації кореневих каналів були визначені за допомогою звичайних стоматологічних плівок, де радіографічні зображення отримуються шляхом хімічної обробки (Taşdemir та ін. 2008). Однак цифрова радіографія стає все більш поширеною у вивченні ендодонтичних герметиків (Baksi Akdeniz та ін. 2007, Carvalho-Júnior та ін. 2007a, Rasimick та ін. 2007, Taşdemir та ін. 2008). Таким чином, у даному дослідженні цифрові зображення матеріалів для заповнення кореневих каналів та етапів алюмінієвого ступеня були отримані за допомогою системи фосфорних пластин та цифрової системи сканування, захоплення та читання.
Аналіз складу протестованих матеріалів виявив, що всі вони мають радіопакуючі агенти (Таблиця 1), за винятком герметика Activ GP. Згідно з Tanomaru-Filho та ін. (2008), наявність порошку барієвого алюмінійсилікатного скла в його складі не забезпечує задовільної радіopacity. AH Plus містить оксид цирконію, оксид заліза та кальцієвий тугстат як радіопакуючі агенти (Tanomaru-Filho та ін. 2007) і мав найвищий середній показник радіopacity (6.0 ± 0.12 mmAl), як було раніше повідомлено (Tagger & Katz 2003, Carvalho-Júnior та ін. 2007a, Tanomaru-Filho та ін. 2007, Taşdemir та ін. 2008). Герметик RoekoSeal містить діоксид цирконію як радіопакуючий агент (Baksi Akdeniz та ін. 2007), а отриманий результат (4.17 ± 0.45 mmAl) узгоджується з попередніми даними, які показали, що його радіopacity коливається від 4.0 до 5.7 (Tagger & Katz 2003, Gambarini та ін. 2006, Tanomaru-Filho та ін. 2007, Rasimick та ін. 2007). Нижча радіopacity GuttaFlow (3.0 ± 0.04 mmAl) у порівнянні з RoekoSeal також була зафіксована в попередніх дослідженнях (Tagger & Katz 2003, Gambarini та ін. 2006, Rasimick та ін. 2007, Tanomaru-Filho та ін. 2007). Оскільки виробник не надає хімічний тип і концентрацію нано-срібла в GuttaFlow, очевидно, що ці частинки не мали радіопакуючих характеристик. Висока розчинність герметиків для кореневих каналів є небажаною, оскільки розчинення може викликати вивільнення матеріалів, які можуть подразнювати періапікальні тканини, а також може дозволити утворення проміжків між кореневими каналами та заповнювальними матеріалами, що, ймовірно, призведе до збільшення бактеріальної витоку з часом (Donnelly та ін. 2007). Незважаючи на рекомендації ANSI/ADA, у даному дослідженні була використана модифікація, раніше запропонована для обох тестів, яка досягла подібних результатів зі зменшенням обсягу матеріалу, необхідного для виготовлення тестових зразків (Carvalho-Júnior та ін. 2007b). У даному дослідженні AH Plus розширився в тесті на зміни розмірів. Повільне збільшення маси з часом було в основному зумовлене енергією взаємодії між водою та адсорбційними ділянками для системи (тобто гідроксильною групою, аміногрупою, кінцем полімерного ланцюга тощо), заповнюючи проміжки між полімерними ланцюгами (McDermott 1993). Можливо, це розширення компенсувало усадку, яку зазнав герметик на основі смоли після полімеризації (Phillips & Skinner 1991, Carvalho-Júnior та ін. 2007b, Resende та ін. 2009, Garrido та ін. 2010).
Полімеризація AH Plus досягається за рахунок поліамінних мономерів у його складі (1-адамантан амін, N,N’-дібензил-5-окса-нонанді-амін-1,9, TCD-діамін). Коли діепоксидні сполуки та паста з поліамінів змішуються, аміногрупи реагують з епоксидними групами, утворюючи ковалентний зв'язок. Використання аліфатичних циклічних аміногруп сприяє змінам у швидкості затвердіння, щільності зшивок і морфології епоксидних смол. Кожна NH група може реагувати з епоксидною групою, так що отриманий полімер є сильно зшитим, а отже, жорстким і міцним (McDermott 1993, Case et al. 2005). Це може пояснити однорідну та компактну шорстку поверхню, виявлену в SEM-аналізі, та низькі результати розчинності AH Plus у даному дослідженні. Шефер і Зандбігларі (2003) також вимірювали розчинність епоксидних смол (AH Plus, AH 26), на основі силікону (RoekoSeal), гідроксиду кальцію (Apexit, Sealapex), оксиду цинку-евгенолу (Aptal-Harz) та на основі скляного іономера (Ketac Endo) герметиків у воді та штучній слині. За словами цих авторів, AH Plus мав найменшу втрату ваги з усіх протестованих герметиків, незалежно від використаного середовища розчинності.
Попередні дослідження показали, що герметики на основі полідіметилсилоксану трохи розширюються під час затвердіння і демонструють мінімальне водопоглинання та розчинність (Donnelly та ін. 2007, Monticelli та ін. 2007). Відповідно до цієї заяви, у даному дослідженні герметики GuttaFlow та RoekoSeal мали низьку розчинність з мінімальним вивільненням металевих іонів. Щодо тесту на зміни розмірів, GuttaFlow був єдиним герметиком, який відповідав Специфікації 57 (ANSI/ADA 2000), зазнавши розширення приблизно на 0.44%. Таке ж не спостерігалося у його попередника, RoekoSeal, який продемонстрував усадку (1.33%). Навпаки, цей результат не відповідав даним Ørstavik та ін. (2001), які повідомили, що Roeko-Seal мав невелике розширення приблизно на 0.2% протягом 4 тижнів і залишався стабільним після цього.
Присутність гутаперчі та наносрібних частинок у герметику GuttaFlow забезпечує кращу стабільність полімерної матриці завдяки силі притягання між атомами срібла та молекулами гутаперчі в полімерному зшиванні (Malynych та ін. 2001). Ці взаємодії можуть пояснити низьке вивільнення іонів срібла з GuttaFlow, що спостерігалося в атомно-абсорбційній спектроскопії. Крім того, присутність гутаперчі в полімерному зшиванні GuttaFlow призвела до більшого водопоглинання, ніж RoekoSeal (Gong та ін. 2008), що пояснює різницю в результатах тесту на зміни розмірів та більш однорідний і компактний шар, спостережуваний на поверхні RoekoSeal під SEM.
Найвищі результати розчинності та зміни розмірів герметика Activ GP можуть бути пов'язані з методологією ANSI/ADA, яка рекомендує занурити зразок у воду після періоду, що в три рази перевищує час затвердіння матеріалу. Згідно з Вілсоном і МакЛейном (1988), час затвердіння цементу іономера завершується лише через 24 години після змішування. Під час часу дозрівання цементів на основі скляного іономера наявність вологи може спричинити розчинення аніонів і катіонів, які формують матрицю для ділянок навколо цементу (Монтічеллі та ін. 2007). Це розчинення іонів не дозволяє воді, яка є частиною складу цементу, гідратувати матрицю (Ca2+ і Al3+ формують полісолі з групами COO- поліакрилової кислоти), що робить її нестабільною (Карвалью-Юніор та ін. 2003, Шефер і Зандбігларі 2003, Доннелі та ін. 2007). Це може пояснити грубіша поверхня, спостережена в SEM, та значний рівень вивільнення іонів кальцію, калію та цинку з Activ GP у даному дослідженні. Оскільки структури цементів на основі скляного іономера, ймовірно, підлягають впливу наявності або відсутності води, вони чутливі до зневоднення на ранніх етапах процесу затвердіння (Вілсон і МакЛейн 1988). Для оцінки SEM зневоднення зразка є важливим процесом, що може пояснити мікротріщини, спостережені на поверхні зразків Activ GP. Тому результати, отримані з Activ GP у даному дослідженні, слід інтерпретувати з обережністю.
Висновки
Час затвердіння всіх герметиків відповідав вимогам ANSI/ADA. Activ GP не відповідав протоколам ANSI/ADA щодо радіопрозорості, зміни розмірів та розчинності. GuttaFlow був єдиним герметиком, який відповідав Специфікації 57 у всіх тестах. SEM-аналіз показав, що поверхні всіх герметиків зазнали мікроморфологічних змін після тесту на розчинність.
Автори: D. S. H. Flores, F. J. A. Rached-Júnior, M. A. Versiani, D. F. C. Guedes, M. D. Sousa-Neto, J. D. Pécora
Посилання:
- ANSI/ADA (2000) Специфікація n° 57 Матеріал для ендодонтичного герметизування. Чикаго, США: ADA Publishing.
- Baksi Akdeniz BG, Eyuboglu TF, Sen BH, Erdilek N (2007) Вплив трьох різних герметиків на радіопрозорість заповнень кореневих каналів у змодельованих каналах. Оральна хірургія, оральна медицина, оральна патологія, оральна радіологія та ендодонтія 103, 138–41.
- Bouillaguet S, Shaw L, Barthelemy J, Krejci I, Wataha JC (2008) Довгострокова герметизуюча здатність Pulp Canal Sealer, AH-Plus, GuttaFlow та Epiphany. Міжнародний ендодонтичний журнал 41, 219–26.
- Carvalho-Júnior JR, Guimarães LF, Correr-Sobrinho L, Pécora JD, Sousa-Neto MD (2003) Оцінка розчинності, дисперсії та зміни розмірів скляного іономерного герметика для кореневих каналів. Бразильський стоматологічний журнал 14, 114–8.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007a) Радіопрозорість матеріалів для заповнення кореневих каналів за допомогою цифрової радіографії. Міжнародний ендодонтичний журнал 40, 514–20.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007b) Розчинність і зміна розмірів після затвердіння герметиків для кореневих каналів: пропозиція щодо менших розмірів тестових зразків. Журнал ендодонтії 33, 1110–6.
- Case SL, O’Brien EP, Ward TC (2005) Профілі затвердіння, щільність зшивок, залишкові напруги та адгезія в моделі епоксидної смоли. Полімер 46, 10831–40.
- De-Deus G, Brandão MC, Fidel RA, Fidel SR (2007) Герметизуюча здатність GuttaFlow в овальних каналах: екс-віво дослідження за допомогою моделі полімикробного витоку. Міжнародний ендодонтичний журнал 40, 794–9.
- Donnelly A, Sword J, Nishitani Y та ін. (2007) Водопоглинання та розчинність герметиків на основі метакрилатної смоли. Журнал ендодонтії 33, 990–4.
- Eldeniz AU, Ørstavik D (2009) Лабораторна оцінка коронального бактеріального витоку в кореневих каналах, заповнених новими та традиційними герметиками. Міжнародний ендодонтичний журнал 42, 303–12.
- Fransen JN, He J, Glickman GN, Rios A, Shulman JD, Honeyman A (2008) Порівняльна оцінка герметика ActiV GP/скляний іономер, Resilon/Epiphany та Gutta-Percha/AH Plus: дослідження бактеріального витоку. Журнал ендодонтії 34, 725–7.
- Gambarini G, Testarelli L, Pongione G, Gerosa R, Gagliani M (2006) Радіографічні та реологічні властивості нового ендодонтичного герметика. Австралійський ендодонтичний журнал 32, 31–4.
- Garrido ADB, Lia RCC, França EC, da Silva JF, Astolfi-FIlho S, Sousa-Neto MD (2010) Лабораторна оцінка фізико-хімічних властивостей нового герметика для кореневих каналів на основі Copaifera multijuga олії-ресини. Міжнародний ендодонтичний журнал 43, 283–91.
- Gençoglu N, Türkmen C, Ahiskali R (2003) Новий герметик для кореневих каналів на основі силікону (Roekoseal-Automix). Журнал оральної реабілітації 30, 753–7.
- Gong W, Zeng K, Wang L, Zheng S (2008) Полі(гідроксиетер бісфенолу А)-блок-полідиметилсилоксановий чергуючий блок-кополімер та його наноструктуровані суміші з епоксидною смолою. Полімер 49, 3318–26.
- Kontakiotis EG, Tzanetakis GN, Loizides AL (2007) Порівняльне дослідження контактних кутів чотирьох різних герметиків для кореневих каналів. Журнал ендодонтії 33, 299–302.
- Lin-Gibson S, Landis FA, Drzal PL (2006) Комбінаторне дослідження структури-властивостей фотополімеризованих диметакрилатних мереж. Біоматеріали 27, 1711–7.
- Malynych S, Robuck H, Chumanov G (2001) Виготовлення двовимірних зборок наночастинок Ag та нано-порожнин у полі(диметилсилоксановій) смолі. Nano Letters 1, 647–9.
- McDermott J (1993) Структура індустрії передових композитів: Блакитна книга передових композитів. Клівленд: Advanstar Communications.
- Monticelli F, Sword J, Martin RL та ін. (2007) Герметизуючі властивості двох сучасних систем одноразового заповнення. Міжнародний ендодонтичний журнал 40, 374–85.
- Ørstavik D (1983) Фізичні властивості герметиків для кореневих каналів: вимірювання текучості, робочого часу та міцності на стиск. Міжнародний ендодонтичний журнал 16, 99–107.
- Ørstavik D (2005) Матеріали, що використовуються для заповнення кореневих каналів: технічне, біологічне та клінічне тестування. Ендодонтичні теми 12, 25–38.
- Ørstavik D, Nordahl I, Tibballs JE (2001) Зміна розмірів після затвердіння матеріалів герметиків для кореневих каналів. Стоматологічні матеріали 17, 512–9.
- Phillips RW, Skinner EW (1991) Наука про стоматологічні матеріали Скіннера, 9-е вид. Філадельфія: Saunders.
- Rasimick BJ, Shah RP, Musikant BL, Deutsch AS (2007) Радіопрозорість ендодонтичних матеріалів на плівці та цифровому сенсорі. Журнал ендодонтії 33, 1098–101.
- Resende LM, Rached-Junior FJ, Versiani MA та ін. (2009) Порівняльне дослідження фізико-хімічних властивостей герметиків AH Plus, Epiphany та Epiphany SE. Міжнародний ендодонтичний журнал 42, 785–93.
- Roggendorf MJ, Legner M, Ebert J, Fillery E, Frankenberger R, Friedman S (2010) Мікро-CT оцінка залишкового матеріалу в каналах, заповнених Activ GP або GuttaFlow після видалення за допомогою NiTi інструментів. Міжнародний ендодонтичний журнал 43, 200–9.
- Schäfer E, Zandbiglari T (2003) Розчинність герметиків для кореневих каналів у воді та штучній слині. Міжнародний ендодонтичний журнал 36, 660–9.
- Tagger M, Katz A (2003) Радіопрозорість ендодонтичних герметиків: розробка нового методу для прямого вимірювання. Журнал ендодонтії 29, 751–5.
- Tanomaru-Filho M, Jorge EG, Guerreiro Tanomaru JM, Goncalves M (2007) Оцінка радіопрозорості нових матеріалів для заповнення кореневих каналів шляхом цифровізації зображень. Журнал ендодонтії 33, 249–51.
- Tanomaru-Filho M, Jorge EG, Tanomaru JM, Goncalves M (2008) Оцінка радіопрозорості герметиків для кореневих каналів на основі гідроксиду кальцію та скляного іономеру. Міжнародний ендодонтичний журнал 41, 50–3.
- Tas¸demir T, Yesilyurt C, Yildirim T, Er K (2008) Оцінка радіопрозорості нових паст/герметиків для кореневих каналів за допомогою цифрової радіографії. Журнал ендодонтії 34, 1388–90.
- Versiani MA, Carvalho-Junior JR, Padilha MI, Lacey S, Pascon EA, Sousa-Neto MD (2006) Порівняльне дослідження фізико-хімічних властивостей герметиків AH Plus та Epiphany. Міжнародний ендодонтичний журнал 39, 464–71.
- Wilson AD, McLean JW (1988) Скляний іономерний цемент. Чикаго: Quintessence Pub. Co.
