Мікро-КТ оцінка зон з проміжками вздовж інтерфейсу гутаперчі та герметика в овальних каналах
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання).
Анотація
Мета: Оцінити міжфасадну адаптацію (області з зазорами) двох герметиків для кореневих каналів (EndoSequence BC Sealer та AH Plus) до звичайного конуса з гутаперчі (інтерфейс гутаперча-герметик) в овальних каналах, заповнених за допомогою техніки одного конуса.
Методологія: Були обрані шістнадцять зубів з овальними каналами, відскановані в мікрокомп'ютерному томографі та парно зіставлені за об'ємом, співвідношенням сторін та конфігурацією кореневих каналів. Потім кореневі канали були послідовно підготовлені інструментами WaveOne Gold Primary та Large, після чого заповнені великими GP-точками WaveOne, асоційованими або з преміксованим кальцій-силікатним герметиком EndoSequence BC Sealer, або з епоксидним герметиком AH Plus (n = 8 на групу) за допомогою техніки одного конуса. Після 7 днів зберігання в розчині фосфатно-буферної солі при 37°C зразки були повторно відскановані, а реконструйовані зображення сегментовані для того, щоб відрізнити заповнювальні матеріали (герметик та конус з гутаперчі) від дентину. Було оцінено та класифіковано 453 поперечних зрізи відповідно до наявності або відсутності зазорів на інтерфейсі гутаперча-герметик. Тест Манна-Уїтні U-тест підтвердив різниці між групами і вважався значущим при альфа = 5%.
Результати: Прогалини були нерівномірно розподілені в двовимірних аксіальних зрізах, і жоден з зразків не показав повністю безпрогалинних ділянок вздовж всього інтерфейсу GP-герметика. Кореневі канали, заповнені EndoSequence BC Sealer та AH Plus, продемонстрували 171 (37.75%) та 136 (30.02%) зрізів з прогалинами в інтерфейсі GP-герметика, і ці частоти були статистично значущими (p = .000).
Висновки: Хоча жоден з зразків не мав безпрогалинної ділянки вздовж всього інтерфейсу GP-герметика, овальні канали, заповнені AH Plus, показали менше прогалин, ніж ті, що були заповнені EndoSequence BC Sealer.
Вступ
Гідравлічні цементи, такі як біоактивні кераміки кальцій фосфату, широко використовуються для регенерації кістки завдяки їх високій біосумісності, остеоіндуктивним та остеокондуктивним властивостям, як в ортопедії, так і в стоматології (Daculsi et al., 1990; Demirkiran, 2012; LeGeros, 1988). В ендодонтії гідрофільні біоактивні герметики на основі кальцій силікату (CSS) привернули значну увагу з моменту впровадження iRoot SP (Innovative BioCeramix Inc.) у 2007 році. Цей великий інтерес базувався на припущенні, що CSS були розроблені як похідна версія цементу MTA, але з оптимізованими властивостями обробки, біологічними та в'язкісними характеристиками (Candeiro et al., 2012; Silva et al., 2017; Silva-Almeida et al., 2017). Цей матеріал зазвичай представлений у вигляді готової до використання ін'єкційної пасти, що зберігається в герметичному шприці, що дозволяє його застосування безпосередньо в порожнині кореневого каналу. Внутрішні характеристики та клінічна корисність CSS спростили процедуру заповнення кореневих каналів для стоматологів усіх рівнів кваліфікації. Тому він став дуже популярним серед ендодонтичної спільноти, навіть без повної підтримки науки щодо деяких критичних аспектів його in vitro властивостей (Elyassi et al., 2019; Silva et al., 2021; Tanomaru-Filho et al., 2017; Torres et al., 2020; Zordan-Bronzel et al., 2019), а також відсутності довгострокових спостережуваних результатів з рандомізованих клінічних випробувань.
Спочатку CSS, як похідна версія MTA, були розроблені для заповнення всього каналу відповідно до концепції «первинного моноблоку», яка полягає в існуванні лише одного інтерфейсу, що простягається по колу між матеріалом і стінками кореневого каналу, щоб покращити довгострокову герметичність (Tay & Pashley, 2007). Проте CSS не підходять для використання як єдиний заповнювач, враховуючи можливість непроникнення після остаточного затвердіння, що ускладнює повторне лікування, якщо це необхідно (Eymirli et al., 2019; Hess et al., 2011). Рішенням було використання іншого матеріалу — основного конуса гутаперчі (GP) — для введення герметика в нерівності каналу та для служіння м’яким ядром, що дозволяє повторне лікування кореневого каналу. Хоча ця техніка була спрямована на заповнення простору кореневого каналу шляхом цементування раніше підігнаного основного конуса GP з CSS, вона також вводить додатковий інтерфейс у заповнюючу масу. Ідея моноблоку для заповнення кореня з двома окружними інтерфейсами (GP-герметик і герметик-дентин), що формують єдину цілісну одиницю, привернула увагу з появою герметиків на основі метакрилату майже два десятиліття тому. Згідно з деякими авторами, цей тип герметика був би ідеальним заповнюючим матеріалом для забезпечення належної корональної герметичності та покращення стійкості до зламу зубів (Shipper et al., 2004, 2005; Teixeira et al., 2004). На жаль, довгострокові клінічні результати ендодонтичних лікувань показали високу ймовірність невдачі в кореневих каналах, заповнених герметиками на основі метакрилату, у порівнянні з традиційними матеріалами (Barborka et al., 2017; Strange et al., 2019), що підтверджує результати попередніх лабораторних досліджень (De-Deus et al., 2009, 2011; Hiraishi et al., 2007, 2008; Tay, Loushine, et al., 2005a; Tay Pashley, Williams, et al., 2005; Tay, Pashley, Yiu, et al., 2005; Tay et al., 2007).
Здатність герметика прилипати як до дентинових стінок, так і до GP є бажаною властивістю, оскільки це важлива умова для досягнення герметичного ущільнення по всій системі кореневого каналу. Прилипання CSS до кореневої дентину вже було розглянуто в кількох дослідженнях (Neelakantan et al., 2015; Oliveira et al., 2016; Sagsen et al., 2011; Silva et al., 2019). Однак існує недостатня кількість доказів щодо якості інтерфейсної адаптації між CSS та звичайним GP (Gandolfi et al., 2013; Kim et al., 2017, 2018; Moinzadeh et al., 2015; Pedullà et al., 2020; Viapiana et al., 2016; Zare et al., 2021). В ідеалі, це важливий аспект, оскільки герметик повинен одночасно з'єднуватися як з дентином, так і з GP, щоб покращити загальну якість заповнення. В іншому випадку, інша взаємодія між ними може призвести до розвитку інтерфейсних зазорів, маленьких порожніх ділянок, які зазвичай неможливо виявити радіографічно. Така інтерфейсна несправність може вплинути на стабільність конуса GP і може функціонувати як шлях для бактерій та їхніх продуктів, внаслідок чого компрометується загальна якість лікування кореневих каналів у довгостроковій перспективі.
Метою даного дослідження було оцінити якість міжфазної адаптації (області з зазорами) між звичайними GP конусами та преміксованим кальцій-силікатним герметиком EndoSequence BC Sealer (Brasseler USA) за допомогою мікрокомп'ютерної томографії (мікро-КТ) як аналітичного інструменту. Герметик AH Plus (Dentsply DeTrey GmbH) використовувався як еталон для порівняння. Нульова гіпотеза, що перевірялась, полягала в тому, що якість адаптації інтерфейсу не залежить від типу герметика.
Матеріали та методи
Рукопис цього лабораторного дослідження був написаний відповідно до рекомендацій Preferred Reporting Items for Laboratory studies in Endodontology (PRILE) 2021 (Nagendrababu et al., 2021). Кроки цього дослідження зображені в діаграмі PRILE (Рисунок 1).
Оцінка розміру вибірки
Для оцінки наявності прогалин у заповнювальному матеріалі за кожним зрізом мікро-КТ використовувалася оцінка на основі балів. Кількість зрізів, необхідних для перевірки значущих відмінностей між групами, була оцінена на основі дослідження Ельтаїра та ін. (2018), в якому розмір ефекту 0.43 був введений разом з помилкою типу альфа 0.05 і потужністю бета 0.95 в незалежну процедуру t-тесту (G*Power 3.1 для Macintosh; Генріх Гайне, Університет Дюссельдорфа). Вихідні дані вказували на мінімум 139 зрізів на групу. Враховуючи оцінку 15–20 зрізів на зуб (отриманих з інтервалом 0.5 мм), для даного дослідження було встановлено загалом вісім зубів на групу.
Вибір та підготовка зразків
Місцевий етичний комітет затвердив це дослідження (CAAE 17561619.1.0000.5243). Зразок з 237 нижніх різців, отриманих з банку зубів, був рентгенографований в обох напрямках: мезіодистальному та буколінгвальному, щоб виключити зуби з більш ніж одним кореневим каналом, незавершеною формою кореня або тріщинами. З цього початкового зразка було обрано 196 зубів, які були відскановані в мікро-КТ пристрої (SkyScan 1173; Bruker-microCT) при 70 кВ, 114 мА, 19.79 мкм (розмір пікселя), 180° обертання навколо вертикальної осі з кроками 0.7°, середнє значення кадру 5, з використанням алюмінієвого фільтра товщиною 1.0 мм. Проекційні зображення були реконструйовані (NRecon v.1.7.16; Bruker-microCT) з подібними параметрами для корекції артефактів кілець (4), меж контрасту (0–0.05) та корекції жорсткості променя (40%), в результаті чого було отримано 800–900 градаційних поперечних зрізів на зуб, що простягаються від цементно-емалевої межі до верхівки. Після виключення зубів з двома або більше каналами або значною додатковою анатомією, поперечні зображення 146 зразків були сегментовані за допомогою автоматичної процедури, реалізованої в програмному забезпеченні ImageJ (Fiji v.1.51n; Fiji), щоб створити тривимірні (3D) моделі зразків, а також для розрахунку об'єму (в мм3) та співвідношення сторін (AR) кореневих каналів (CTAn v.1.6.6.0; Bruker-microCT; De-Deus et al., 2020). AR є математичним представленням круговості каналу і вимірюється шляхом розрахунку співвідношення між великими та малими осями еліпса, що підходить до реконструйованих каналів у кожному поперечному зрізі, використовуючи плагін дескрипторів форми програмного забезпечення ImageJ. AR кореневих каналів був розрахований для кожного поперечного зрізу та відкладений у графік. Потім програмне забезпечення CTAn v.1.6.6.0 (Bruker-microCT) було використано для створення 3D моделей кореневих каналів зубів, в той час як CTVol v.2.3.2.0 (Bruker-microCT) було використано для якісного аналізу конфігурації кореневого каналу (Рисунок 2).
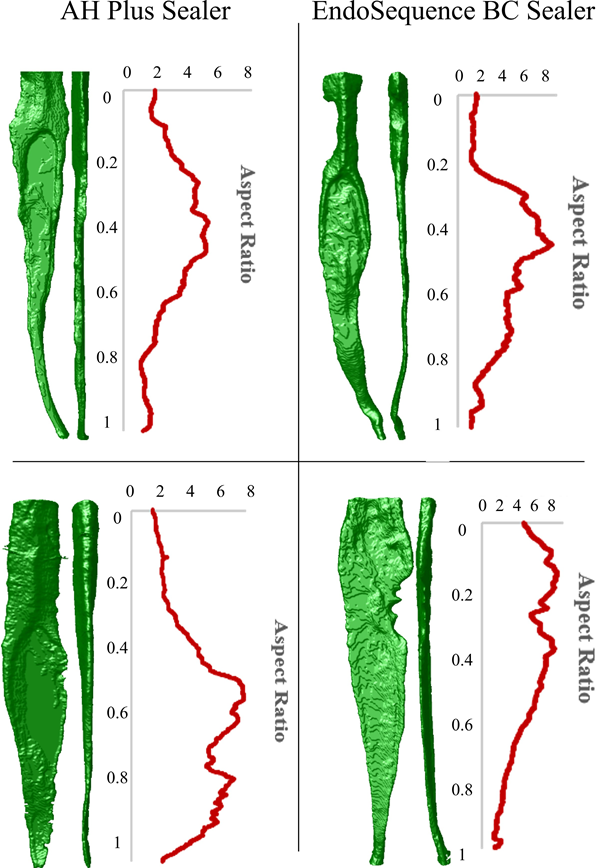
Процес парного співставлення був здійснений спочатку шляхом ідентифікації кореневих каналів з подібним об'ємом (не більше 2 мм3), подібними графічними кривими AR та подібною конфігурацією каналів. Вибір зразків за цими трьома параметрами є спробою ізолювати змінні, що цікавлять, зменшуючи упередженість, створену анатомічною варіацією, яка може бути фактором, що плутає в дослідженні такого роду. Після цих суворих критеріїв відбору було паровано 16 зубів з овальними каналами (графічні криві AR > 4) та максимальним об'ємом 5 мм3 (Рисунок 3), розподілених на дві експериментальні групи (n = 8), відсканованих та реконструйованих за вищезазначеними параметрами, за винятком розміру пікселя (14.37 мкм) та обертання (360°) з кроками 0.5°.
Підготовка кореневого каналу
Кожен корінь був обгорнутий у Parafilm-M (Bemis NA) і вмонтований у полімерний силікон (Speedex; Coltene), щоб змоделювати закриту систему та стабілізувати зразки під час експериментальних процедур. Як підготовка, так і заповнення кореневих каналів виконувалися одним спеціалістом з ендодонтії з понад 8-річним досвідом.
Після звичайного доступу до порожнини, був використаний K-файл розміру 10 (Dentsply Sirona Endodontics) для підтвердження прохідності та встановлення робочої довжини на 1.0 мм коротше від апікального отвору. Потім кореневі канали послідовно розширювалися за допомогою інструментів WaveOne Gold Primary та Large (Dentsply Tulsa Dental Specialties), які працювали з мотором VDW Silver (VDW) у попередньо налаштованій програмі «WAVEONE ALL». Спочатку WaveOne Gold Primary використовувався до робочої довжини в повільному вхідно-вихідному русі з амплітудою 3 мм. Після трьох рухів інструмент був витягнутий з каналу та очищений спиртом. Робоча довжина була досягнута після трьох хвиль інструментації. Потім WaveOne Gold Large використовувався до робочої довжини аналогічно до первинного інструмента. Апікальна прохідність була підтверджена K-файлом розміру 15 (Dentsply Sirona Endodontics) протягом всіх процедур інструментації. Після кожного етапу підготовки з реверсивними інструментами кореневі канали промивалися 3 мл 2.5% натрію гіпохлориту (NaOCl) за допомогою голки 31-G NaviTip з подвійним портом (Ultradent Inc.), яка вводилася на 1 мм коротше від робочої довжини, тоді як після підтвердження прохідності було виділено 1 мл промивної рідини. Видалення слизового шару виконувалося за допомогою 3 мл 17% EDTA (5 хв) з подальшим фінальним промиванням 2 мл дворазово дистильованої води. Таким чином, у кожному кореневому каналі було використано загалом 20 мл промивної розчини.
Заповнення кореневих каналів
Кореневі канали були висушені паперовими точками (Dentsply Sirona Endodontics) і заповнені за допомогою техніки одного конуса з використанням WaveOne Large GP точок (Dentsply Sirona Endodontics), асоційованих з EndoSequence BC Sealer (експериментальна група; n = 8) або AH Plus (контрольна група, n = 8). Випробувані матеріали були підготовлені на окремих скляних пластинах відповідно до специфічних рекомендацій кожного виробника. Для процедури обтурації 80 μl герметика були отримані за допомогою мікропіпетки і введені в кожен кореневий канал з використанням K-файлу розміру 25 (Dentsply Sirona Endodontics) у протилежному напрямку. Потім конус WaveOne Large GP обережно вставлявся в простір кореневого каналу до робочої довжини. Надлишок GP конуса був видалений за допомогою теплового носія (B&L Biotech) на рівні отвору каналу, а залишковий матеріал був вертикально ущільнений сумісним ручним плугом (B&L Biotech). Якість заповнень коренів оцінювалася за допомогою цифрових рентгенограм з буколінгвального та мезіодистального напрямків, і жоден з зразків не був відкинутий. Доступні порожнини потім були заповнені Cavit G (3M ESPE), а зразки зберігалися при 37°C у розчині з фосфатним буфером протягом 7 днів, щоб дозволити повне затвердіння герметиків. Усі процедури виконувала досвідчена особа. Після цього періоду всі зразки були знову відскановані при 100 кВ, 80 мА, 14.37 μm, 360° обертання з кроками 0.3° і середнім значенням кадру 5, відфільтровані алюмінієвою фольгою товщиною 0.5 мм.
Мікро-КТ аналіз
Після реконструкції проекційних зображень з використанням контрастних меж для можливості диференціації герметика, GP конуса та дентину, було обрано приблизно 25 зрізів, в яких було можливо спостерігати інтерфейс GP-конуса на зуб, всього 453 зображення. Два досвідчені оператори незалежно виконали аналіз зображень, щоб категоризувати зрізи відповідно до наявності (бал 1) або відсутності (бал 0) прогалин на інтерфейсі GP-герметика. Остаточний результат був досягнутий шляхом угоди між ними.
Статистичний аналіз
Бал, використаний для категоризації виникнення інтерфейсної прогалини між GP конусами та протестованими герметиками, за мікро-КТ зрізом, вважався одиницею для статистичного аналізу, і був застосований тест Манна–Уїтні U-тест для перевірки відмінностей між групами на значущому рівні 5% (SPSS 21.0; SPSS Inc.).
Результати
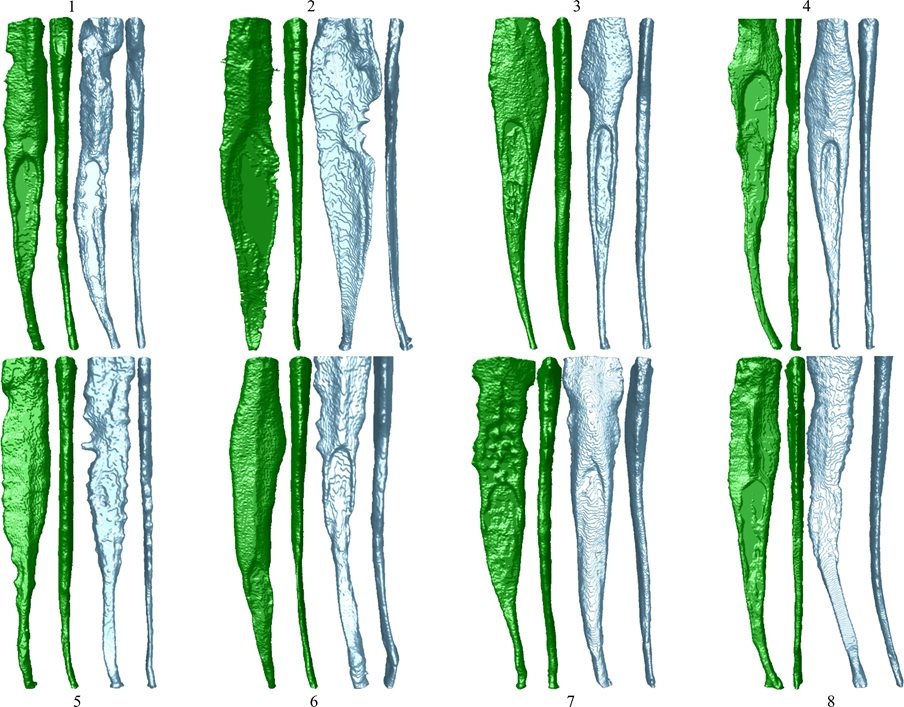
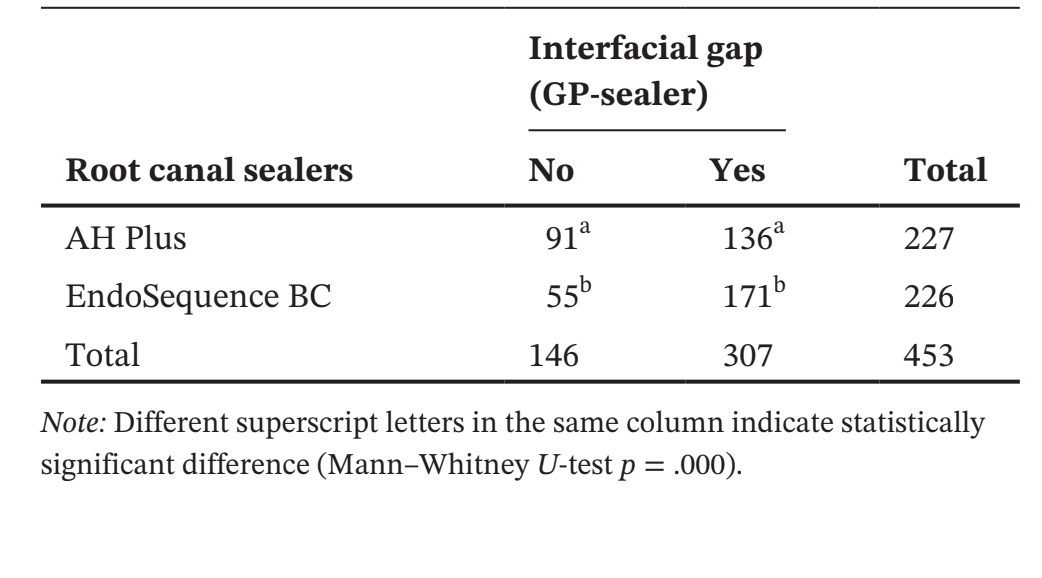
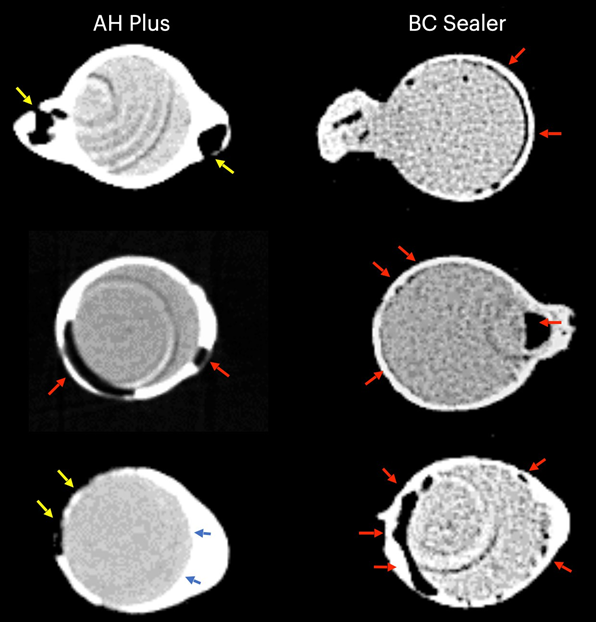
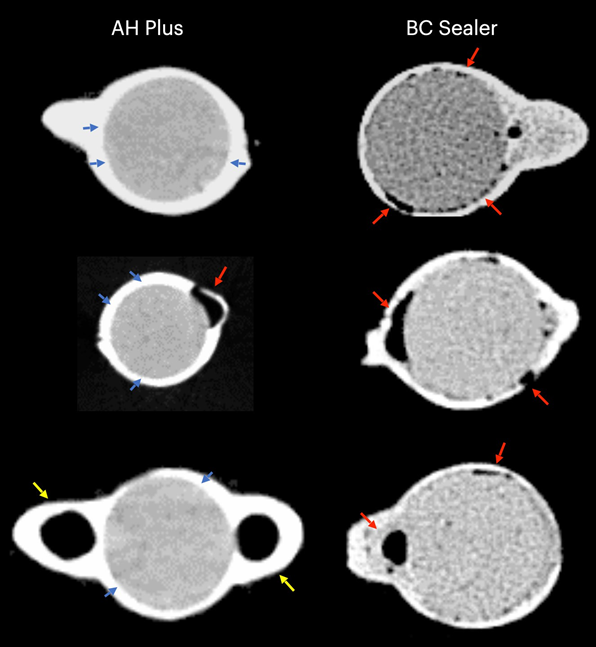
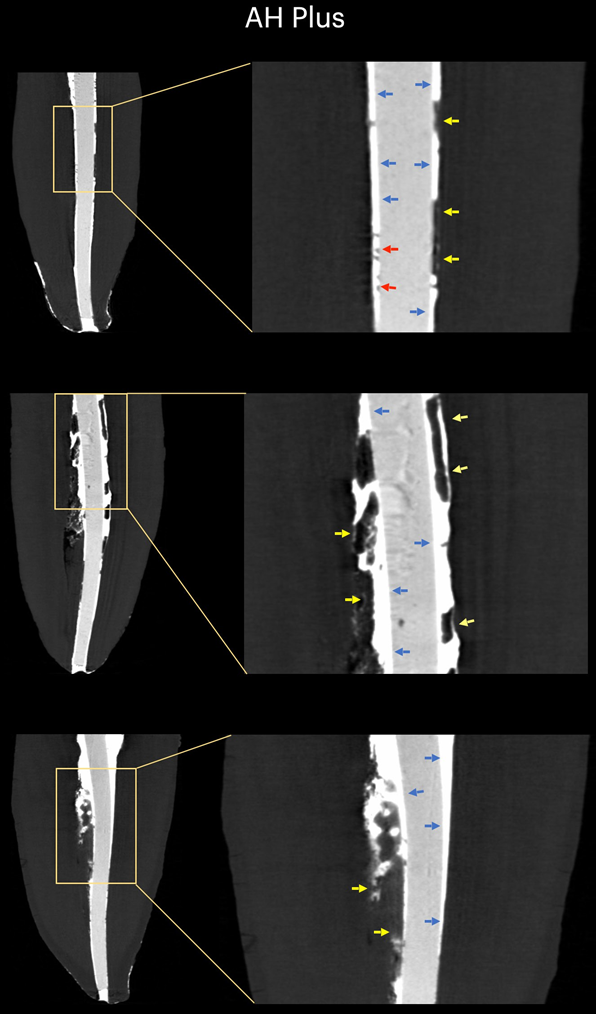
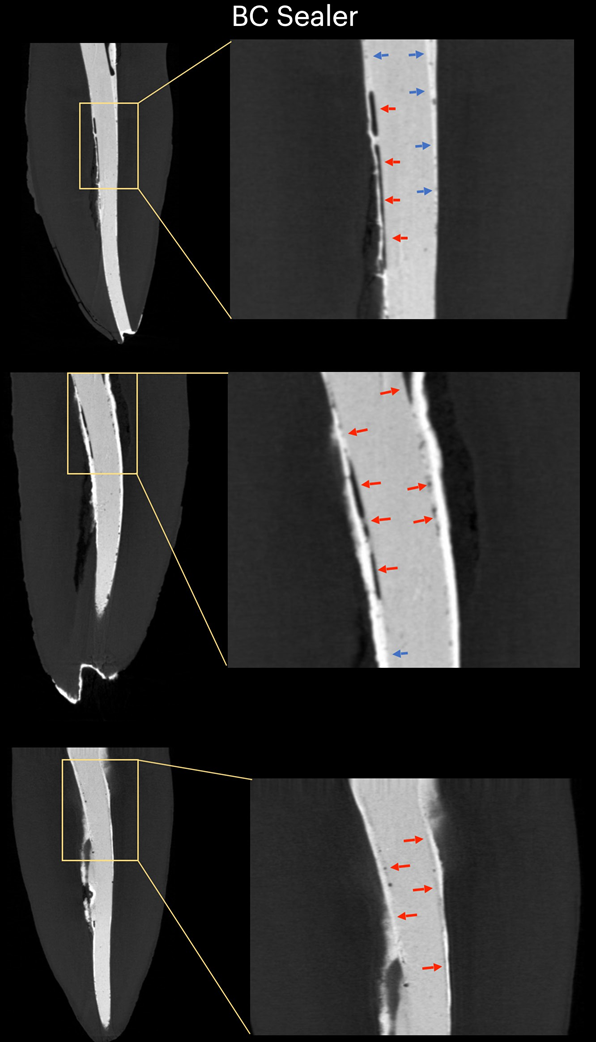
Таблиця 1 представляє кількість мікро-КТ зрізів, розподілених відповідно до виникнення міжфасадних зазорів між конусом GP та перевіреними герметиками. Зазори були нерівномірно розподілені в двовимірних (2D) аксіальних зрізах, і жоден з зразків не показав повністю беззазорні ділянки вздовж всього інтерфейсу GP-герметика. Кореневі канали, заповнені герметиком EndoSequence BC Sealer та AH Plus, показали міжфасадні зазори в 171 (37.7%) та 136 (30.0%) зрізах відповідно, і ця різниця була статистично значущою (p = .000). Фігури 4–7 показують репрезентативні трансаксіальні та сагітальні мікро-КТ зображення кореневих каналів нижніх різців, заповнених одноразовою технікою з використанням AH Plus та EndoSequence BC Sealer. Загалом, можна спостерігати хорошу адаптацію герметика AH Plus до конуса GP, тоді як більше міжфасадних зазорів присутні в каналах, заповнених EndoSequence BC Sealer. У всіх зубах також можна спостерігати ділянки з зазорами на інтерфейсі герметик-діентин.
Обговорення
У даному дослідженні було використано не руйнівний аналітичний інструмент для оцінки інтерфейсної адаптації між звичайними GP конусами та різними герметиками для кореневих каналів (AH Plus та EndoSequence BC Sealer) в анатомічно відповідних овальних каналах нижніх різців, заповнених за допомогою техніки одиночного конуса. Результати показали, що зуби, заповнені EndoSequence BC Sealer, мали значно вищу частоту зображень перерізу, що показують зазори в інтерфейсі GP-герметика, ніж ті, що були заповнені AH Plus, і нульова гіпотеза була відхилена.
У літературі кілька досліджень, що використовують різні методи аналізу, повідомляли про суперечливі результати щодо наявності зазорів і порожнин у кореневих каналах, заповнених CSS (Gandolfi et al., 2013; Kim et al., 2017, 2018; Moinzadeh et al., 2015; Pedullà et al., 2020; Viapiana et al., 2016; Zare et al., 2021). Використовуючи технологію мікро-КТ, Yanpiset et al. (2018) повідомили про мінімальні зазори і порожнини в зубах, заповнених герметиком CSS TotalFill BC Sealer (FKG Dentaire, La Chaux-de-Fonds, Швейцарія) та покритими GP конусами. Аналогічно, Eltair et al. (2018) не продемонстрували значних відмінностей в інтерфейсних зазорах між TotalFill BC Sealer та AH Plus, в поєднанні з покритими або звичайними GP конусами, через описовий аналіз з використанням скануючої електронної мікроскопії. Ці результати, однак, суперечать попереднім висновкам Zhang et al. (2010), які продемонстрували кращу інтерфейсну адаптацію герметика iRoot SP до GP у порівнянні з AH Plus. Більше того, хоча Viapiana et al. (2016) показали, що BioRoot RCS (Septodont) асоціюється з більшим відсотком порожнин, ніж AH Plus, Gandolfi et al. (2013), Kim et al. (2017) та Zare et al. (2021) не повідомили про жодні відмінності між AH Plus та різними марками CSS. Ці невідповідності, ймовірно, можна пояснити методологічними відмінностями, пов'язаними з пристроєм мікро-КТ (параметри сканування та реконструкції), вибором зразків, якістю підготовки кореневих каналів, досвідом операторів, технікою заповнення та фізико-хімічними властивостями протестованих герметиків. Таким чином, обґрунтування для інтерпретації цих відмінностей у порівнянні з нинішніми результатами ґрунтується на тому факті, що більшість досліджень, що використовують мікро-КТ, зосереджувалися на загальному аналізі відсотка порожнин, розрахованого шляхом оцінки обсягу заповнювальних матеріалів у відношенні до підготовленого каналу (Gandolfi et al., 2013; Kim et al., 2017, 2018; Moinzadeh et al., 2015; Pedullà et al., 2020; Viapiana et al., 2016). Цей підхід, однак, не враховує специфічну взаємодію герметика та GP, як продемонстровано в даному дослідженні, використовуючи специфічний параметр на основі оцінки, що допомагає зрозуміти невідповідності, спостережувані у зв'язку з попередніми висновками.
У цьому дослідженні овальні канали, заповнені звичайним GP та EndoSequence BC Sealer за допомогою техніки одноразового конуса, мали більшу кількість зрізів, що демонструють прогалини на межі GP-герметика, ніж при використанні AH Plus (Таблиця 1). Окрім деяких технічних аспектів заповнення кореневих каналів та відмінностей у фізико-хімічних властивостях герметиків, отримані результати також можна пояснити варіаціями в хімічних поверхневих полярностях між протестованими герметиками та основним матеріалом. Загалом, GP точки складаються лише приблизно з 20% хімічного складу GP, тоді як 60%–75% складу становить наповнювач оксиду цинку. Решта компонентів - це віск або смола, щоб зробити точку більш гнучкою та/або компактною, а також металеві солі для надання радіопрозорості. На органічній та неорганічній основі, GP точки складаються лише на 23.1% з органічних (GP та віск) та 76.4% з неорганічних наповнювачів (оксид цинку та сульфат барію; Фрідман та ін., 1977). GP має хімічну структуру, засновану на полімеризації стереоізомеру ізопрену, мономеру, що формує натуральний каучук, що призводить до вищої кристалічності з приблизно 30%–40% гідрофобності. Іншими словами, гідрофобні властивості GP є наслідком його аліфатичної хімічної природи (Ле Ферран & Бача, 2021). Інші два основні компоненти GP точок - це оксид цинку, віск та сульфат барію (неорганічні наповнювачі), які, в свою чергу, також мають гідрофобні характеристики (Фрідман та ін., 1977; Мурер & Жене, 1982; Вілсон та ін., 1973; Вольфмайер та ін., 2002). Тому можливо, що гідрофобна природа GP конуса більше відштовхнула CSS, матеріал, відомий своєю гідрофільністю (Хегде & Арора, 2015), ніж AH Plus, матеріал на основі епоксидної смоли, який має гідрофобний радикал у своїй молекулі (Лі та ін., 2017), що частково пояснює найменшу кількість прогалин, спостережуваних уздовж його межі. Хоча величина поляризаційних сил між гідрофільними та гідрофобними ендодонтичними матеріалами ще має бути визначена, можливо, що це слабкі сили. Відповідно, малоймовірно, що вони можуть мати великий вплив на їх взаємодію, особливо враховуючи, що ці матеріали знаходяться в жорстких дентинних стінах. Однак в анатомічних умовах, коли потрібно велика кількість герметика для заповнення простору кореневого каналу, як при використанні техніки одноразового конуса в овальних каналах, можна припустити, що доступний простір між конусом GP та дентинними стінами може забезпечити достатньо місця для дії цих сил. Як показано на малюнках 4 до 7, прогалини на межі GP-герметика в основному спостерігалися на вестибулярних та лінгвальних аспектах кореневих каналів, тобто найбільших ділянках між основою та дентинними стінами, в яких знаходиться найбільша кількість герметика. Можна стверджувати, що отримані результати є наслідком неправильного використання CSS зі звичайним GP замість конусів, покритих кальцієвим силікатом. Однак до цього часу жоден виробник не розкрив, що CSS не можна використовувати зі звичайними GP точками. Насправді, нещодавнє опитування показало, що лише 22.1% користувачів CSS використовували попередньо покритий GP у своїх заповненнях кореневих каналів (Гюварк та ін., 2020), що є доказом, який підтверджує основну мету даного дослідження.
Хоча технологія мікро-КТ дозволяє проводити не руйнівні об'ємні експерименти, висока щільність матеріалів для заповнення зазвичай має значний вплив на якість виходу реконструйованих зображень, головним чином у крайових зонах, що робить оцінку інтерфейсів справжнім викликом, особливо коли щільність між герметиком і конусами GP є подібною, що безпосередньо впливає на їх контрасти (Sun et al., 2009; Zeiger et al., 2009). Це означає, що навіть зображення, отримані за допомогою адекватних параметрів сканування та реконструкції в відповідних пристроях мікро-КТ, можуть часто призводити до незаперечних труднощів у визначенні та розрізненні меж між стінками кореневого каналу та компонентами заповнення. Це критичний методологічний аспект, враховуючи, що визначення порогу для сегментації зображень є суб'єктивною процедурою, яка залежить від досвіду оператора і, відповідно, може безпосередньо впливати на точність та надійність результатів. Коли йдеться про неоднорідні структури, такі як дентин, герметик і конуси GP, це досить складне завдання і все ще є неконсенсуальним аспектом оцінки мікро-КТ. Тому є помилковим вважати, що лише розмір пікселя визначає якість зображень, отриманих за допомогою сканування мікро-КТ. Насправді, це взаємодія між чутливістю до контрасту та просторовою роздільною здатністю визначає, що можна досягти за допомогою КТ-сканування (Stock 2009). Хоча контрастна роздільна здатність даного зображення є мірою того, наскільки добре особливість інтересу може бути відрізнена від сусіднього фону, просторове розділення описує, наскільки добре можуть бути зображені дрібні деталі або малюнки можуть бути розташовані відносно контрольної точки (Ketcham & Carlson, 2001). У даному дослідженні, хоча зразки були відскановані з використанням розміру пікселя 14,37 мкм, загальна контрастна роздільна здатність отриманих зображень була середньої якості і, отже, кількісні об'ємні вимірювання зазорів не могли бути проведені, що може вважатися обмеженням цього дослідження. Однак якість виходу була достатньою для ідентифікації та оцінки зон, що містять зазори, вздовж інтерфейсу GP-герметика за допомогою 2D трансаксіальних зображень. Хоча деякі можуть стверджувати, що розмір пікселя, використаний у цьому дослідженні, є великим, Пінто та ін. (2021) продемонстрували, що візуальна та автоматична сегментація можуть бути застосовані до зображень мікро-КТ з розмірами вокселів від 5 до 20 мкм для оцінки заповнення герметика з радіопрозорістю, що відповідає стандарту ISO 6876:2012 (ISO, 2012), такого як AH Plus (Silva et al., 2013) та EndoSequence BC Sealer (Candeiro et al., 2012).
Як і в цьому дослідженні, нещодавнє мікро-КТ дослідження також використовувало 2D зображення для оцінки інтерфейсу GP-герметика в кореневих каналах верхніх передніх зубів, заповнених одноразовою конусною технікою з використанням звичайного GP у поєднанні з герметиками AH Plus або EndoSequence BC (Zare et al., 2021), але сканування проводилося на пристрої високої роздільної здатності з меншим розміром пікселя (6 мкм). На відміну від теперішніх результатів, група AH Plus мала значно нижче співвідношення інтерфейсу GP-герметика (контакт) порівняно з EndoSequence BC, і ця різниця може бути пояснена деякими методологічними відмінностями, пов'язаними з морфологією кореневого каналу (яка була більш круглою), методом нанесення герметика (техніка «масляного» конуса), що сприяє матеріалам з низькою в'язкістю, таким як CSS. Крім того, для покращення загальної якості аналізу в даному дослідженні двоє досвідчених операторів виконували процедури сегментації та всі аналізи окремо, а остаточний результат був досягнутий шляхом угоди між ними. Особлива увага також була приділена забезпеченню порівнянності між експериментальними групами шляхом вирівнювання анатомічного фактора. Добре збалансовані експериментальні групи були створені шляхом вибору анатомічно відповідних кореневих каналів відповідно до AR, об'єму та 3D геометрії каналу після сканування 237 нижніх різців (De-Deus et al., 2020). Цей підхід дозволяє краще контролювати вплив спотворюючих факторів, які можуть виникнути через анатомічні варіації в морфології кореневого каналу на результати лабораторних досліджень. Враховуючи, що мінімізація зазорів в інтерфейсах GP-герметика та дентин-герметика є клінічно важливою для запобігання проникненню бактерій та/або їх побічних продуктів (Yücel & Çiftçi, 2006), теперішні результати повинні сприяти розвитку подальших досліджень для валідації заповнювальної здатності одноразової конусної техніки з CSS не лише в різних морфологіях каналів, але й у зубах, підготовлених за мінімально інвазивними підходами.
Висновки
В рамках експериментальної структури поточного дослідження можна зробити висновок, що AH Plus продемонстрував кращу якість адаптації на межі GP-герметика, ніж EndoSequence BC Sealer. Жоден з зразків не показав безпроміжкову межу.
Автори: Густаво Де-Деус, Густаво О. Сантос, Іара Замбоні Монтейро, Даніеле М. Кавалканте, Марко Сімойнс-Карвальо, Феліпе Г. Белладонна, Еммануель Ж. Н. Л. Сілва, Ерік М. Соуза, Рафаель Ліча, Карла Зогейб, Марко А. Версіяні
Посилання:
- Барборка, Б.Й., Вудменсі, К.Ф., Глікман, Г.Н., Шнейдерман, Е. & Хе, Дж. (2017) Довгострокові клінічні результати лікування зубів, заповнених Resilon. Журнал ендодонтії, 43, 556–560.
- Кандейро, Г.Т., Коррея, Ф.Ц., Дуарте, М.А., Рібейро-Сікейра, Д.Ц. & Гавіні, Г. (2012) Оцінка радіопрозорості, pH, вивільнення іонів кальцію та текучості біокерамічного герметика для кореневих каналів. Журнал ендодонтії, 38, 842–845.
- Дакульсі, Г., Пассуті, Н., Мартін, С., Деудон, С., Легерос, Р.З. & Рахер, С. (1990) Макропориста кераміка кальцієвого фосфату для хірургії довгих кісток у людей і собак. Клінічне та гістологічне дослідження. Журнал біомедичних матеріалів, 24, 379–396.
- Де-Деус, Г., Ді Джорджі, К., Фідель, С., Фідель, Р.А. & Пачіорнік, С. (2009) Сила зчеплення Resilon/Epiphany та Resilon/Epiphany self-etch до кореневої дентину. Журнал ендодонтії, 35, 1048–1050.
- Де-Деус, Г., Рейс, С., Ді Джорджі, К., Брандão, М.Ц., Ауді, С. & Фідель, Р.А. (2011) Інтерфейсна адаптація самоклеючого герметика Epiphany до кореневої дентину. Оральна хірургія, оральна медицина, оральна патологія, оральна радіологія та ендодонтія, 11, 381–386.
- Де-Деус, Г., Сімойнс-Карвальо, М., Белладонна, Ф.Г., Версіяні, М.А., Сілва, Е.Ж.Н.Л., Кавалканте, Д.М. та ін. (2020) Створення добре збалансованих експериментальних груп для порівняльних лабораторних досліджень ендодонтії: нова пропозиція на основі мікро-КТ та in silico методів. Міжнародний журнал ендодонтії, 53, 974–985.
- Деміркіран, Х. (2012) Біокераміка для остеогенезу, молекулярні та клітинні досягнення. У: Джандіал, Р. & Чен, М.Й. (Ред.) Регенеративна біологія хребта та спинного мозку. Досягнення в експериментальній медицині та біології. Нью-Йорк, NY: Springer, с. 760. Ельтаір, М., Пітчіка, В., Хікель, Р., Кюніш, Дж. & Діегріц, С. (2018)
- Оцінка інтерфейсу між гутаперчею та двома типами герметиків за допомогою скануючої електронної мікроскопії (SEM). Клінічні оральні дослідження, 22, 1631–1639.
- Еліасі, Й., Мойнзадех, А.Т. & Клевералан, С.Й. (2019) Характеризація вивільнень з 6 герметиків для кореневих каналів. Журнал ендодонтії, 45, 623–627.
- Еймірлі, А., Сунгур, Д.Д., Уянік, О., Пуралі, Н., Наґас, Е. & Чехреллі, З.Ц. (2019) Проникнення в дентинові канальці та можливість повторного лікування герметика на основі кальцієвого силікату, протестованого в обсязі або з різними основними матеріалами. Журнал ендодонтії, 45, 1036–1040.
- Фрідман, С.Е., Сандрік, Дж.Л., Хеюер, М.А. & Рапп, Г.В. (1977) Склад та фізичні властивості гутаперчевих ендодонтичних заповнювальних матеріалів. Журнал ендодонтії, 3, 304–308.
- Гандольфі, М.Г., Парріллі, А.П., Фіні, М., Праті, Ч. & Даммер, П.М. (2013) 3D мікро-КТ аналіз порожнин інтерфейсу, пов'язаних з кореневими заповненнями Thermafil, використаними з AH Plus або текучим MTA герметиком. Міжнародний журнал ендодонтії, 46, 253–263.
- Гюварк, М., Жанно, С., Жирауд, Т., Поммель, Л., Абу, І., Азім, А.А. та ін. (2020) Міжнародне опитування щодо використання герметиків на основі кальцієвого силікату в неоперативному ендодонтичному лікуванні. Клінічні оральні дослідження, 1, 417–424.
- Хегде, В. & Арора, С. (2015) Герметизаційна здатність нового гідрофільного та традиційного гідрофобного заповнювальних систем: дослідження бактеріальної витоку. Журнал консервативної стоматології, 18, 62–65.
- Гесс, Д., Соломон, Е., Спірс, Р. & Хе, Дж. (2011) Можливість повторного лікування біокерамічного герметика для кореневих каналів. Журнал ендодонтії, 37, 1547–1549.
- Хіраїші, Н., Садек, Ф.Т., Кінг, Н.М., Феррарі, М., Пашлі, Д.Х. & Тей, Ф.Р. (2008) Схильність матеріалу для заповнення кореневих каналів на основі полікарплактону до деградації за допомогою дифузійного тесту з агаром. Американський журнал стоматології, 21, 119–123.
- Хіраїші, Н., Яу, Дж.Й.Й., Лаушайн, Р.Й., Армстронг, С.Р., Уеллер, Р.Н., Кінг, Н.М. та ін. (2007) Схильність матеріалу для заповнення кореневих каналів на основі полікарплактону до деградації. III. Турбідиметрична оцінка ензиматичної гідролізи. Журнал ендодонтії, 33, 952–956.
- ISO. (2012) Міжнародний стандарт ISO 6876:2012: герметики для кореневих каналів. Женева: Швейцарія.
- Кетчем, Р.А. & Карлсон, В.Д. (2001) Отримання, оптимізація та інтерпретація рентгенівських комп'ютерних томографічних зображень: застосування до геонаук. Комп'ютери та геонауки, 27, 381–400.
- Кім, Дж.А., Хванг, Й.Ц., Роса, В., Ю, М.К., Лі, К.В. & Мін, К.С. (2018) Якість заповнення кореневих каналів преміксованим герметиком на основі кальцієвого силікату, застосованим за допомогою ультразвукової активації з конусом гутаперчі. Журнал ендодонтії, 44, 133–138.
- Кім, С., Кім, С., Парк, Дж.W., Чунг, І.Й. & Шин, С.Й. (2017) Порівняння відсотка порожнин у заповненні каналу герметиком на основі кальцієвого силікату та конусах гутаперчі за допомогою двох технік заповнення. Матеріали, 12(10), 1170.
- Ле Ферранд, Х. & Бача, А. (2021) Відкриття та повторне відкриття гутаперчі, природного термопластика. MRS Bulletin, 46, 84–85.
- Лі, Дж.К., Квак, С.В., Ха, Дж.Х., Лі, В.Ц. & Кім, Х.Ц. (2017) Фізико-хімічні властивості герметиків на основі епоксидної смоли та біокераміки. Біоінорганічна хімія та застосування, 2017, 1–8.
- ЛеГерос, Р.З. (1988) Матеріали кальцієвого фосфату в реставраційній стоматології: огляд. Досягнення в стоматологічних дослідженнях, 2, 164–180.
- Мойнзадех, А.Т., Зербст, В., Бутсіоукіс, К., Шемеш, Х. & Засланський, П. (2015) Розподіл пористості в кореневих каналах, заповнених гутаперчею та цементом на основі кальцієвого силікату. Стоматологічні матеріали, 31, 1100–1108.
- Мурер, В.Р. & Жене, Ж.М. (1982) Антибактеріальна активність конусів гутаперчі, що приписується компоненту оксиду цинку. Оральна хірургія, оральна медицина та оральна патологія, 53, 508–517.
- Нагендрабабу, В., Мюррей, П.Е., Ордінола-Запата, Р., Пітерс, О.А., Роціас, І.Н., Сікейра, Дж.Ф. молодший та ін. (2021) PRILE 2021 рекомендації щодо звітування про лабораторні дослідження в ендодонтії: пояснення та розширення. Міжнародний журнал ендодонтії, 54, 1491–1515.
- Нілакантан, П., Нандагопал, М., Шемеш, Х. & Веселінк, П. (2015) Вплив протоколів кондиціонування кореневої дентину на силу зчеплення трьох герметиків на основі кальцієвого силікату. Міжнародний журнал адгезії та адгезивів, 60, 104–108.
- Олівейра, Д.С., Кардозо, М.Л., Кейроз, Т.Ф., Сілва, Е.Ж., Соуза, Е.М. & Де-Деус, Г. (2016) Підоптимальні сили зчеплення герметиків на основі кальцієвого силікату. Міжнародний журнал ендодонтії, 49, 796–801.
- Педулла, Е., Абіад, Р.С., Конте, Г., Ла Роса, Г.Р.М., Рапісарда, Е. & Нілакантан, П. (2020) Заповнення коренів з конусом з відповідним конусом та двома герметиками на основі кальцієвого силікату: аналіз порожнин за допомогою мікро-комп'ютерної томографії. Клінічні оральні дослідження, 24, 4487–4492.
- Пінто, Дж.Ц., Торрес, Ф.Ф.Е., Лукас-Олівейра, Е., Бонагамба, Т.Й., Геррейро-Таномару, Дж.М. & Таномуару-Фільо, М. (2021) Оцінка вигнутого кореневого каналу, заповненого новим біокерамічним герметиком: мікрокомп'ютерна томографія за допомогою зображень з різними розмірами вокселів та методами сегментації. Дослідження мікроскопії та техніки, 84, 2960–2967.
- Сагсен, Б., Устюн, Й., Демірбуга, С. & Пала, К. (2011) Сила зчеплення двох нових герметиків на основі кальцієвого силікату до дентину кореневого каналу. Міжнародний журнал ендодонтії, 44, 1088–1091.
- Шіппер, Г., Øрставік, Д., Тейшейра, Ф.Б. & Тропе, М. (2004) Оцінка мікробної витоку в коренях, заповнених термопластичним синтетичним полімерним матеріалом для заповнення кореневих каналів (Resilon). Журнал ендодонтії, 30, 342–347.
- Шіппер, Г., Тейшейра, Ф.Б., Арнольд, Р.Р. & Тропе, М. (2005) Періапікальна запалення після коронального мікробного інокулювання коренів собак, заповнених гутаперчею або Resilon. Журнал ендодонтії, 31, 91–96.
- Сілва, Е.Ж.Н.Л., Канабарро, А., Андраде, М.Р.Т.Ц., Кавалканте, Д.М., фон Стеттен, О., Фідальго, Т.К.Д.С. та ін. (2019) Стійкість до вивільнення біокерамічних та епоксидних герметиків: систематичний огляд та мета-аналіз. Журнал практики стоматології на основі доказів, 19, 221–235.
- Сілва, Е.Ж.Н.Л., Ейргардт, І.Ц., Сампайо, Г.Ц., Кардозо, М.Л., Олівейра, Д.Д.С., Узеда, М.Ж. та ін. (2021) Визначення затвердіння герметиків для кореневих каналів за допомогою експериментальної моделі на тваринах in vivo. Клінічні оральні дослідження, 25, 1899–1906.
- Сілва, Е.Ж., Роса, Т.П., Еррера, Д.Р., Жасінто, Р.Ц., Гомес, Б.П. & Зая, А.А. (2013) Оцінка цитотоксичності та фізико-хімічних властивостей герметика на основі кальцієвого силікату MTA Fillapex. Журнал ендодонтії, 39, 274–277.
- Сілва, Е.Ж.Н.Л., Зая, А.А. & Пітерс, О.А. (2017) Цитосумісність герметиків на основі кальцієвого силікату в тривимірній моделі клітинної культури. Клінічні оральні дослідження, 21, 1531–1536.
- Сілва-Альмейда, Л.Х., Мораес, Р.Р., Моргенталь, Р.Д. & Паппен, Ф.Г. (2017) Чи можна порівняти преміксовані герметики на основі кальцієвого силікату з традиційними матеріалами? Систематичний огляд in vitro досліджень. Журнал ендодонтії, 43, 527–535.
- Стрендж, К.А., Тавіл, П.З., Філліпс, С., Валія, Х.Д. & Фуада, А.Ф. (2019) Довгострокові результати ендодонтичного лікування, проведеного з Resilon/Epiphany. Журнал ендодонтії, 45, 507–512.
- Сун, Дж., Ейделман, Н. & Лін-Гібсон, С. (2009) 3D картографування усадки полімеризації за допомогою рентгенівської мікро-комп'ютерної томографії для прогнозування мікровитоку. Стоматологічні матеріали, 25, 314–320.
- Таномару-Фільо, М., Торрес, Ф.Ф.Е., Чавес-Андраде, Г.М., де Алмейда, М., Наварро, Л.Г., Стейер, Л. та ін. (2017) Фізико-хімічні властивості та об'ємна зміна силікону/біоактивного скла та герметиків на основі кальцієвого силікату. Журнал ендодонтії, 43, 2097–2101.
- Тей, Ф.Р., Лаушайн, Р.Й., Ламбретс, П., Уеллер, Р.Н. & Пашлі, Д.Х. (2005а) Геометричні фактори, що впливають на зчеплення дентину в кореневих каналах: теоретичний підхід до моделювання. Журнал ендодонтії, 31, 584–589.
- Тей, Ф., Пашлі, Д., Вільямс, М., Рейна, Р., Лаушайн, Р., Уеллер, Р. та ін. (2005б) Схильність матеріалу для заповнення кореневих каналів на основі полікарплактону до деградації. I. Лужна гідролізація. Журнал ендодонтії, 31, 593–598.
- Тей, Ф.Р., Пашлі, Д.Х., Юй, С.К.Й., Яу, Дж.Й.Й., Юй-фай, М., Лаушайн, Р.Й. та ін. (2005в) Схильність матеріалу для заповнення кореневих каналів на основі полікарплактону до деградації. II. Гравіметрична оцінка ензиматичної гідролізи. Журнал ендодонтії, 31, 737–741.
- Тей, Ф.Р. & Пашлі, Д.Х. (2007) Моноблоки в кореневих каналах: гіпотетична чи реальна мета. Журнал ендодонтії, 33, 391–398.
- Тей, Ф.Р., Пашлі, Д.Х., Лаушайн, Р.Й., Куттлер, С., Гарсія-Годой, Ф., Кінг, Н.М. та ін. (2007) Схильність матеріалу для заповнення кореневих каналів на основі полікарплактону до деградації. Докази біодеградації з симульованого польового тесту. Американський журнал стоматології, 20, 365–369.
- Тейшейра, Ф.Б., Тейшейра, Е.Ц., Томпсон, Дж.Й. & Тропе, М. (2004) Стійкість до зламу коренів, ендодонтично лікуваних новим матеріалом для заповнення смолою. Журнал Американської стоматологічної асоціації, 135, 646–652.
- Торрес, Ф.Ф.Е., Зордан-Бронзель, К.Л., Геррейро-Таномару, Дж.М., Чавес-Андраде, Г.М., Пінто, Дж.Ц. & Таномуару-Фільо, М. (2020) Вплив занурення в дистильовану воду або фосфатно-буферний розчин на розчинність, об'ємну зміну та наявність порожнин у нових герметиках на основі кальцієвого силікату. Міжнародний журнал ендодонтії, 53, 385–391.
- Віапіана, Р., Мойнзадех, А.Т., Каміллері, Л., Веселінк, П.Р., Таномуару Фільо, М. & Каміллері, Дж. (2016) Пористість та герметизаційна здатність заповнень коренів з гутаперчею та герметиками BioRoot RCS або AH Plus. Оцінка трьох ex vivo методів. Міжнародний журнал ендодонтії, 49, 774–782.
- Уілсон, А.Д., Клінтон, Д.Й. & Міллер, Р.П. (1973) Цементи оксиду цинку-евгенолу: IV. Мікроструктура та гідроліз. Журнал стоматологічних досліджень, 52, 253–260.
- Вольфмейер, У., Шмідт, Х., Хайнріхс, Ф.Л., Міхальчик, Г., Пайер, В., Дітше, В. та ін. (2002) Воски. У: Енциклопедія промислової хімії Ульмана. Т. 39. Вейнхайм: Вайлі:112–172.
- Янпісет, К., Баномйонг, Д., Чотворрак, К. & Срисатджалук, Р.Л. (2018) Бактеріальна витік та оцінка мікро-комп'ютерної томографії в каналах круглої форми, заповнених біокерамічним конусом та герметиком за допомогою техніки відповідного одиночного конуса. Відновлювальна стоматологія та ендодонтія, 43, e30.
- Юсель, А.Ц. & Чифтчі, А. (2006) Вплив різних технік заповнення кореневих каналів на бактеріальне проникнення. Оральна хірургія, оральна медицина, оральна патологія, оральна радіологія та ендодонтія, 102, e88–e92.
- Заре, С., Шен, І., Чжу, Q., Аhn, C., Прімус, C. & Комабаяші, Т. (2021) Мікро-комп'ютерна томографія оцінки одиночного конуса заповнення з трьома герметиками. Відновлювальна стоматологія та ендодонтія, 46, e25.
- Зайгер, Д.Н., Сун, Дж., Шумахер, Г.Е. & Лін-Гібсон, С. (2009) Оцінка усадки стоматологічних композитів та витоку в екстрагованих зубах за допомогою рентгенівської мікро-комп'ютерної томографії. Стоматологічні матеріали, 25, 1213–1220.
- Чжан, В., Лі, З. & Пень, Б. (2010) Вплив iRoot SP на експресію генів, пов'язаних з мінералізацією, у клітинах MG63. Журнал ендодонтії, 36, 1978–1982.
- Зордан-Бронзель, К.Л., Естевес Торрес, Ф.Ф., Таномуару-Фільо, М., Чавес-Андраде, Г.М., Боссо-Мартело, Р. & Геррейро-Таномару, Дж.М. (2019) Оцінка фізико-хімічних властивостей нового герметика на основі кальцієвого силікату, Bio-C sealer. Журнал ендодонтії, 45, 1248–1252.

/social-network-service/media/default/6758/89a8282e.png)