Додаткові етапи дезінфекції кореневої системи моляра нижньої щелепи: кореляційний бактеріологічний, мікро-комп'ютерна томографія та кріопульверизаційний підхід
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання).
Анотація
Вступ: Це дослідження оцінювало дезінфікуючу здатність хіміомеханічної обробки з використанням ротаційних інструментів з нікель-титану, за якою слідували 2 різні додаткові процедури в кореневих каналах видалених нижніх молярів за допомогою кореляційного аналітичного підходу.
Методи: Було обрано двадцять два видалені нижні моляри, які були анатомічно співвіднесені між групами на основі мікро-комп'ютерної томографії. На першій фазі експерименту кореневі канали були забруднені Enterococcus faecalis і піддані хіміомеханічній обробці з інструментами BT RaCe та зрошенню 2.5% NaOCl. Потім або інструмент XP-Endo Finisher, або пасивне ультразвукове зрошення використовувалися для доповнення дезінфекції. Мікро-комп'ютерна томографія використовувалася для визначення, чи корелює відсоток незроблених ділянок з бактеріальними кількостями. На другій фазі ті ж зуби знову були забруднені, і були використані додаткові процедури. Зразки з області істму мезіальних коренів та апікального 5-мм фрагмента дистальних коренів були отримані шляхом кріопульверизації. Зразки, взяті до та після етапів лікування в обох фазах, були оцінені за допомогою кількісної полімеразної ланцюгової реакції та статистично проаналізовані.
Результати: У фазі 1 підготовка в обох групах призвела до суттєвого зменшення кількості бактерій (P < .001). Додаткові підходи призвели до подальшого незначного зменшення бактерій, що було значущим для XP-Endo Finisher (P < .05). Не було виявлено значущих відмінностей між групами за залишковими кількостями бактерій. Кореляційний аналіз не виявив статистично значущого зв'язку між зменшенням бактерій та відсотком непідготовлених ділянок (P > .05). У фазі 2 обидва методи мали значні антибактеріальні ефекти в основному каналі, але жоден з них не зміг передбачувано дезінфікувати області істмуса/рецесів.
Висновки: Як XP-Endo Finisher, так і пасивна ультразвукова іригація продемонстрували антибактеріальну ефективність, але лише перший з них призвів до значного зменшення кількості бактерій після хемомеханічної підготовки. Жоден з них не був ефективним у передбачуваній дезінфекції областей істмуса/рецесів. (J Endod 2016;42:1667–1672).
Незалежно від технік інструментування, інструментів та іригантів, ретельне очищення, дезінфекція та формування кореневого каналу не були досягнуті в більшості випадків, особливо у зубах з вигнутими каналами або незвичайною анатомією. Дослідження, що використовували технологію мікро-комп'ютерної томографії високої роздільної здатності (мікро-КТ), показали, що 11%–48% основних ділянок кореневого каналу залишаються неушкодженими після інструментування. Ці ділянки можуть бути колонізовані біоплівками, які мають потенціал залишатися неушкодженими і ставити під загрозу результати лікування. Більше того, певні анатомічні складнощі системи кореневих каналів, такі як розгалуження, заглиблення та істмуси, зазвичай не досягаються інструментами та іригантами. Бактерії, що знаходяться в цих ділянках, можуть зберігатися і призводити до стійкого апікального періодонтиту. Насправді, клінічні бактеріологічні дослідження продемонстрували, що бактерії все ще виявляються приблизно в 30%–60% каналів після хіміомеханічної підготовки. Бактерії, що зберігаються в каналі, є найважливішим фактором ризику для посттерапевтичного апікального періодонтиту. Зусилля були спрямовані на розробку додаткових підходів для покращення дезінфекції кореневих каналів. Це включає підходи, які сприяють доставці іригантів до важкодоступних ділянок або дозволяють інструменту досягати та механічно очищати неушкоджені області. Один з цих додаткових підходів - пасивна ультразвукова іригація (ПУІ), яка включає ультразвукову активацію іригенту. Дані з in vitro та in vivo досліджень, що оцінюють переваги в термінах антибактеріальних ефектів додаткового підходу ПУІ з NaOCl, були невизначеними.
Інструмент XP-Endo Finisher (FKG Dentaire, La Chaux-de-Fonds, Швейцарія) нещодавно був представлений з обіцянкою покращити очищення та дезінфекцію кореневих каналів. Це інструмент розміру 25 без конусності, виготовлений з сплаву нікель-титан (NiTi) MaxWire (Martensite-Austenite Electropolish FleX). При кімнатній температурі інструмент є прямим у своїй мартенситній фазі, але при температурі тіла він переходить у аустенітну фазу і набуває форми ложки; при обертанні та русі вгору-вниз у каналі ця форма дозволяє інструменту розширюватися та скорочуватися, торкаючись стінок каналу та перемішуючи іригаційний розчин. Нещодавнє дослідження показало, що XP-Endo Finisher та PUI успішно зменшили рівні твердих залишків у мезіальному кореневому каналі в порівнянні з традиційною іригацією та модифікованим протоколом системи саморегулюючих файлів. Досі лише 1 дослідження вивчало антибактеріальні переваги використання XP-Endo Finisher і повідомило про кращі результати, ніж традиційна іригація. Жодне дослідження не оцінювало антибактеріальні ефекти цього інструменту після хемомеханічних процедур.
Дане дослідження було спрямоване на оцінку дезінфекційної та формуючої здатності хіміомеханічної підготовки з ротаційними NiTi інструментами, за якими слідували 2 різні додаткові підходи в кореневих каналах видалених нижніх молярів за допомогою кореляційного бактеріологічного та мікро-КТ аналізу. Для оцінки бактеріологічних умов ізтму та рецесивних ділянок після використання або інструмента XP-Endo Finisher, або процедур PUI було використано підхід кріопульверизації.
Матеріали та методи
Вибір та підготовка зубів
Протокол дослідження був затверджений Етичним комітетом Університету Естасіо де СА, Ріо-де-Жанейро, RJ, Бразилія. Було обрано двадцять два видалених нижніх моляра з 2 незалежними каналами, з'єднаними апікально ізтмом у мезіальному корені (тип Вертуcci II) та одним дистальним каналом (тип Вертуcci I) з колекції з 185 нижніх молярів на основі рентгенограм, зроблених у буколінгвальному та мезіодистальному напрямках, дослідження з використанням малих файлів після підготовки доступу та мікро-КТ зображення за допомогою сканера SkyScan 1174v2 (Bruker-microCT, Контіх, Бельгія), що працює на 50 Кв, 800 мА, ізотропна роздільна здатність 19.86 мм та 180◦ обертання навколо вертикальної осі з кроком обертання 1.0 за допомогою алюмінієвого фільтра товщиною 0.5 мм.
Зображення кожного зразка були реконструйовані з корекцією артефактів кільця 5, корекцією жорсткості променя 15% та згладжуванням 5 (NRecon v.1.6.9.16; Bruker-microCT). Програмне забезпечення CTAn v.1.14.4 (Bruker-microCT) використовувалося для тривимірної (3D) оцінки кореневих каналів щодо об'єму та площі поверхні, а програмне забезпечення CTVol v.2.2.1 (Bruker-microCT) використовувалося для візуалізації та якісної оцінки конфігурації системи кореневих каналів. Зразки були парно зіставлені на основі морфологічних та анатомічних аспектів мезіальних та дистальних систем кореневих каналів, оцінених за допомогою мікро-КТ, і 1 зразок з кожної пари був випадковим чином призначений до однієї з 2 експериментальних груп.
Кореневі канали досліджувалися за допомогою ручних K-файлів #15, поки кінчик інструмента не досяг апікального отвору, що було візуалізовано стереомікроскопом. Цей показник був зафіксований як довжина прохідності, і канали спочатку розширювалися до цієї точки за допомогою інструмента BioRaCe BR2 (25/04) (FKG Dentaire), який працював у моторі VDW Gold (VDW, Мюнхен, Німеччина) на 300 об/хв, 1.5 Н • см, щоб стандартизувати початковий діаметр каналу та створити місце для бактеріального забруднення. Шар змиву був видалений за допомогою 17% EDTA та 2.5% NaOCl для зрошення. NaOCl був інактивований 5% натрію тіосульфатом. Зуби були знову відскановані в мікро-КТ, використовуючи раніше згадані параметри, а отримані набори даних були використані як базова лінія для порівняння з зображеннями після підготовки.
Фаза 1
Для контамінації кореневі канали були заповнені бульйоном триптикази сої (Difco, Детройт, МІ) за допомогою голок Navitip (Ultradent Products Inc, Південний Джордан, ЮТ) до тих пір, поки бульйон не почав витікати через апікальний отвор. Зуби були поміщені в колбу, що містила 50 мл бульйону триптикази сої, і ультразвуковому оброблені протягом 1 хвилини, щоб вивільнити захоплене повітря та дозволити проникнення культури середовища в нерівності кореневого каналу. Далі зуби були стерилізовані в автоклаві. Свіжа культура Enterococcus faecalis ATCC 29212, вирощена протягом 24 годин при 37◦C, була використана як інокулянт для контамінації кореневих каналів. Зуби інкубувалися протягом 30 днів при 37◦C під м'яким струшуванням, а культура середовища оновлювалася щотижня. Пізніше всі контаміновані зуби мали надлишок культури середовища стікати, а їх зовнішні кореневі поверхні були протерті стерильним марлею. Два зуби були зафіксовані в 10% буферному формаліні та оброблені для скануючої електронної мікроскопії (SEM), щоб підтвердити бактеріальну колонізацію, як описано в інших джерелах.
Апікальні отвори кожного кореня були запечатані Topdam (FGM, Жуанвіль, SC, Бразилія), щоб запобігти апікальному бактеріальному витоку та створити закриту систему. Перед підготовкою кореневого каналу зовнішні поверхні кореня були очищені 3% перекисом водню та дезінфіковані 2.5% NaOCl, після чого активність останнього була нейтралізована 5% натрію тіосульфатом. Зуби були встановлені вертикально до шийки в блоки, виготовлені з силіконового матеріалу для відбитків (President Jet; Coltène AG, Куяга Фоллс, OH). Коронка зуба, включаючи стінки пульпної камери, та силіконова поверхня були дезінфіковані 2.5% NaOCl, після чого активність цієї речовини була нейтралізована 5% натрію тіосульфатом. Зразки були взяті з кореневого каналу за допомогою паперових точок до (P1S1) та після хіміомеханічної підготовки (P1S2) та після додаткового підходу (P1S3) (Рис. 1A). Кореневий канал був промитий 1 мл стерильного 0.85% сольового розчину, щоб видалити неприкріплені клітини, і 3–5 стерильних паперових точок використовувалися послідовно на робочій довжині (WL), яка була встановлена на 0.5 мм від довжини прохідності. Кожна паперова точка залишалася в каналі протягом 1 хвилини. Паперові точки були перенесені в трубки, що містять 1 мл буфера Tris-EDTA (10 ммоль/л Tris-HCl, 1 ммоль/л EDTA, pH 7.6) та заморожені при –20◦C. У мезіальному корені зразки були взяті з кожного каналу, але вони були об'єднані для подальшого бактеріологічного аналізу, оскільки 2 канали злилися в 1 в апікальній частині. Канали були підготовлені на WL за допомогою системи BT RaCe (FKG Dentaire), що працювала в моторі VDW Gold на 600 об/хв, 1.5 N • см, до інструменту BT3. Полив проводився за допомогою 2.5% NaOCl, що подавався голками Navitip, які вводилися на 2 мм коротше за WL (Рис. 1A). Під час інструментування мезіальних каналів отвір дистального каналу був запечатаний Topdam (і навпаки), щоб уникнути витоку іригантів у нього. Після апікальної підготовки канал був промитий NaOCl, EDTA (для видалення шлакової плівки), а потім знову NaOCl (Рис. 1A). Після нейтралізації NaOCl 5% натрію тіосульфатом, зразок P1S2 був взятий, як описано вище, і зуби з кожної групи піддавалися або PUI, або XP-Endo Finisher додатковим процедурам наступним чином.
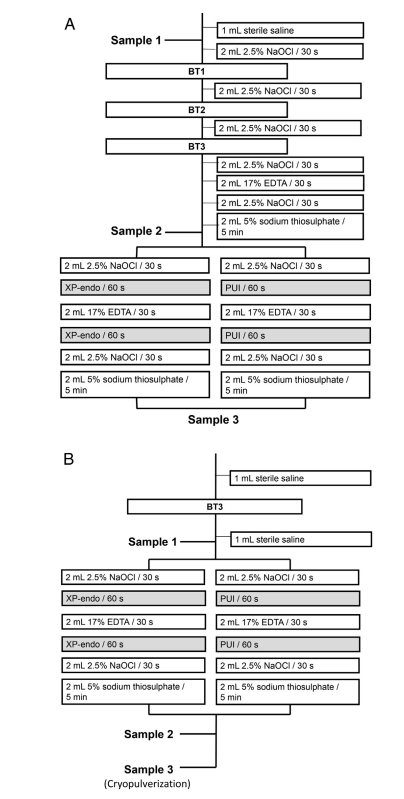
PUI.
Кореневі канали промивали 2 мл 2,5% NaOCl, який ультразвуково активували в каналі протягом 1 хвилини за допомогою пристрою EndoUltra (Vista Dental Products, Racine, WI), з наконечником зонда, розташованим на 1 мм коротше від робочої довжини. Канали промивали 2 мл EDTA, який ультразвуково активували так само, як і вище, після чого проводили остаточне промивання 2,5% NaOCl. Нарешті, NaOCl був інактивований 2 мл 5% натрію тіосульфату, і був взятий зразок P1S3.
Інструмент XP-Endo Finisher.
XP-Endo Finisher працював до WL протягом 1 хвилини після іригації 2 мл 2,5% NaOCl. Інструмент був підключений до мотора VDW Gold на 800 об/хв, 1 N • см, з повільними рухами вгору-вниз довжиною 7-8 мм. Кореневі канали потім іригувалися 17% EDTA, і XP-Endo використовувався знову. Після фінальних іригацій 2,5% NaOCl та натрію тіосульфату був взятий зразок P1S3.
Той же фінальний об'єм іригаторів використовувався для кожної групи, з 14 мл NaOCl на канал. У обох групах іригатори попередньо підігрівалися до 37◦C для внутрішньоканальних процедур, які проводилися при 37◦C всередині шафи з обігрівачем (800-Heater; PlasLabs, Лансинг, Мічиган).
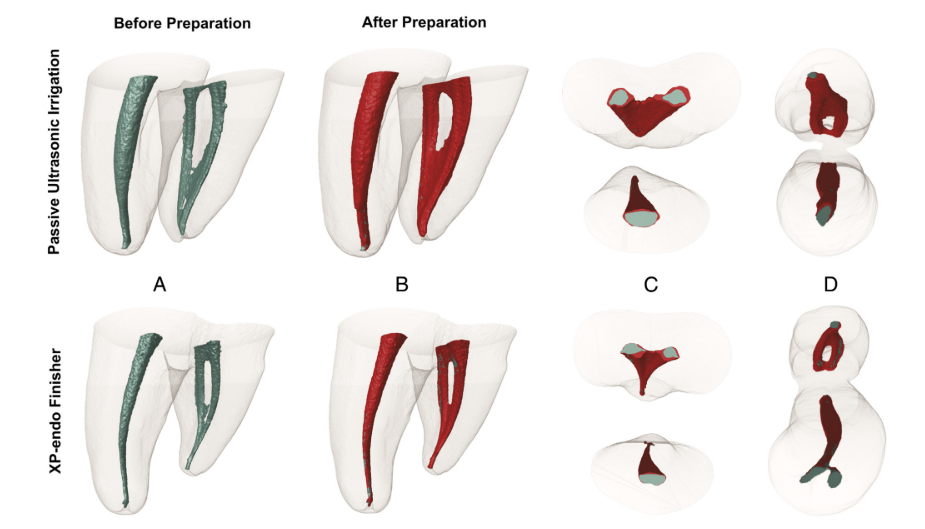
Зразки були автоклавовані та піддані новому мікро-КТ скануванню з використанням вищезгаданих параметрів. Передопераційні та післяопераційні кольорові 3D моделі мезіальних каналів були створені (CTVol v.2.2.1; Bruker-microCT) та співвіднесені з відповідними передопераційними наборами даних (зелений та червоний вказують на передопераційні та післяопераційні поверхні каналу відповідно) за допомогою модуля жорсткої реєстрації програмного забезпечення 3D Slicer 4.3.1 (доступно за http://www.slicer.org), з точністю більше 1 вокселя. Потім співвіднесені зображення були досліджені для розрахунку об'єму (мм3) та площі поверхні (мм2) мезіальної системи кореневих каналів до та після підготовки за допомогою програмного забезпечення CTAn v.1.14.4 (Bruker micro-CT). Площа незайманої поверхні каналу визначалася шляхом обчислення кількості статичних вокселів і виражалася у відсотках від загальної кількості вокселів, присутніх на поверхні каналу.
Фаза 2
Ті ж зразки зубів з фази 1 були використані в другій фазі експерименту. Вісімнадцять зубів все ще були доступні. Цю другу фазу було проведено для збільшення кількості зубів з каналами, позитивними на наявність бактерій, перед застосуванням додаткових підходів, що дозволило провести більш надійне статистичне порівняння. Крім того, стало можливим протестувати обидва підходи проти більш контрольованих початкових бактеріальних навантажень. Нарешті, оцінка ефектів ізольованого додаткового підходу на зони істмуса була включена в цей другий експеримент.
Зуби були стерилізовані в автоклаві, забруднені та закріплені, як описано в фазі 1. Далі кореневі канали були промиті 1 мл фізіологічного розчину і знову оброблені інструментом BT3, щоб трохи зменшити початкове бактеріальне навантаження. P2S1 було взято, як у фазі 1. Кожен канал був промитий 2 мл 2.5% NaOCl, і або інструмент XP-Endo Finisher, або PUI були використані, як було описано раніше (Рис. 1B). Після промивання EDTA додаткові підходи були виконані ще раз, а потім канал був промитий NaOCl і натрію тіосульфатом. Зразок P2S2 був зібраний.
На основі мікро-КТ зображень перетину кореневих каналів було встановлено положення істму в мезіальному корені, а зразки були відрізані за допомогою стерильних двосторонніх алмазних дисків для отримання кореневих фрагментів, що містять істм, для аналізу. Дистальні корені мали один сплюснутий канал, що містив заглиблення, і були розділені на 5 мм від верхівки. Кореневі фрагменти, що відповідали зоні істму мезіального кореня та апікальній частині дистального кореня, мали свої зовнішні поверхні очищені 3% перекисом водню та дезінфіковані 2.5% NaOCl, який був подальше інактивований натрію тіосульфатом. У послідовності зовнішні кореневі поверхні були відібрані за допомогою стерильного паперового пункту #80, зволоженого буфером Tris-EDTA. Цей зразок слугував контролем стерильності та оцінювався за допомогою кількісної реакції полімеразної ланцюгової реакції в реальному часі (qPCR). Ці процедури дезінфекції та контролю відбору зразків проводилися під операційним мікроскопом. Для кріогенного подрібнення кожного кореневого фрагмента використовувався млин 6750 (Spex, Metuchen, NJ), що працював при температурі рідкого азоту, як описано в інших джерелах. Після подрібнення апікальні зразки кореневого порошку (P2S3) були суспендовані в буфері Tris-EDTA та зберігалися при –20◦C.
Виділення ДНК та qPCR аналіз
ДНК була виділена з зразків обох експериментальних фаз і використана як шаблон для кількісного визначення E. faecalis клітин за допомогою qPCR аналізу, націленого на ген 16S рРНК. Кроки виділення ДНК та qPCR, контролі та умови були описані раніше. Усі вимірювання проводилися в трьох екземплярах.
Статистичний аналіз
Для порівняння внутрішньогрупового зменшення бактеріальних кількостей з P1S1/P2S1 до P1S2/P2S2, P1S1/P2S1 до P1S3/P2S3, і P1S2/P2S2 до P1S3/P2S3 використовувався тест Вілкоксона для парних спостережень. Початкові зразки (P1S1/P2S1) порівнювалися між групами за допомогою непараметричного тесту Манна-Уїтні U тесту, який не виявив значних відмінностей між ними (P> .05). Тому той же тест використовувався для порівняння кількостей у зразках P1S2/P2S2 та P1S3/P2S3 між групами. Спочатку аналізи проводилися для мезіальних і дистальних коренів окремо. Оскільки не було значних відмінностей між мезіальними і дистальними каналами, дані також були зібрані для підвищення надійності статистичного аналізу. Для перевірки зв'язків між зменшенням бактерій та відсотком непідготовлених ділянок використовувався аналіз кореляції Пірсона. Статистичні аналізи проводилися за допомогою STATISTICA версії 8 (StatSoft, Талса, ОК) з рівнем значущості, встановленим на 5%.
Результати
Аналіз SEM виявив, що E. faecalis колонізував стінки кореневого каналу, зазвичай утворюючи структури, схожі на біоплівку (дані не показані). Колонізація кореневого каналу була додатково підтверджена позитивними результатами qPCR у зразках P1S1/P2S1 з усіх зубів.
Фаза 1
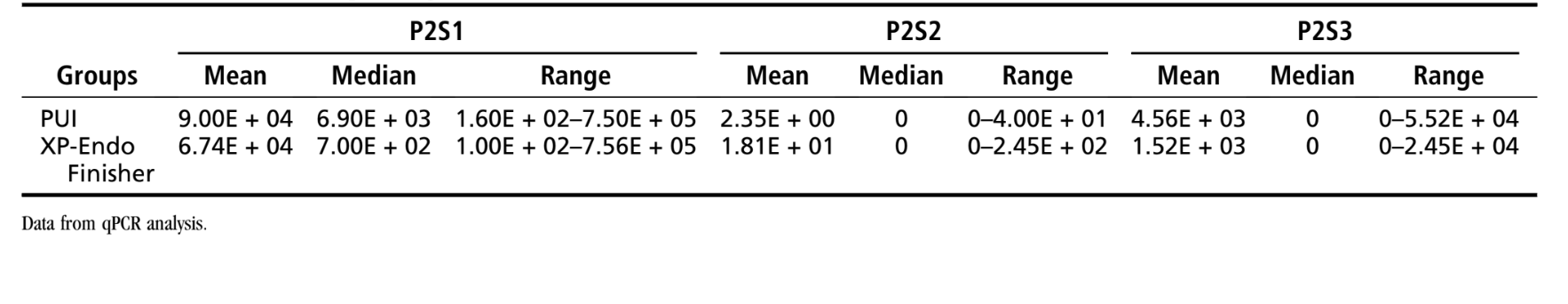
Таблиця 1 показує середнє, медіану та діапазон кількостей E. faecalis , спостережуваних для тестових груп. У групі XP-Endo Finisher кількість E. faecalis була суттєво знижена з P1S1 до P1S2 (P < .001). Після використання інструмента XP-Endo (P1S3) відбулося додаткове значне зниження (P < .05). Усі 20 зразків були позитивними на E. faecalis в P1S1, 6 в P1S2 та 6 в P1S3. У групі PUI початкові бактеріальні кількості (P1S1) також були суттєво знижені після підготовки (P1S2) (P < .001). Хоча бактеріальні кількості були ще більше знижені в P1S3, вони не відрізнялися суттєво від P1S2 (P > .05). Усі 20 зразків були позитивними в P1S1, 10 в P1S2 та 7 в P1S3. Не було виявлено суттєвих відмінностей при порівнянні P1S3 між групами XP-Endo та PUI (P > .05).

Статистичний аналіз мезіальних і дистальних даних окремо показав відсутність значущості для всіх порівнянь між P1S2 і P1S3 (P > .05), за винятком мезіальних каналів у групі XP-Endo Finisher (P < .05). Дані з мезіальних і дистальних коренів окремо наведені в Додатковій таблиці S1.
Мікро-КТ аналіз не показав значних відмінностей у початкових об'ємах каналів між групами (P > .05). Що стосується непідготовлених ділянок, середнє відсоткове значення статичних вокселів становило 4.5% (медіана, 4.3%) для групи XP-Endo Finisher і 4.3% (медіана, 5.4%) для групи PUI (P > .05) (Рис. 2). Кореляційний аналіз не виявив статистично значущого зв'язку між зменшенням бактерій і відсотком непідготовлених ділянок (P > .05).
Фаза 2
Таблиця 2 показує кількісні дані з фази 2. У групі XP-Endo Finisher кількість E. faecalis у P2S1 була значно знижена після використання цього інструменту (P< .001). Усі 18 зразків були позитивними на наявність бактерій у P2S1, 2 у P2S2 та 4 у P2S3 (пульверизовані зразки). Процедура PUI також була дуже ефективною у зменшенні кількості бактерій у головному каналі (P< .001). Усі 18 зразків були позитивними на наявність бактерій у P2S1, 1 у P2S2 та 6 у P2S3 (пульверизовані зразки). Не було виявлено значних відмінностей при порівнянні ефектів XP-Endo та PUI у P2S2 (головні канали) або P2S3 (істмуси/рекеси) (P> .05). Статистичний аналіз даних мезіальних і дистальних зразків окремо також не показав значних відмінностей між групами (P> .05) (Додаткова таблиця S2).
Обговорення
Це дослідження корелювало різні аналітичні інструменти для оцінки, у 2 експериментальних фазах, антибактеріальних ефектів додаткових підходів у системі кореневих каналів нижніх молярів. У першій фазі оцінювалися ефекти 2 процедур, які використовувалися безпосередньо після хіміомеханічної обробки з ротаційним NiTi інструментом та зрошенням NaOCl. Цей аналіз був обмежений антибактеріальними ефектами в основному кореневому каналі, визначеними за допомогою паперових точок. Оскільки 50% (група PUI) і 70% (група XP-Endo Finisher) випадків показали негативні результати на наявність бактерій у P1S2, було зменшено розмір вибірки для міжгрупового аналізу P1S3, і була розроблена друга фаза для збільшення кількості каналів, підданих обом підходам, та включення аналізу їхніх ефектів не лише в основних каналах, але й в істмусах та зворотних зонах шляхом кріогенного шліфування кореня для взяття зразків.
У першій фазі хіміомеханічна обробка з BT RaCe та зрошення NaOCl сприяла суттєвому усуненню бактерій у обох групах, що узгоджується з попередніми дослідженнями. Тоді як додатковий етап процедури з PUI не зміг значно зменшити кількість бактерій, внутрішньоканальні E. faecalis кількості після використання XP-Endo Finisher були значно нижчими, ніж ті, що були отримані безпосередньо після обробки. Значно кращі результати для XP-Endo спостерігалися в мезіальних коренях. У другій фазі початкові зразки складалися з початкового нижчого бактеріального навантаження, щоб дозволити порівняння обох підходів з бактеріальними числами, які відповідають тому, з чим додаткові процедури очікується стикатися в клінічній ситуації. У цій фазі підходи PUI та XP-Endo Finisher були подібними та надзвичайно ефективними у зменшенні кількості бактерій в основному каналі.
Що стосується ділянок перешийка/заглиблень, руйнівний характер підходу кріопульверизації не дозволив провести довгостроковий аналіз. Тому неможливо зробити висновок, чи негативні результати були наслідком впливу допоміжних підходів або невдалої бактеріальної контамінації в цих областях. Однак не було суттєвих відмінностей у кількості бактерій між групами. Кількість у ділянці перешийка (P2S3) дійсно була вищою, ніж у головному каналі (P2S2), що свідчить про те, що ефекти PUI та XP-Endo Finisher у цій області непередбачувані. Це, разом із виявленням кількох зубів з негативними зразками каналу та позитивними зразками перешийка, підкреслює обмеження підходу з паперовими пунктами в відборі зразків з системи кореневих каналів.
Загальні результати для інструмента XP-Endo Finisher були обнадійливими, оскільки він загалом показав порівнянні результати з PUI, широко рекомендованим допоміжним підходом. У недавньому дослідженні інструмент XP-Endo Finisher був більш ефективним, ніж інші техніки, у дезінфекції простору головного каналу. Дизайн та спіральний рух інструмента, можливо, дозволили йому досягти раніше недоступних областей і зрушити бактеріальні біоплівки. Збільшення оброблених ділянок не було оцінено за допомогою мікро-КТ через мінімальні, якщо такі є, ріжучі можливості інструмента XP-Endo Finisher.
Наші результати з PUI узгоджуються з кількома дослідженнями, які повідомляли про відсутність значного покращення дезінфекції після підготовки. Антибактеріальні ефекти PUI, як вважається, пов'язані з кавітацією, акустичним потоком і нагріванням іриганта, але якщо ці явища дійсно відбуваються в кореневому каналі, вони, здається, не є достатніми для значного підвищення елімінації бактерій.
Не було виявлено кореляції між відсотком непідготовлених ділянок і рівнями бактерій у P1S3, що узгоджується з попереднім дослідженням. Існує можливість, що в деяких зразках незаймані ділянки основного каналу могли не бути колонізовані бактеріями. Більше того, можливо, що непідготовлені ділянки дійсно були дезінфіковані іригацією NaOCl. Обмеження процедури вибіркового відбору в статті також могли пояснити цю відсутність кореляції.
Сучасний експериментальний дизайн має кілька помітних аспектів. Для вибору та узгодження зубів за анатомічними подібностями перед розподілом між групами використовувалися мікро-КТ сканування, що мінімізує змінні, властиві анатомії. Крім того, впродовж експериментів використовувалися нагріті іриганти. Це було необхідно, оскільки інструмент XP-Endo Finisher зазнає фазової трансформації при температурі тіла. Тоді ми вирішили включити підігріті розчини на всіх етапах експерименту, який також проводився в шафі з температурою, що підтримується на рівні 37◦C. Більшість попередніх досліджень на видалених зубах проводилися при кімнатній температурі. Оскільки температура може впливати на антибактеріальну активність NaOCl, рекомендується проводити антибактеріальні тести при температурі, подібній до температури тіла. Ще однією перевагою цього дослідження було використання qPCR для кількісного визначення бактерій. Цей підхід є дуже чутливим і може бути надійно використаний у кріоподрібнених зразках (пілотні дослідження, що використовували культуру, показали втрату бактеріальних підрахунків через метод подрібнення). Використання кріоподрібнення, в свою чергу, було необхідним для дозволу аналізу антибактеріальних ефектів протестованих підходів у таких областях, як істми і заглиблення, які можуть не бути належним чином відібрані за допомогою паперових точок.
Хоча це дослідження є інноваційним у поєднанні різних аналітичних підходів, воно також має обмеження. Взяття проб за допомогою паперових точок зазвичай обмежується основним каналом, і деякі області, такі як нерівності, істмі та заглиблення, можуть не бути охоплені. Обмеження техніки паперових точок було очевидним на фазі 2, коли більше каналів виявилися позитивними на наявність бактерій у P2S3, ніж у P2S2; також були показані вищі середні показники для P2S3. Крім того, оскільки взяття проб за допомогою паперових точок не розрізняє сегмент основного каналу, залишається невідомим, в якій частині залишилися бактерії. Кріопульверизація може обійти ці обмеження, але це руйнівний метод і може бути використаний лише для поперечного аналізу. Іншим обмеженням може бути використання qPCR для виявлення бактерій. Існує занепокоєння, що ДНК з клітин, які нещодавно загинули внаслідок антибактеріального лікування, також може бути виявлена цим методом. Проте попереднє дослідження, яке використовувало подібний in vitro протокол, не показало значної різниці в кількості бактерій між культурою та qPCR у зразках після лікування. Це, разом з високою частотою негативних результатів qPCR у зразках після лікування, сильно вказує на те, що ДНК з мертвих клітин, можливо, не була значною проблемою в даному дослідженні. Вільна ДНК може бути розкладена NaOCl або могла бути змита під час іригації.
На завершення, це дослідження продемонструвало, що обидва допоміжні підходи спричинили невелике зменшення бактеріальних показників після хіміомеханічної обробки, що було значущим лише для XP-Endo Finisher. Ані XP-Endo, ані PUI не були ефективними у передбачуваній дезінфекції істмусів/рекесів нижніх молярів.
Автори: Флавіо Р.Ф. Алвес, Карлос В. Андраде-молодший, Марілія Ф. Марселіано-Алвес, Алехандро Р. Перес, Ізабела Н. Роціас, Марко А. Версіані, Мануел Д. Соуза-Нето, Хосе С. Провенцано, Хосе Ф. Сікейра
Посилання:
- Сікейра Дж.Ф. молодший, Араухо М.Ц., Гарсія П.Ф. та ін. Гістологічна оцінка ефективності п’яти технік інструментування для очищення апікальної третини кореневих каналів. J Endod 1997;23:499–502.
- Петерс О.А., Шоненбергер К., Лайб А. Вплив чотирьох технік підготовки Ni-Ti на геометрію кореневого каналу, оцінений за допомогою мікро-комп’ютерної томографії. Int Endod J 2001;34: 221–30.
- Вера Дж., Сікейра Дж.Ф. молодший, Річуччі Д. та ін. Одно- проти двох-візитного ендодонтичного лікування зубів з апікальним періодонтитом: гістобактеріологічне дослідження. J Endod 2012;38: 1040–52.
- Паке Ф., Цендер М., Де-Деус Г. Порівняння на основі мікротомографії рециркуляційної техніки F2 ProTaper з ротаційною повною послідовністю. J Endod 2011; 37:1394–7.
- Марктарт М., Дарванн Т.А., Ларсен П. та ін. Мікро-CT аналізи апікального розширення та складності кореневих каналів молярів. Int Endod J 2012;45:273–81.
- Сікейра Дж.Ф. молодший, Алвес Ф.Р., Версіані М.А. та ін. Кореляційний бактеріологічний та мікро-комп’ютерний томографічний аналіз мезіальних каналів нижніх молярів, підготовлених саморегульованими файлами, системами Reciproc та Twisted File. J Endod 2013;39:1044–50.
- Петерс О.А., Аріас А., Паке Ф. Мікро-комп’ютерна томографічна оцінка підготовки кореневого каналу з новим інструментом TRUShape в мезіальних коренях нижніх молярів. J Endod 2015;41:1545–50.
- Річуччі Д., Сікейра Дж.Ф. молодший. Біоплівки та апікальний періодонтит: дослідження поширеності та асоціації з клінічними та гістопатологічними знахідками. J Endod 2010;36:1277–88.
- Річуччі Д., Сікейра Дж.Ф. молодший, Бейт А.Л., Пітт Форд Т.Р. Гістологічне дослідження зубів, оброблених кореневими каналами з апікальним періодонтитом: ретроспективне дослідження двадцяти чотирьох пацієнтів. J Endod 2009;35:493–502.
- Паіва С.С., Сікейра Дж.Ф. молодший, Роціас І.Н. та ін. Доповнення антимікробних ефектів хіміомеханічного очищення або пасивною ультразвуковою іригацією, або фінальним промиванням хлоргексидином: клінічне дослідження. J Endod 2012;38:1202–6.
- Бістрем А. Оцінка ендодонтичного лікування зубів з апікальним періодонтитом [одонтологічна дисертація № 27]. Умеа, Швеція: Університет Умеа; 1986.
- Віанна М.Е., Хорц Х.П., Гомес Б.П., Конрадс Г. Оцінка зниження мікробів in vivo після хіміомеханічної обробки людських кореневих каналів, що містять некротичну пульпу. Int Endod J 2006;39:484–92.
- Сйогрен У. Успіх і невдача в ендодонтії [одонтологічна дисертація № 60]. Умеа, Швеція: Університет Умеа; 1996.
- Невес М.А., Провенцано Дж.Ц., Роціас І.Н., Сікейра Дж.Ф. молодший. Клінічна антибактеріальна ефективність підготовки кореневого каналу з рециркуляційними одноінструментними або безперервно обертовими багатоструменевими системами. J Endod 2016;42:25–9.
- Сікейра Дж.Ф. молодший, Роціас І.Н. Клінічні наслідки та мікробіологія бактеріальної стійкості після лікувальних процедур. J Endod 2008;34:1291–13013.
- Сікейра Дж.Ф. молодший, Роціас І.Н. Оптимізація дезінфекції за один візит з допоміжними підходами: пошук передбачуваності. Aust Endod J 2011;37:92–8.
- Алвес Ф.Р., Алмейда Б.М., Невес М.А. та ін. Дезінфекція овальних кореневих каналів: ефективність різних допоміжних підходів. J Endod 2011;37:496–501.
- Тардиво Д., Поммель Л., Ла Скола Б. та ін. Антибактеріальна ефективність пасивної ультразвукової та звукової іригації: ультразвукова іригація кореневих каналів. Odontostomatol Trop 2010;33:29–35.
- Карвер К., Нустейн Дж., Рідер А., Бек М. Антибактеріальна ефективність ультразвуку in vivo після ручного та ротаційного інструментування в людських нижніх молярах. J Endod 2007; 33:1038–43.
- Паіва С.С., Сікейра Дж.Ф. молодший, Роціас І.Н. та ін. Молекулярна мікробіологічна оцінка пасивної ультразвукової активації як допоміжного дезінфікуючого етапу: клінічне дослідження. J Endod 2013;39:190–4.
- Дебеліан Г., Тропе М. Очищення третього виміру. Ендодонтична практика 2015;8: 22–4.
- Леоні Г.Б., Версіані М.А., Сілва-Соуса Й.Т. та ін. Ex vivo оцінка чотирьох фінальних протоколів іригації на видалення твердих залишків з мезіальної системи кореневих каналів нижніх перших молярів. Int Endod J 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
- Азім А.А., Аксель Х., Чжуан Т. та ін. Ефективність 4 протоколів іригації в знищенні бактерій, колонізованих у дентинних канальцях, досліджена за допомогою нової конфокальної лазерної мікроскопії. J Endod 2016;42:928–34.
- Сікейра Дж.Ф. молодший, Алвес Ф.Р., Алмейда Б.М. та ін. Здатність хіміомеханічної підготовки з ротаційними інструментами або саморегульованими файлами дезінфікувати овальні кореневі канали. J Endod 2010;36:1860–5.
- Алвес Ф.Р., Сікейра Дж.Ф. молодший, Кармо Ф.Л. та ін. Профілювання бактеріальної спільноти з криогенно подрібнених зразків з апікальних і корональних сегментів коренів зубів з апікальним періодонтитом. J Endod 2009;35:486–92.
- Антунес Х.С., Роціас І.Н., Алвес Ф.Р., Сікейра Дж.Ф. молодший. Загальні та специфічні бактеріальні рівні в апікальній системі кореневих каналів зубів з постлікувальним апікальним періодонтитом. J Endod 2015;41:1037–42.
- Алвес Ф.Р., Роціас І.Н., Алмейда Б.М. та ін. Кількісний молекулярний та культурний аналізи бактеріального знищення в овальних кореневих каналах за допомогою техніки однофайлового інструментування. Int Endod J 2012;45:871–7.
- ван дер Слуіс Л.В., Верслуіс М., Ву М.К., Весселінк П.Р. Пасивна ультразвукова іригація кореневого каналу: огляд літератури. Int Endod J 2007;40:415–26.
- Мартін Х. Ультразвукова дезінфекція кореневого каналу. Oral Surg Oral Med Oral Pathol 1976;42:92–9.
- Ахмад М., Пітт Форд Т.Р., Крам Л.А. Ультразвукове очищення кореневих каналів: погляд на механізми, що беруть участь. J Endod 1987;13:93–101.
- Сіртес Г., Вальтімо Т., Шаецле М., Цендер М. Вплив температури на короткострокову стабільність натрію гіпохлориту, здатність до розчинення пульпи та антимікробну ефективність. J Endod 2005;31:669–71.
- Сікейра Дж.Ф. молодший, Роціас І.Н. Використання молекулярних методів для дослідження ендодонтичних інфекцій: частина 1—сучасні молекулярні технології для мікробіологічної діагностики. J Endod 2005;31:411–23.
- Маккарті С.Ц., Атлас Р.М. Вплив розміру амплікона на ПЛР-детекцію бактерій, які піддаються впливу хлору. PCR Methods Appl 1993;3:181–5.
- Фуад А.Ф., Баррі Дж. Вплив антибіотиків та ендодонтичних антимікробних засобів на реакцію полімеразної ланцюгової реакції. J Endod 2005;31:510–3.


