Контрастно-посилена мікро-КТ для оцінки дебридування тканини зубного пульпи в кореневих каналах видалених зубів: серія каскадних експериментів для валідації методу
Машинний переклад
Оригінальна стаття написана мовою EN (посилання для прочитання) .
Анотація
Мета: Валідація нового методу оцінки дебридування пульпової тканини в кореневих каналах видалених зубів за допомогою протоколу імпрегнації, що включає калійний трйодид, радіоконтрастний розчин, відомий як розчин Люголя, в поєднанні з мікрокомп'ютерною томографією (мікро-КТ).
Методологія: Вплив NaOCl на радіопрозорість розчину Люголя оцінювався за допомогою дворазової серії розведення Люголя в дистильованій воді та 5.25% NaOCl, які потім були перенесені в прозорі посудини та рентгенографовані. Для перевірки впливу Люголя на протеолітичний ефект NaOCl був проведений тест на розчинення з використанням свіжого яловичого м'яса. Десять слайсів не підлягали жодній обробці тканини, тоді як двадцять слайсів були зафіксовані у формальдегіді на 24 години. Після цього 10 з них були занурені в розчин Люголя ще на 24 години. Потім усі зразки були поміщені в NaOCl, і час, необхідний для повного розчинення тканини, був зафіксований. Для останніх експериментів (гістологічна валідація та оцінка мікро-КТ) 8 видалених нижніх премолярів з раніше життєздатними пульпами були занурені в буферизований формалін, відскановані в пристрої мікро-КТ, оцінені, занурені в розчин Люголя на 7 днів і знову відскановані. Потім кореневі канали 5 зубів були підготовлені та відскановані, а об'єм залишкової пульпової тканини ідентифікований і кількісно визначений, тоді як 3 зуби були гістологічно оброблені. Ті ж зразки були піддані гістологічній оцінці, а зображення гістологічних зрізів були зареєстровані з відповідними зображеннями мікро-КТ, щоб перевірити, чи відповідає пульпова тканина в гістологічних зрізах її аналогам у тканинах, імпрегнованих розчином Люголя, ідентифікованих у зрізах мікро-КТ.
Результати: Не було помітного впливу на радіопрозорість, коли NaOCl змішували з розчином Люголя. Обробка тканин не вплинула на час, необхідний для повного розчинення свіжого яловичого м'яса. Гістологічна оцінка виявила кореляцію між мікро-КТ та гістологічними зображеннями, що підтверджує ідентифікацію тканини пульпи, просоченої Люголем, на зображеннях мікро-КТ. Висновки: Радіоконтрастний розчин Люголя не піддавався впливу NaOCl і не заважав його здатності розчиняти м'які тканини. Протокол імпрегнації з використанням розчину Люголя дозволив візуалізувати тканину пульпи на зображеннях мікро-КТ та ідентифікувати залишки пульпи після хімічно-механічних процедур обробки каналів.
Вступ
Звичайний аналіз гістологічних зрізів та використання рентгенівської мікро-комп'ютерної томографії (мікро-КТ) вважаються золотим стандартом методів для оцінки процедур очищення та формування під час підготовки кореневих каналів. Хоча мікро-КТ дозволяє ідентифікувати та кількісно оцінювати мінералізовані тканини кореневого каналу, що були видалені механічною підготовкою, кількість залишкової (немінералізованої) тканини пульпи зазвичай оцінюється на гістологічних зрізах. Таким чином, незважаючи на корисність технології мікро-КТ, цей метод був обмежений оцінкою змін уздовж стінок каналу, включаючи транспортування та створення аномалій, таких як зіпи та перфорації. Завдяки проникаючій силі рентгенівських променів, техніки мікро-КТ надають 3D-карту щільності зразків та тканин, які сильно поглинають це випромінювання (Alfaro та ін. 2015, Cunha та ін. 2015). Однак це не підходить для зображення м'яких тканин, таких як зубна пульпа, оскільки ці тканини поглинають рентгенівські промені в дуже обмеженій мірі (Gignac & Kley 2014).
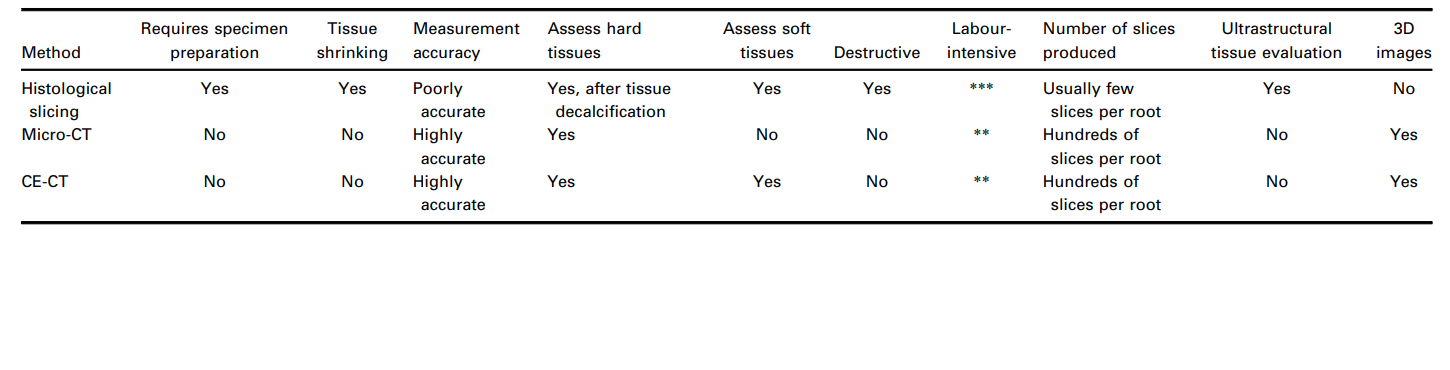
Нещодавно в двох дослідженнях було застосовано кореляційний підхід, використовуючи гістологію як додатковий метод для оцінки мікро-КТ, щоб оцінити різні хемомеханічні протоколи в кореневих каналах (Lacerda et al. 2017, Siqueira et al. 2018). Обидва дослідження гістологічно продемонстрували наявність залишків пульпної тканини, що прикріплені до неушкоджених стінок каналу, раніше виявлених за допомогою аналізу мікро-КТ. Хоча цей кореляційний підхід, що використовує різні методи, може дозволити визначити механізми причинності, гістологічний аналіз зазвичай дозволяє оцінити лише кілька зрізів на корінь, що надає дуже обмежені дані і не відповідає обсягу інформації в сотнях перетинів, які зазвичай отримуються при скануванні мікро-КТ типового кореневого каналу. Більше того, гістологічне секціонування є трудомісткою та дорогою процедурою, яка знищує зразок.
Очевидно, що бажано розробити надійний недеструктивний експериментальний метод, здатний одночасно оцінювати якість і кількість м'яких і твердих тканин у гетерогенному зразку, такому як людський зуб. У інших дослідницьких областях це обмеження було подолано за допомогою різних контрастних агентів, таких як осмій, золото, сульфат барію та йодовані барвники (Metscher 2009a, b, Faulwetter et al. 2013, Pauwels et al. 2013). Загалом, було продемонстровано, що водний розчин йоду Люголя, також відомий як йод-калій йодид (I2KI), є одним з найефективніших засобів для швидкого розрізнення різноманітних типів м'яких тканин. Розчин Люголя є простим, економічним, нетоксичним і швидким варіантом фарбування для підвищення контрастності м'яких тканин. Проте його використання було обмежене анатомічними дослідженнями широкого спектру біологічних зразків з використанням різних концентрацій йоду та тривалості фарбування, залежно від типу тканини (Heimel et al. 2019). Наразі, незважаючи на те, що імпрегнація Люголем є найбільш широко використовуваним контрастним агентом в анатомічному дослідженні м'яких тканин, досі неясно, чи буде цей розчин підходити для оцінки мікро-КТ пульпної тканини після дебридменту кореневого каналу ex vivo. Однією з основних проблем при використанні Люголя є натрію гіпохлорит (NaOCl), основний ендодонтичний іригант, що використовується для розчинення некротичної пульпної тканини (Zehnder 2006), який реагує з йодом (Vogel 1978) і, таким чином, може перешкоджати його імпрегнації та видимості на рентгенографічних зображеннях.
У даній комунікації представлено серію каскадних експериментів, що мають на меті впровадження та дослідження потенціалу візуалізації пульпної тканини зуба на мікро-КТ зображеннях за допомогою Люголя як контрастуючого розчину. Каскад експериментів був спрямований на валідацію протоколу імпрегнації та методу мікро-КТ з підвищеним контрастом (CE-CT), а також на виявлення переваг і потенційних обмежень цієї нової методології. Каскадні експерименти були спроектовані для:
- Оцінки потенціалу NaOCl для зменшення ступеня радіографічного контрасту, пов'язаного з Люголем (тест на радіопрозорість);
- Перевірки можливості впливу розчину Люголя на протеолітичний ефект NaOCl (тест на розчинення м'яких тканин);
- Оцінки здатності розчину Люголя належним чином імпрегнувати пульпну тканину шляхом кореляційної візуалізації мікро-КТ з підвищеним Люголем та звичайної гістології (гістологічна валідація);
- Вимірювання залишкового об'єму імпрегнованої Люголем пульпної тканини (об'ємна оцінка мікро-КТ).
Матеріали та методи
Вплив NaOCl на радіопрозорість розчину Люголя
Розчин Люголя (I2KI), що використовувався для всіх експериментів, мав концентрацію 5% I2 та 10% KI. Для оцінки впливу NaOCl на його радіопрозорість була проведена серія розведень 1:1 у дистильованій воді та 5.25% NaOCl (загальний об'єм 1.5 мл). Чистий розчин та його розведення були відміряні в круглі прозорі посудини з полістиролу (Semadeni, Остермундіген, Швейцарія) з внутрішнім діаметром 23.4 мм на глибину 3.5 мм. Радіопрозорість визначали за допомогою стандартної установки, як описано раніше (Hertig та ін. 2017). Коротко, електронні набори даних генерувалися за допомогою фіксованого пристрою (Trophy, Париж, Франція) при 65 кВ, 8 мА та 0.22 с з відстанню фокус-фільм 25 см та електронними сенсорами (Digora; Soredex, Туусула, Фінляндія). Зображення аналізувалися за допомогою ImageJ (Бетесда, Меріленд, США). Сірі значення були нормалізовані в кожному зображенні відносно алюмінієвого ступеневого клина, з індивідуальною стандартною кривою для кожного зображення. Експерименти проводилися в трьох екземплярах. Відносна радіопрозорість розчину Люголя та його розведень виражена як алюмінієвий еквівалент (в мм) на мм розчину.
Тест на розчинення м'яких тканин
Тридцять шматків свіжого яловичого м'яса були відрегульовані до схожої ваги (2 мг) та розмірів (4 x 4 мм) за допомогою хірургічного леза № 15. Десять шматків не піддавалися жодній обробці тканин, тоді як інші 20 були зафіксовані у формальдегіді на 24 години. Після цього 10 з зафіксованих шматків були додатково занурені в розчин Люголя ще на 24 години. Потім усі зразки були поміщені окремо в колби, що містили 40 мл 5,25% NaOCl, і загальний час, необхідний для повного розчинення пульпної тканини (в хвилинах), був зафіксований. Усі тестові процедури проводилися при кімнатній температурі. Це дослідження не класифікувалося як дослідження на тваринах, оскільки не впливало на премортальну долю або процес забою тварин. Попередній аналіз сирих даних вказував на дотримання гауссового розподілу (тест Шапіро–Уїлка, P < 0.05). Дані порівнювалися між групами за допомогою одностороннього ANOVA, за яким слідував тест HSD Тьюкі. Альфа-помилка була визнана на рівні 5%.
Оцінка залишків пульпового тканини за допомогою мікро-КТ
Після затвердження місцевим етичним комітетом (протокол № 12127319.3.0000.5243) вісім некаріозних однокореневих нижніх премолярів та один нижній моляр з життєздатними пульпами, видалені з ортодонтичних причин, були занурені в 10% буферний формалін і зберігалися до 30 днів при 15 °C. Після цього зуби були відскановані з розміром пікселя 14.37 мкм за допомогою пристрою мікро-КТ (SkyScan 1173; Bruker microCT, Контіх, Бельгія), налаштованого на 70 кВ, 114 мА, 360° обертання навколо вертикальної осі з кроком обертання 0.5°, середнім значенням кадру 5, використовуючи алюмінієвий фільтр товщиною 1.0 мм. Програмне забезпечення NRecon v.1.7.16 (Bruker micro-CT) було використано для реконструкції проекцій мікро-КТ в аксіальні зрізи з використанням корекції артефактів кільця 4, меж контрасту від 0.006 до 0.05 та корекції жорсткості променя 40%, що призвело до отримання 800–900 зображень у градаціях сірого на зуб від з'єднання цементу та емалі до верхівки. Для перевірки морфології каналу перетинні зображення були сегментовані за допомогою автоматичної рутини (De-Deus та ін. 2020) у програмному забезпеченні FIJI/ImageJ (Fiji v.1.51n; Мадісон, ВІ, США), а співвідношення сторін кореневого каналу, визначене як співвідношення великих до малих діаметрів, було виміряно в кожному зрізі від отвору до апікального отвору. Потім об'єм каналу (в мм3) був розрахований як об'єм бінаризованого кореневого каналу в межах об'єму інтересу.
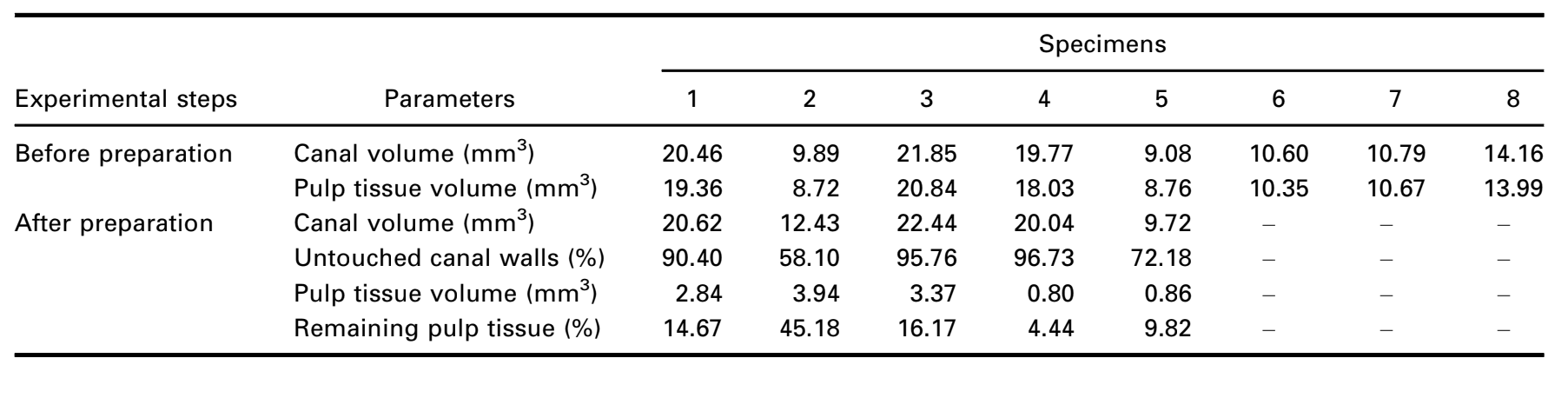
Після підготовки звичайної доступної порожнини кожен зуб був занурений у розчин Люголя на 7 днів і підданий новому скануванню та процедурам реконструкції з використанням раніше згаданих параметрів для оцінки імпрегнації всієї пульпної тканини контрастним розчином. Цей набір зображень був корегований з нефарбованим набором даних за допомогою афінного алгоритму, реалізованого в програмному забезпеченні 3D Slicer 4.6.0 (http://www.slicer.org) (Федоров та ін. 2012), і дентин кореня зуба після занурення був видалений за допомогою булевої операції для зменшення шуму, що виникає внаслідок сегментації пульпної тканини. Таким чином, пульпна тканина, імпрегнована розчином Люголя, була спостережена та кількісно оцінена (в мм3) за допомогою процесу сегментації з використанням специфічного порогового значення, за допомогою інструменту Object Counter, доступного в програмному забезпеченні FIJI/ImageJ. Після цього кореневі канали 5 з 8 вибраних премолярів були хемомеханічно підготовлені, тоді як інші 4 здорові зуби (3 премоляри та 1 моляр) були підготовлені для гістологічного секціонування, щоб підтвердити наявність залишків пульпної тканини (контрольна група).
Підготовка кореневих каналів
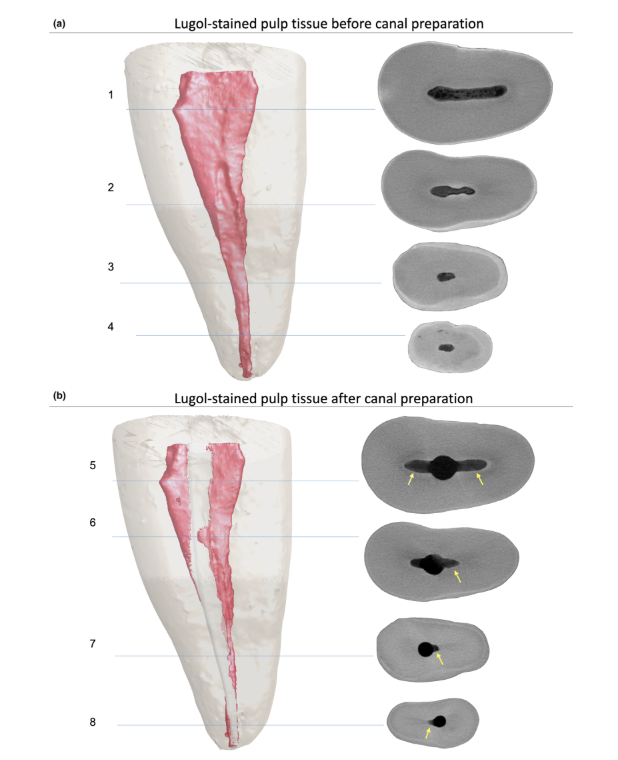
Кореневі канали були підготовлені до робочої довжини за допомогою інструмента Reciproc R25 (VDW GmbH, Мюнхен, Німеччина), що приводився в дію мотором VDW Silver (VDW GmbH) у програмі ‘RECIPROC ALL’, використовуючи легкий апікальний тиск з повільним рухом вгору-вниз амплітудою 3 мм. Після завершення трьох рухів інструмент був витягнутий з каналу, а його канавки очищені шляхом вставлення в губку, зволожену спиртом. Робоча довжина була досягнута після 3 хвиль інструментування. Апікальна прохідність була перевірена за допомогою K-файлу розміру 15 (Dentsply Sirona Endodontics, Баллаїг, Швейцарія) протягом всіх процедур підготовки. Іригація проводилася загалом 12 мл 5.25% NaOCl, введеного в кореневий канал за допомогою голки 31-G NaviTip з подвійним бічним портом (Ultradent Inc., Південний Джордан, Юта, США), що вводилася на 1 мм коротше робочої довжини протягом всіх процедур підготовки. Після підготовки кореневих каналів зразки були повторно відскановані, реконструйовані та співвіднесені, використовуючи вищезазначені параметри. Потім обсяг залишків пульпової тканини, просочених розчином Люголя, був розрахований (в мм3) і кількісно оцінений у відсотковому значенні на основі початкового обсягу пульпової тканини.
Гістологічна оцінка
Після експериментальних процедур, описаних вище, зразки демінералізували в 22,5% (об./об.) формальній кислоті плюс 10% (ваг./об.) розчині натрію цитрату протягом 2–3 тижнів. Кінцеву точку контролювали радіографічно. Потім зразки промивали протягом 24 годин у водопровідній воді, дегідратували та обробляли для рутинного гістологічного дослідження. Зуби вморожували в парафінові блоки, і серійні зрізи товщиною 0,6 мкм отримували кожні 1 мм від цементно-емалевої межі до верхівки, в результаті чого отримували 8 зрізів на зуб. Отримані зрізи монтували на скляні пластини та фарбували гематоксиліном-еозином. Гістологічні зображення візуалізували за допомогою повністю моторизованого світлового мікроскопа Axioplan 2 Imaging (Carl Zeiss Vision, Hallbergmoos, Німеччина).
Суміщення мікро-КТ зображень, імпрегнованих Люголем, та гістологічних зрізів
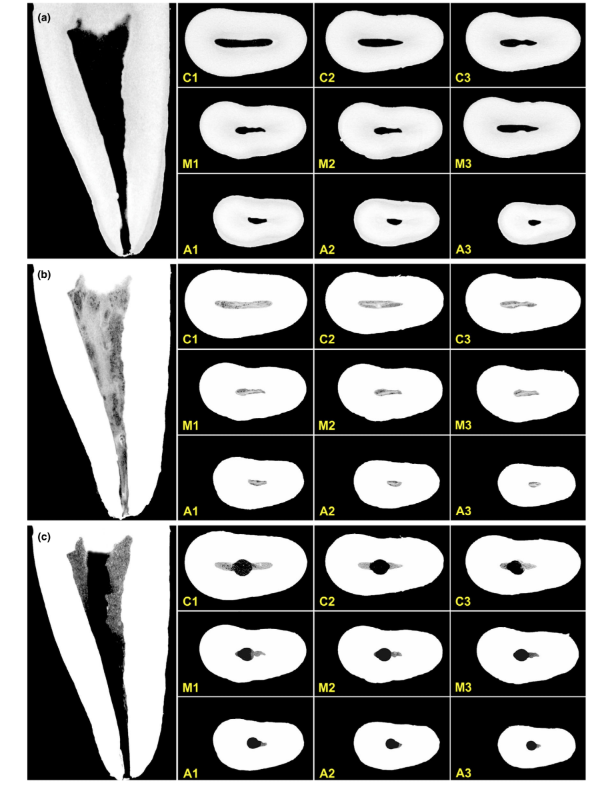
Отримані мікро-КТ зрізи, що містять імпрегновану Люголем пульпову тканину, були перевірені вздовж осі z за допомогою системи координат на основі алгоритму реєстрації, заснованого на орієнтирах (програмне забезпечення Analyze; Biomedical Imaging Resource, Mayo Clinic, Рочестер, Міннесота, США), щоб вирівняти їх з мікрорентгенограмами гістологічних зрізів. Після вибору відповідних зображень було виконано коригування розмірів, яке включало автоматичне збільшення, зміни розміру та обрізання, за допомогою комп'ютерної процедури. Цей процедурний етап дозволив експертам надійно перевірити корені на тих же рівнях і, таким чином, якісно підтвердити, чи відповідає пульпова тканина в гістологічному зрізі своїй відповідності в мікро-КТ зрізі, імпрегнованому Люголем, підтверджуючи ефективність протоколу імпрегнації та параметрів сканування. Два попередньо калібровані експерти використовували проформу з попередньо визначеними критеріями для аналізу ступеня відповідності між зображеннями, імпрегнованими Люголем, та гістологічними зображеннями. Процедура аналізу зображень виконувалася на 34-дюймовому моніторі високої якості з можливістю збільшення зображень (до 10x) та зміни кольорового режиму. Для валідації аналітичного процесу аналізи повторювалися двічі з інтервалом у 10 днів для оцінки відтворюваності.
Результати
Вплив NaOCl на радіопрозорість розчину Люголя
Чистий розчин Люголя мав радіопрозорість 0.70 ± 0.09 мм Al мм-1. Розведення в 5.25% NaOCl мало подібний ефект на радіопрозорість, як контрольна процедура у воді, при цьому вищі розведення в NaOCl показували трохи вищу радіопрозорість (Рис. 1), що базується на різниці в радіопрозорості між чистим 5.25% NaOCl розчином і водою в 0.05 мм Al мм-1. Не було помітного впливу на радіопрозорість, викликаного хімічною взаємодією між NaOCl і розчином Люголя, що було видно за очищенням коричневого кольору в присутності NaOCl.
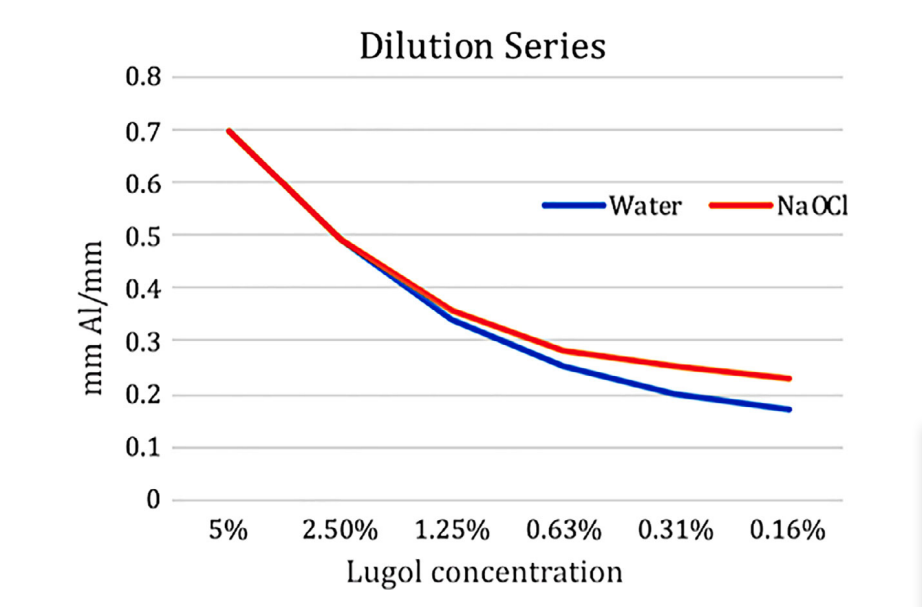
Тест на розчинення м'яких тканин
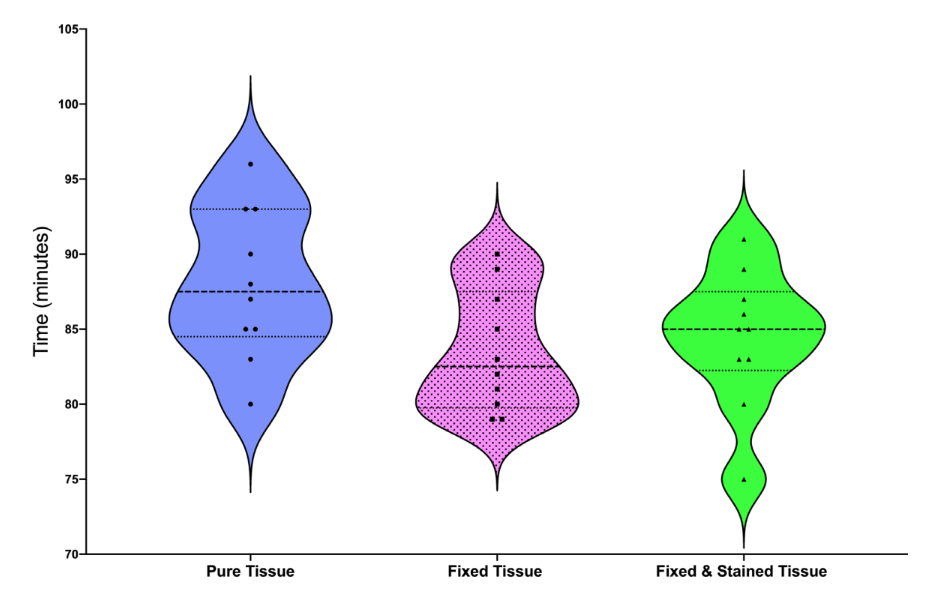
Графіки у вигляді скрипки ілюструють середнє, мінімальне та максимальне значення, а також розподіл даних про розчинення тканин серед зразків (Рис. 2). Обробка тканин у формальдегіді та розчині Люголя не вплинула на час, необхідний для розчинення свіжого яловичого м'яса (P > 0.05).
Гістологічна валідація
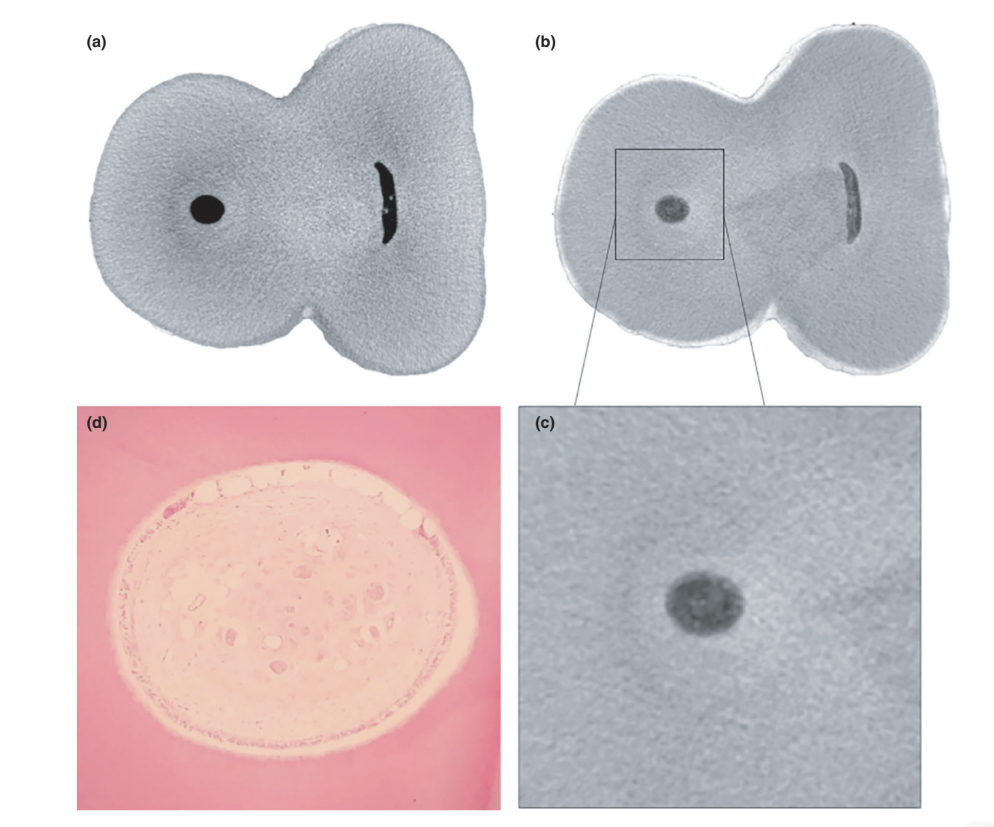
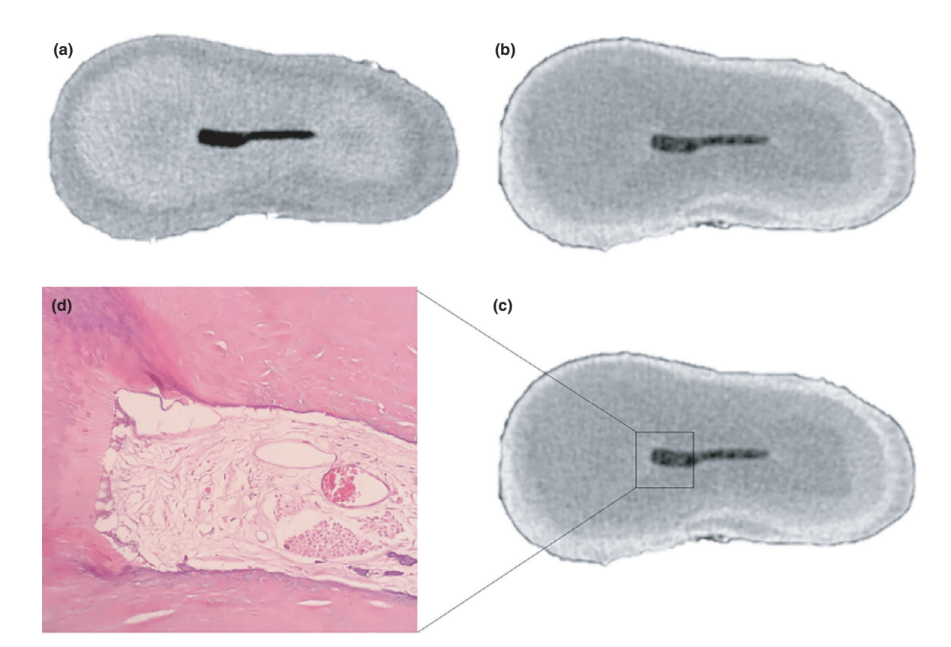
Загальна якість використаного протоколу фарбування ілюструється на малюнку 3. Кореляційний аналіз між мікро-КТ та гістологічними зображеннями підтвердив ідентичність тканини пульпи, просоченої Люголем, на зображеннях мікро-КТ. Результати зіставлених зображень мікро-КТ та гістологічних зображень показані на малюнках 4 та 5, підтверджуючи якість протоколу фарбування.

Об'ємна мікро-КТ оцінка
Крім того, сегментовані залишки пульпи після підготовки кореневого каналу були кількісно оцінені та виражені у відсотковому значенні. Об'єм інструментованого кореневого каналу та неінструментовані ділянки каналу, отримані за допомогою методу мікро-КТ, також були кількісно оцінені (Таблиця 1) та проілюстровані на малюнках 6 і 7 та Додатковому відео 1. Об'єм кореневого каналу та співвідношення сторін безпосередньо впливали на видалення пульпового тканини під час інструментації. Зуби зі значеннями співвідношення сторін менше 3.5, виражені графічною кривою та великими об'ємами, були пов'язані з меншими об'ємами залишків пульпового тканини.
Обговорення
Ця комунікація представляє новий метод фарбування для тканини зубного пульпи в контексті мікро-КТ оцінки очищення кореневих каналів з очевидними корисними застосуваннями для майбутніх досліджень у цій галузі. Запропонований недеструктивний метод здатний забезпечити зображення високої роздільної здатності та 3D інформацію про тканину пульпи та дентин одночасно, що дозволяє проводити поздовжню та кількісну об'ємну оцінку процедур очищення та формування кореневих каналів. Оскільки Гісі та Розе (1894) опублікували перші високоякісні фотомікрофотографії, що зображують деталі судинних, лімфатичних та нервових елементів пульпо-дентинного комплексу нижнього моляра, а Келлікер (1852) надав перший опис зубного пульпи, названого ним Pulpa dentis, у своїй класичній книзі про мікроскопічні структури тканин та органів тіла, багато досліджень вивчали зуби, використовуючи гістологічні методи. Використовуючи цю техніку, Хаттон та ін. (1928) були першими, хто продемонстрував, що канал був очищений лише поверхнево, і велика частина тканини пульпи не була видалена після підготовки нержавіючими інструментами. Однак лише після того, як Уолтон (1976) опублікував знакове дослідження, оцінюючи кількість залишкової тканини пульпи після процедур очищення та формування, гістологічне секціонування на основі парафіну стало стандартним методом для визначення ефективності процедур очищення в просторі кореневого каналу.
У цілих зубах з життєздатними пульпами, які зазвичай використовуються як контроль у гістологічних дослідженнях, пульпова тканина прикріплена до всього периметра кореневого каналу (De-Deus et al. 2010, 2011), тоді як залишки тканини в експериментальних групах підтверджують, які ділянки стінок каналу не були механічно очищені або де протоколи зрошення були неефективними. Оскільки залишки пульпи можуть служити субстратом для бактерій і можуть негативно впливати на якість процедур заповнення каналу (Ricucci et al. 2009, Ricucci & Siqueira 2011), це теоретично підтримує цю експериментальну змінну, залишкову пульпову тканину, як прийнятну заміну для оцінки якості процедур очищення в просторі кореневого каналу. Однак процеси та відповідне навантаження для підготовки зразків, що включає секціювання, фарбування, зображення та фінальну комплексну гістологічну оцінку, залишаються громіздкою та трудомісткою технікою. Зокрема, у контексті ендодонтичних лабораторних досліджень, декальцинація мінералізованих зубних тканин є трудомістким і складним етапом, і важко досягти високоякісних зразків без пошкодження пульпової тканини. Це стає ще більш важливим, оскільки, в загальному, гістологічне секціювання декальцинованих твердих тканин схильне викликати значні спотворення тканин, збої в обробці та структурні артефакти. Наприклад, зменшення обсягу тканини до 3% відбувається з кістковими тканинами (Lane & Ráliš 1983, Henson et al. 1994), тоді як зневоднення м'якої тканини може створити зменшення до 11% (Rown et al. 2002). Таким чином, навіть з корисними даними, доступними в літературі з цієї теми, варто зазначити, що кількісні дані мікроскопії з гістологічного секціювання були отримані з тканин, які, ймовірно, зменшилися під час підготовки зразків. Більше того, техніки гістологічного секціювання неминуче призводять до втрати зразків, що робить неможливими довгострокові експерименти з часом. Отже, гістологію можна вважати архаїчним методом у порівнянні з об'ємним та кількісним підходом, досягнутим за допомогою недеструктивних методів зображення (Таблиця 2), хоча на сьогодні це залишається єдиною доступною експериментальною моделлю, яка дозволяє одночасну оцінку як мінералізованих твердих, так і м'яких тканин зубів на їх ультраструктурному рівні і, відповідно, здатна пролити світло на цю важливу область досліджень (De-Deus et al. 2008, 2010, 2011).
Кілька досліджень, що використовують недеструктивну технологію мікро-КТ, продемонстрували, що підготовка стінок кореневих каналів ендодонтичними інструментами, активованими в ротаційному або рециркуляційному русі, не є ідеальною (Paqué et al. 2010, Paqué & Peters 2011, Versiani et al. 2013, De-Deus et al. 2015, Zuolo et al. 2018).
Механічна підготовка цими інструментами обмежена, оскільки вони, як правило, обробляють лише центральні аспекти кореневих каналів, щоб створити круглу форму, залишаючи більшість щічних і язикових розширень цих складних просторів неушкодженими, навіть при спробах бічних рухів, таких як при використанні руху щітки (Paqué et al. 2010, Paqué & Peters 2011, Versiani et al. 2013, De-Deus et al. 2015, Zuolo et al. 2018).
Хоча мікро-КТ може надати цінні та точні вимірювання щодо положення та кількості дентину, видаленого під час підготовки каналу, він не надає інформації про пульпову тканину або мікробні біоплівки, які можуть залишатися прикріпленими до стінок кореневих каналів, особливо в областях, недоступних для механічної дії інструментів, таких як істмуси, плавники, анастомози та додаткові канали (Versiani et al. 2013). Це означає, що мікро-КТ в основному обмежений оцінкою змін дентинових стінок, оскільки, по суті, мікро-КТ не підходить для зображення м'яких тканин, оскільки вони практично є «прозорими» для рентгенівських променів. Це обмеження пов'язане з нездатністю цього рентгенографічного методу, розробленого для зображення щільніших елементів, таких як кальцій, виявляти нерадіолюцентні м'які тканини (Rüegsegger et al. 1996). Однак було досягнуто значного прогресу в дослідженнях на основі мікро-КТ в інших біомедичних областях, включаючи різні типи настільних сканерів, захоплення інформації з фазовим контрастом, більш швидкі та ефективні протоколи отримання сканів і алгоритми реконструкції. У сукупності такі розробки можуть бути використані для зображення м'яких (некальцифікованих) тканин, подолавши їх вроджене обмеження. Для цього можна досягти специфічного підвищення візуалізації м'яких тканин, використовуючи рентгеноконтрастні контрастні агенти для досягнення атенуації рентгенівських променів, так звану техніку мікро-КТ з підвищеним контрастом (CE-CT). Коротко кажучи, CE-CT підходить для оцінки гетерогенних тканин, таких як зуби.
Контрастні агенти складаються з специфічних хімічних агентів з високою молекулярною вагою, здатних природно зв'язуватися з м'якими тканинами, щоб створити «контраст» ефективним способом. Контрастним агентом, використаним у даному дослідженні, був неорганічний йод Люголя (I2KI), який вперше був представлений Метшером (2009a), який протестував кілька протоколів фіксації зразків та потенціал фарбування кількох комерційно доступних сполук для ряду типів м'яких тканин. На сьогоднішній день було продемонстровано, що йод Люголя має високу афінність до глікогену (Феннерті 1999) і націлюється на епітеліальні клітини та м'які тканини миші (Дегенгардт та ін. 2010, Баверсток та ін. 2013). Таким чином, потенціал йоду Люголя для отримання зображень пульпної тканини за допомогою мікро-КТ був протестований у даному дослідженні. Через серію випробувань з різними протоколами імпрегнації, зуби з традиційними доступними порожнинами, зануреними в розчин Люголя на 7 днів, дозволили ефективну імпрегнацію пульпної тканини (Рисунки 3 і 7). Однак два аспекти, що стосуються використання методу CE-CT для аналізу залишків пульпи в довгостроковій перспективі після іригації кореневих каналів розчином NaOCl, можуть викликати занепокоєння. Перший аспект стосується хімічної реакції NaOCl з йодом розчину Люголя. Незважаючи на цю взаємодію, розчин Люголя не зменшив значно протеолітичну здатність NaOCl за поточних умов. Друге занепокоєння полягало в потенціалі NaOCl зменшити ступінь контрасту, пов'язану з імпрегнованою пульпною тканиною Люголем. Тест на радіопрозорість показав, що розчин Люголя підходить для імпрегнації пульпної тканини, оскільки NaOCl не заважав його радіопрозорості. У сукупності ці результати підтвердили, що розчин Люголя можна використовувати як контрастний агент для тестування пульпної тканини як субстрату для аналізу протоколів іригації на основі NaOCl. Подальший аналіз був зосереджений на валідації розчину Люголя в правильній ідентифікації пульпної тканини. Для цього було використано гістологічне секціонування на основі парафіну, щоб підтвердити, чи була пульпна тканина, імпрегнована розчином Люголя, видима на мікро-КТ знімках. Потім був розроблений експериментальний підхід для порівняння гістологічних зрізів з відповідними зображеннями, отриманими з мікро-КТ стеків, подолавши типові проблеми вирівнювання в цьому типі кореляційного аналізу. Результати підтвердили правильну ідентифікацію пульпної тканини на мікро-КТ зображеннях, імпрегнованих Люголем, і таким чином довели якість протоколу імпрегнації (Рисунки 4 і 5).
Варто зазначити, що, особливо для ендодонтичних досліджень, які використовують залишкову пульпову тканину як параметр результату, підхід CE-CT має явну перевагу, оскільки не зосереджується на ультраструктурній детальній оцінці м'якої тканини. Натомість CE-CT легко дозволяє кількісну оцінку залишкової пульпової тканини в цілому в довгострокових (протягом часу) експериментах (Рисунки 6 і 7). З якісної точки зору, сотні зрізів, отриманих на зубі за допомогою CE-CT, можуть забезпечити краще розуміння тісного зв'язку між внутрішньою анатомією кореневих каналів та механічними формуваннями і іригаційними протоколами. Це пов'язано з тим, що CE-CT надає 3D моделі високої роздільної здатності, які містять правдиву інформацію про розміри, структурну кількісну оцінку та анатомічні особливості гетерогенних тканин, таких як дентин і пульпова тканина. Водночас цей метод дозволяє оцінити преоперативний розподіл пульпової тканини по всьому канальному простору перед експериментальними процедурами навіть після 7 днів без будь-якого протоколу фіксації. Це важливий момент, оскільки кількість і розташування пульпової тканини можуть діяти як фактор, що спотворює результати, впливаючи на результати експерименту. Таким чином, використання методу CE-CT у зубах з життєздатними пульпами здається дійсним і відтворювальним, оскільки пульпова тканина була розподілена по всій системі кореневих каналів у всіх здорових зубах. Майбутні дослідження, що використовують цей інноваційний метод, повинні включати порівняння різних іригаційних розчинів (інертні проти активних розчинів) з часом та протоколів підготовки щодо ефективності розчинення/видалення пульпової тканини з систем кореневих каналів. Подальші вдосконалення цього методу також дозволять його застосування в in vivo дослідженнях з використанням CBCT, наприклад. На даний момент, ця методологія вимагає, щоб контрастна речовина була в контакті з пульповою тканиною щонайменше 7 днів, а в in vivo підході також вимагатиме пре- та постоперативної томографічної візуалізації, що, безумовно, повинно відповідати прийнятним етичним принципам дослідження. Безумовно, поточний протокол повинен бути валідаційований in vivo з використанням CBCT. З іншого боку, його можна безпечно застосовувати in vivo за допомогою некаріозних і нереставрованих зубів з життєздатними пульпами, запланованими на видалення, без пре- або постоперативних сканувань. Наприклад, після підтвердження життєздатного стану пульпи за допомогою звичайних тестів, хемомеханічний протокол може бути застосований in situ, а контрастний розчин введений у простір пульпового каналу, і корональна доступна порожнина відновлена, щоб забезпечити залишення розчину Люголя в просторі кореневого каналу. Потім зуб може бути видалений, збережений і оцінений за допомогою мікро-CT візуалізації через тиждень.
Отже, поточне дослідження зосереджене на наданні попередніх, але оригінальних доказів для підтримки недеструктивних довгострокових CE-CT досліджень, використовуючи залишкову пульпову тканину як параметр результату. Було продемонстровано, що CE-CT поєднує в одному методі основні переваги технології мікро-CT (оцінка мінералізованої тканини) та традиційних гістологічних методів (оцінка немінералізованої тканини) для вивчення процедур очищення кореневих каналів, охоплюючи можливість оцінки, ідентифікації та вимірювання тих ділянок каналу, які не підлягали механічній обробці або іригаційним протоколам. Варто зазначити, що CE-CT дозволяє вивчати механічну підготовку каналу та іригаційні протоколи незалежно або комбінований синергічний ефект хімічно-механічних процедур.
Висновки
Розчин Люголя дозволив візуалізацію пульпової тканини на зображеннях мікро-CT. Розчин Люголя не підлягав впливу NaOCl у своїй радіопрозорості і не заважав розчиненню фіксованих і забарвлених м'яких тканин. У практичному плані, техніка контрастно-посиленої мікро-CT візуалізації з розчином Люголя, представлена тут, дозволяє оцінювати ефект хімічного розчинення та механічного видалення пульпової тканини за допомогою процедур очищення та формування незалежно або разом, що робить її надзвичайно корисною технікою в лабораторних дослідженнях ендодонтії.
Автори: G. De-Deus, F. G. Belladonna, D. M. Cavalcante, M. Simões-Carvalho, E. J. N. L. Silva, J. C. A. Carvalhal, R. Q. Zamolyi, R. T. Lopes, M. A. Versiani, P. M. H. Dummer та M. Zehnder
Посилання:
- Alfaro DP, Ruse ND, Carvalho RM, Wyatt CC (2015) Оцінка внутрішньої відповідності коронок з літій-дисилікатів за допомогою мікро-КТ. Журнал протезування 24, 381–6.
- Baverstock H, Jeffery NS, Cobb SN (2013) Морфологія жувальної мускулатури миші. Журнал анатомії 223, 46–60.
- Cunha AC, Marquezan M, Lima I, Lopes RT, Nojima LI, Sant’Anna EF (2015) Вплив архітектури кістки на первинну стабільність різних дизайнів міні-імплантів. Американський журнал ортодонтії та дентально-фасіальної ортопедії 147, 45–51.
- De-Deus G, Reis C, Beznos D, Gruetzmacher-de-Abranches AM, Coutinho-Filho T, Pacionrik S (2008) Обмежена здатність трьох загальновживаних термопластичних технік гуттаперчі в заповненні овальних каналів. Журнал ендодонтії 34, 1401–5.
- De-Deus G, Barino B, Quintella Zamolyi R та ін. (2010) Підоптимальна якість дебридменту, що виникає внаслідок техніки однофайлового F2 ProTaper в овальних каналах. Журнал ендодонтії 36, 1897–900.
- De-Deus G, Souza EM, Barino B та ін. (2011) Саморегулюючий файл оптимізує якість дебридменту в овальних кореневих каналах. Журнал ендодонтії 37, 701–5.
- De-Deus G, Belladonna FG, Silva EJ та ін. (2015) Оцінка мікро-КТ неінструментованих ділянок каналу з різними розширеннями, виконаними системами NiTi. Бразильський стоматологічний журнал 26, 624–9.
- De-Deus G, Simões-Carvalho M, Belladonna FG та ін. (2020) Створення добре збалансованих експериментальних груп для порівняльних лабораторних досліджень ендодонтії: нова пропозиція на основі мікро-КТ та in silico методів. Міжнародний журнал ендодонтії 53, 974–85.
- Degenhardt K, Wright AC, Horng D, Padmanabhan A, Epstein JA (2010) Швидка 3D фенотипізація розвитку серцево-судинної системи у мишачих ембріонах за допомогою мікро-КТ з йодним фарбуванням. Циркуляція: кардіоваскулярна візуалізація 3, 314–22.
- Faulwetter S, Vasileiadou A, Kouratoras M, Dailianis T, Arvanitidis C (2013) Мікро-комп'ютерна томографія: введення нових вимірів у таксономію. ZooKeys 263, 1–45. Fedorov A, Beichel R, Kalpathy-Cramer J та ін. (2012) 3D
- Slicer як платформа обробки зображень для кількісної візуалізації. Магнітно-резонансна томографія 30, 1323–41.
- Fennerty MB (1999) Фарбування тканин. Клініки гастроінтестинальної ендоскопії Північної Америки 4, 297–311.
- Gignac PM, Kley NJ (2014) Мікро-КТ з підвищеним йодом: методологічні вдосконалення для вивчення анатомії м'яких тканин постембріонних хребетних. Журнал експериментальної зоології Частина B: Молекулярна та розвиткова еволюція 322, 166–76.
- Gysi A, Röse C (1894) Збірник мікрофотографій для ілюстрації мікроскопічної структури зубів людини. Мікрофотографії зубної гістології. Цюріх: Швейцарія.
- Hatton EH, Skillen WG, Moen OH (1928) Гістологічні знахідки в зубах з лікуваними та заповненими кореневими каналами. Журнал Американської стоматологічної асоціації 15, 56.
- Henson MM, Henson OW Jr, Gewalt SL, Wilson JL, Johnson GA (1994) Візуалізація кохлеї за допомогою магнітно-резонансної мікроскопії. Дослідження слуху 75, 75–80.
- Heimel P, Swiadek NV, Slezak P та ін. (2019) Візуалізація м'яких тканин з підвищеним йодом на прикладі регенерації периферичних нервів. Контрастні медіа та молекулярна візуалізація 2019, 1–15.
- Hertig G, Zehnder M, Woloszyk A, Mitsiadis T, Ivica A, Weber F (2017) Йодиксанол як контрастна речовина в фібриновому гідрогелі для ендодонтичних застосувань. Фронт у фізіології 8, 152.
- Kölliker VA (1852) Посібник з гістології людини, 1-е вид. Лейпциг: W. Engelmann, с. 405.
- Lacerda MFLS, Marceliano-Alves MF, P´erez AR та ін. (2017) Очищення та формування овальних каналів з 3 системами інструментування: кореляційне мікро-комп'ютерне томографічне та гістологічне дослідження. Журнал ендодонтії 43, 1878–84.
- Lane & Ráliš (1983) Зміни в розмірах великих спонгіозних кісткових зразків під час гістологічної підготовки, виміряні на плитах з людських стегнових голів. Міжнародна кальцинована тканина 35, 1–4.
- Metscher BD (2009a) Мікро-КТ для порівняльної морфології: прості методи фарбування дозволяють отримувати висококонтрастні 3D зображення різноманітних немінералізованих тваринних тканин. BMC фізіологія 9, 11.
- Metscher BD (2009b) Мікро-КТ для розвитку біології: універсальний інструмент для висококонтрастної 3D візуалізації на гістологічних розділах. Розвиткові динаміки 238, 632–40.
- Paqué F, Balmer M, Attin T, Peters OA (2010) Підготовка овальних кореневих каналів у нижніх молярах за допомогою ротаційних інструментів з нікель-титаном: дослідження мікро-комп'ютерної томографії. Журнал ендодонтії 36, 703–7.
- Paqué F, Peters OA (2011) Оцінка мікро-комп'ютерної томографії підготовки довгих овальних кореневих каналів у нижніх молярах за допомогою саморегулюючого файлу. Журнал ендодонтії 37, 517–21.
- Pauwels E, Van Loo D, Cornillie P, Brabant L, Van Hoorebeke L (2013) Дослідження контрастних агентів для візуалізації м'яких тканин за допомогою високоякісної рентгенівської комп'ютерної томографії. Журнал мікроскопії 250, 21–31.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR (2009) Гістологічне дослідження зубів, які пройшли лікування кореневих каналів з апікальною періодонтитом: ретроспективне дослідження двадцяти чотирьох пацієнтів. Журнал ендодонтії 35, 493–502.
- Ricucci D, Siqueira JF Jr (2011) Доля тканини в бічних каналах і апікальних розгалуженнях у відповідь на патологічні умови та лікувальні процедури. Журнал ендодонтії 36, 1–15.
- Rown MAB, Eed RBR, Enry RWH (2002) Вплив середовищ зневоднення та температури на загальний час зневоднення та усадку тканин. Журнал Міжнародного товариства за пластинацію 17, 28–33.
- Rüegsegger P, Koller B, Müller R (1996) Мікротомографічна система для неразрушаючої оцінки архітектури кістки. Міжнародна кальцинована тканина 58, 24–9.
- Siqueira JF Jr, Pérez AR, Marceliano-Alves MF та ін. (2018) Що відбувається з непідготовленими стінками кореневих каналів: кореляційний аналіз за допомогою мікро-комп'ютерної томографії та гістології/скануючої електронної мікроскопії. Міжнародний журнал ендодонтії 51, 501–8.
- Versiani MA, Leoni GB, Steier L та ін. (2013) Дослідження мікро-комп'ютерної томографії овальних каналів, підготовлених за допомогою саморегулюючого файлу, Reciproc, WaveOne та Pro-Taper універсальних систем. Журнал ендодонтії 39, 1060–6.
- Vogel AI (1978) Підручник з кількісного неорганічного аналізу, включаючи елементарний інструментальний аналіз. 4-е вид. Лондон: Longmans, Green and Co., Ltd. с. 925.
- Walton RE (1976) Гістологічна оцінка різних методів розширення простору пульпового каналу. Журнал ендодонтії 2, 304–11.
- Zehnder M (2006) Іригатори для кореневих каналів. Журнал ендодонтії 32, 389–98.
- Zuolo ML, Zaia AA, Belladonna FG та ін. (2018) Оцінка мікро-КТ здатності формування чотирьох систем інструментування кореневих каналів в овальних каналах. Міжнародний журнал ендодонтії 51, 564–71.
