Спрямована регенерація тканин
Машинний переклад
Оригінальна стаття написана мовою RU (посилання для прочитання) .
Вперше методику спрямованої регенерації застосували під час проведення лоскутної операції у 1982 році спеціалісти під керівництвом S. Nyman. Щоб запобігти в області оголеного ділянки кореня зрощення цементу з клітинами ясенного лоскута, а також для профілактики проростання епітеліальних клітин, застосували міліпорний фільтр. Даний фільтр поклали у проміжку між поверхнею коренів і слизово-надкістковим лоскутом, це забезпечило передумови для реконструкції пародонтального зв'язку.
Біологічні принципи спрямованої кісткової регенерації та види використовуваних мембран на вебінарі Резорбовані мембрани у спрямованій кістковій регенерації.
Зубоясенне прикріплення можна відтворити виключно з тканин пародонту оскільки останні здатні перетворюватися у цементобласти та гальмують ріст інших тканин. Якщо описану умову не дотримуватися, починають проростати тканини ясен, що веде за собою руйнування цементу кореня. Зубоясенне з'єднання може формуватися також у вигляді кісткового анкілозу завдяки тому, що тканини пародонтального зв'язку мають у своєму складі остеобласти-попередники – це клітини, які здатні диференціюватися в цементобласти та остеобласти, формувати шари цементу на поверхні кореня, тим самим беручи безпосередню участь у реорганізації зубоясенного з'єднання.
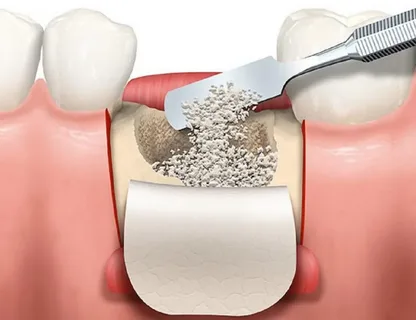
Малюнок 1. Остеопластичний матеріал насипають під мембрану.
Розмноження клітин відновлювальної пародонтальної зв'язки відбувається між поверхнею цементу та внутрішньою стороною мембрани. Завдяки експериментам, проведеним командою Nyman, було запропоновано абсолютно новий матеріал мембрани на основі політетрафлюоретилену та «Millipore». У майбутньому цей матеріал назвали «Gore-Tex».
Випускали мембрани різноманітних конфігурацій, що дозволяло досягти високого рівня фіксації їх у пришийкових областях зубів. Головний недолік матеріалу – це відсутність здатності до розсмоктування, це пояснює необхідність проведення повторного оперативного втручання, спрямованого тепер уже на вилучення мембрани.
Оскільки настання регенерації відбувається приблизно через 5-6 тижнів, після даного проміжку часу планується повторне хірургічне втручання.
Біодеградуючі мембрани з розсмоктувального матеріалу. В основі їх виробництва лежить застосування глікогенних і лактатних полімерів, вони не містять у своєму складі пластифікаторів, а в процесі гідролізу розпадаються на гліколеву та молочну кислоти. Склад їх включає колаген, який прискорює руйнування тромбоцитарних пластинок, стимулює утворення в кров'яних згустках зчеплення. Екзогенний колаген сприяє активізації хемотаксису фібробластів, прискорює утворення навколо них фібрилярних просторових структур.
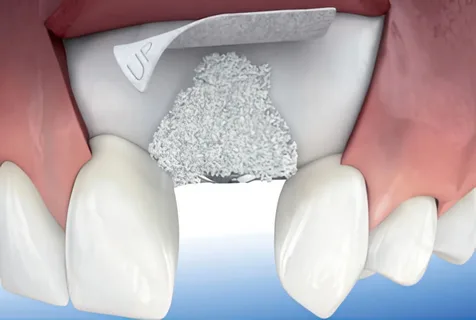
Малюнок 2. Укладання мембрани.
Якщо об'єднати в єдиному комплексі колагенову мембрану та матеріал, що містить кісткову добавку, це призведе до утворення крім сполучно-
тканинної структури, також молодої кісткової тканини, яка заповнить більше половини початкового дефекту. Розсмоктуються подібні мембрани протягом місяця, а коронкова їх область – вже протягом півтора тижнів. Таке стрімке розсмоктування обумовлене роботою тканинних ферментів. Для запобігання такого явища стали випускати двошарові мембрани, в яких колаген виступає у якості зовнішнього шару, а внутрішнє покриття містить наступні добавки:
- сульфат гепарину;
- фактор росту 1;
- фібрин, активізує розмноження клітин, що беруть участь у реконструкції пародонтального зв'язку.
Види мембран
Все розмаїття мембран можна поділити на дві групи:
- нерезорбовані,
- резорбовані.
Представником першої групи є GORETEX – політетрафторетиленовий матеріал. Структура його представлена порами, розмір яких становить приблизно 1 мк, у ці пори відбувається вростання сполучної тканини, що не дозволяє проростати уздовж поверхні кореня епітелію.
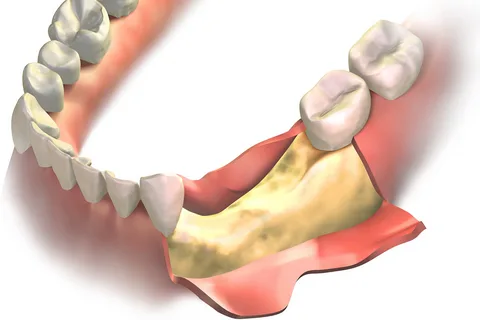
Малюнок 3. Відшарувався слизово-надкістяний клапоть.
Усі сучасні мембрани, щоб стимулювати формування органотипічної регенерації пародонтальних тканин, випускаються у вигляді пластинок із кількох шарів. Завдяки морфометричним та клінікогістологічним дослідженням розроблені бар'єри, які сприяють реорганізації опорного апарату зуба та мають передбачуваний ефект лікування.
Представник резорбованих мембран – матеріал RESOLUT, у його основі – сукупність глікогенних і лактатних полімерів, очікуваний терапевтичний ефект досягається протягом від 1 місяця до півтора.
Перелік матеріалів, що використовуються як роздільні мембрани, різноманітний. Оксидована целюлоза популярна для закриття фуркаційних та міжзубних дефектів, матеріал випускається не у вигляді мембрани, а представляє собою гомогенну масу. Після контакту целюлози з кров'янистою поверхнею, маса стає желатиноподібною, потім поступово розсмоктується, не залишаючи після себе токсичних продуктів.
Ще один популярний матеріал – це колагеноподібні хрящові мембрани, їх виробляють з оболонки сліпої кишки великої рогатої худоби, потім хромування, а далі застосовують окрім пародонтології, також у вигляді шовного матеріалу. Розсмоктування таких мембран спостерігається протягом 1-2 місяців, структура їх не допускає проростання клітин епітелію.
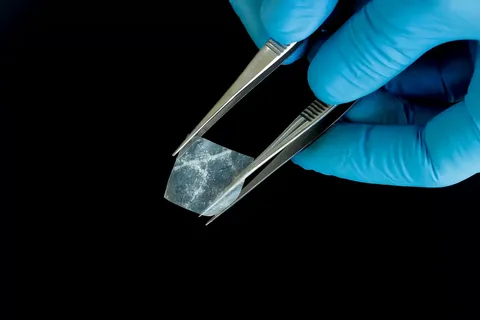
Малюнок 4. Приклад мембрани.
Використання у практиці хірургічної пародонтології мембран, виготовлених на основі біодеградуючого поліестеру, дозволило досягти вже протягом 4 тижнів після оперативного втручання відновлення зубодесневого з'єднання, а ще через 4 тижні формується молода кісткова тканина. Застосування даного матеріалу дозволило повністю заповнювати фуркаційні дефекти.
Мембрани Polyglactin 910, в їхній основі – вікрилова маса, утворена лактидом і гліколідом, співвідношення яких у масі становить 1:9. Матеріал отриманий штучним шляхом. М'які тканини регенерують у чотири рази ефективніше, ніж у представників контрольної групи. Значно зменшуються міжкореневі дефекти. Введення додаткових штучних кісткових добавок значно прискорює кісткову регенерацію.
Щоб збільшити ефективність хірургічного пародонтологічного лікування захворювань пародонту в якості матеріалу для мембранної технології була запропонована наделастична тканина, створена на основі нікеліду титану. Тканинний імплантат виробляється з найтоншої нікелід-титанової нитки, перетин якої не перевищує 50-60 мкм, клітинка тканини становить 10-100 мкм.
Переваги матеріалу
- відрізняється надзвичайною еластичністю,
- чудовою біохімічною сумісністю з навколишніми тканинами,
- високими біомеханічними властивостями.
За допомогою хірургічних ножиць з тканинного імплантату інтраопераційно вирізається шматочок мембрани необхідної в конкретній клінічній картині конфігурації, враховуючи топографію та розмір кісткового дефекту. Особливість матеріалу полягає в тому, що мембрана має пористу відкриту мікроструктуру, куди проростає сполучна тканина, надійно фіксується. Таким чином це з одного боку створює перешкоду для проростання епітелію, а з іншого боку не дозволяє йому ковзати уздовж, формуючи над мембраною кишеню. Дуже добре зарекомендували себе ці мембрани у складних клінічних випадках, коли висока ймовірність зсування мембрани всередину дефекту. Виробники рекомендують використовувати мембрану на основі нікеліду титану, щоб забезпечувати реконструкцію обширних кісткових дефектів.
Методика використання
Виділяється слизово-надкістяний лоскут для забезпечення доступу до дефекту кістки, його необхідно викраювати так, щоб він повністю, без натягу, покрив повністю поверхню мембрани над кістковим дефектом. Мембрану необхідно моделювати з запасом, щоб її краї перекривали дефект кістки на 4-5 мм. Для отримання стабільності підмембранного простору краї мембрани заправляються під надкістя.
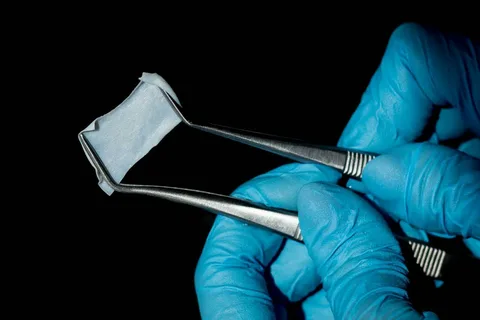
Рисунок 5. Мембрана на основі колагену.
Завдяки мікропористості матеріалу та шорсткості його поверхні мембрана надійно стабілізується над дефектом, так само як і лоскут над нею. Додатково фіксувати до краю кістки мембрану не потрібно. Для профілактики зміщення синтетичної тканинної мембрани всередину дефекту кістки простір під мембраною заповнюється різноманітними остеопластичними матеріалами.
Коли всі шари укладені, слизово-надкістяний клапоть укладають на місце, далі його зашивають вузловими або матрацними швами. Бажано для накладення швів вибрати шовний матеріал однойменний – це нитка, виготовлена з нікеліду титану. Зняття швів здійснюється через два тижні.
Особливості післяопераційного періоду: часті полоскання порожнини рота розчинами антисептиків, обмеження подразнюючої та твердої їжі.
Детальніша інформація з цієї теми на онлайн-курсі Направлена регенерація та навігаційна імплантація.
